Nhà sản xuất
Merck Sharp & Dohme
Thành phần
• Hoạt chất:
Liều 2mL có chứa các biến thể (bò-người) rotavirus G1, G2, G3, G4 và P1A[8]. Mức biến thể tối thiểu có trong một liều như sau:
G1 2,2 x 106 đơn vị gây nhiễm
G2 2,8 x 106 đơn vị gây nhiễm
G3 2,2 x 106 đơn vị gây nhiễm
G4 2,0 x 106 đơn vị gây nhiễm
P1A[8] 2,3 x 106 đơn vị gây nhiễm
Các biến thể này được cấy vào các tế bào Vero bằng các kỹ thuật nuôi cấy mô chuẩn mà không có chất chống nấm.
• Tá dược: Các biến thể vi-rút được tạo thành hỗn dịch trong dung dịch chất ổn định đệm. Mỗi liều vắc-xin đều có chứa sucrose, natri citrate, natri phosphate monobasic monohydrate, natri hydroxide, polysorbate 80 và môi trường nuôi cấy. Không có chất bảo quản hoặc thimerosal.
Dược lực học
Các týp huyết thanh (serotype) rotavirus ở người (G1, G2, G3, G4, và P1A[8]) đã được chọn lựa để sản xuất RotaTeq vì những chủng này gây ra trên 90% bệnh lý liên quan đến rotavirus tại Bắc Mỹ, Châu Âu và châu Úc; và trên 88% bệnh lý rotavirus trên toàn cầu vào những năm 1973-2003.
Hiệu quả
Hiệu quả bảo vệ của RotaTeq được đánh giá bằng 2 cách:
(1). Hiệu quả của RotaTeq trong phòng ngừa viêm dạ dày-ruột do rotavirus đã được đánh giá trên 6983 trẻ nhỏ dùng vắc-xin (n=3.484) hoặc giả dược (n=3.499) qua 2 nghiên cứu: Nghiên cứu hiệu quả và tính an toàn của Rotavirus (the Rotavirus Efficacy and Safety Trial REST) và nghiên cứu 007. Hiệu quả được đánh giá trên cơ sở xem xét hiệu quả đối với viêm dạ dày-ruột ở mức độ nặng bất kỳ do rotavirus và hiệu quả phòng viêm dạ dày-ruột mức độ nặng do rotavirus.
(2). Mức độ giảm số lần khám bệnh tại các cơ sở y tế do viêm dạ dày-ruột do rotavirus, bao gồm giảm số lần nhập viện điều trị nội trú và khám ngoại trú tại khoa cấp cứu, đã được đánh giá trên 68.038 trẻ nhỏ qua thử nghiệm REST và qua một nghiên cứu nhánh với 20.736 trẻ nhỏ trong nghiên cứu Mở rộng đoàn hệ ở người Phần Lan của REST. Những trẻ nhỏ được theo dõi trong vòng 2 năm sau khi chủng ngừa trong nghiên cứu REST và những trẻ nhỏ trong nghiên cứu Mở rộng được tiếp tục theo dõi trong vòng 3 năm sau khi chủng ngừa. Không thu thập dữ liệu về tính an toàn trong nghiên cứu Mở rộng. Tỷ lệ giảm của những lần trẻ nhỏ đi khám bệnh và số ngày phải nghỉ làm của cha mẹ/người giám hộ hợp pháp cũng được đánh giá trong REST.
Liều vắc-xin thứ ba hay giả dược được sử dụng cho trẻ nhỏ khi được 32 tuần tuổi. Chấp nhận cho sử dụng đồng thời các loại vắc-xin khác mà đã được phép sử dụng đối với trẻ nhỏ ngoại trừ vắc-xin ngừa bại liệt uống (oral poliovirus vaccine: OPV) đối với tất cả nghiên cứu Pha III.
Hiệu quả phòng viêm dạ dày-ruột ở mức độ nặng bất kỳ do các rotavirus trong tự nhiên cùng với các týp G (G1-G4) trong thành phần vắc-xin gây ra là 73,8%, và hiệu quả đối với viêm dạ dày-ruột nặng do rotavirus là 98,2% trong suốt mùa dịch rotavirus đầu tiên sau khi dùng vắc-xin. RotaTeq cũng có hiệu quả bảo vệ đối với týp huyết thanh G không có trong thành phần của vắc-xin. Qua những dữ liệu còn hạn chế, hiệu quả phòng viêm dạ dày-ruột ở mức độ nặng bất kỳ do týp G (G9) không có trong vắc-xin là 74,1%. Hiệu quả của RotaTeq trong phòng viêm dạ dày-ruột ở bất kỳ mức độ nặng nào qua 2 mùa dịch rotavirus sau khi hoàn tất chủng ngừa là 71,3%.
RotaTeq làm giảm tỷ lệ nhập viện điều trị nội trú và khám ngoại trú tại khoa cấp cứu, số lần khám không phải cấp cứu và số ngày phải nghỉ làm của cha mẹ/người giám hộ hợp pháp của trẻ nhỏ. Tỷ lệ giảm số lần khám bệnh tại các cơ sở y tế (số lần nhập viện, cấp cứu) do týp huyết thanh G1-G4 trong REST và trong Nghiên cứu phối hợp mở rộng như sau:
- 94,4% số lần nhập viện điều trị nội trú và khám ngoại trú tại khoa cấp cứu (RotaTeq n = 34.035 trẻ nhỏ, giả dược n = 34.003 trẻ nhỏ);
+ 94,3% số lần nhập viện điều trị nội trú; và
+ 94,4% số lần khám ngoại trú tại khoa cấp cứu
Trong năm thứ 3 (RotaTeq n = 3.112 trẻ nhỏ, giả dược n = 3.126 trẻ nhỏ), số lần khám bệnh tại các cơ sở y tế do viêm dạ dày-ruột do rotavirus là 0 trong nhóm sử dụng vắc-xin và 1 trường hợp (không thể xác định được týp) trong nhóm sử dụng giả dược.
Số lần khám thông thường không phải cấp cứu và số ngày phải nghỉ làm của cha mẹ/người giám hộ hợp pháp của trẻ nhỏ được đánh giá trong vòng 2 năm sau khi chủng ngừa theo nghiên cứu REST. Mức độ giảm như sau:
- Giảm 86,0% số lần khám thông thường không phải cấp cứu (RotaTeq n = 2.834, giả dược n = 2.839 trẻ nhỏ); và
- Giảm 86,6% số ngày phải nghỉ làm của cha mẹ/người giám hộ hợp pháp của trẻ nhỏ (RotaTeq n = 34.035 trẻ nhỏ, giả dược = 34.003 trẻ nhỏ).
Hiệu quả của RotaTeq trong phòng viêm dạ dày-ruột do rotavirus qua cả mùa dịch rotavirus đầu tiên sau khi hoàn tất chủng ngừa và mức giảm số lần nhập viện điều trị nội trú và số lần khám ngoại trú tại khoa cấp cứu do viêm dạ dày-ruột do rotavirus cho đến 3 năm sau khi chủng ngừa týp G được trình bày trong bảng 1 sau đây.
- xem Bảng 1.

Hiệu quả giữa các liều
Hiệu quả bảo vệ của RotaTeq đối với tỷ lệ viêm dạ dày-ruột do rotavirus ở mức độ nặng bất kỳ do týp G1-G4 gây ra ở giữa các liều không có ý nghĩa thống kê. Kết quả này đánh giá dựa trên dữ liệu phân tích post hoc từ nghiên cứu lâm sàng đoàn hệ của REST (n = 5.673 trẻ nhỏ).
Hiệu quả bảo vệ của RotaTeq đánh giá qua sự giảm tỷ lệ nhập viện điều trị nội trú và khám ngoại trú tại khoa cấp cứu do viêm dạ dày-ruột do týp rotavirus G1-G4 gây ra ở giữa các liều của liệu trình 3 liều được đánh giá qua phân tích dữ liệu post hoc của REST (n = 68.038 trẻ nhỏ). Những kết quả của phân tích này được trình bày trong Bảng 2.
- xem Bảng 2.

Hiệu quả và An toàn trên trẻ thiếu tháng
RotaTeq hay giả dược đã được sử dụng trên 2070 trẻ thiếu tháng (tuổi thai từ 25 đến 36 tuần), trong đó có 1.007 trẻ sử dụng RotaTeq, theo thứ tự thời gian về tuổi trong một nghiên cứu có đối chứng giả dược. Trong một nghiên cứu nhánh trên 308 trẻ thiếu tháng để theo dõi về tất cả các tác dụng ngoại ý, so sánh về tính an toàn thấy tương tự như nhau ở nhóm trẻ dùng RotaTeq và nhóm trẻ dùng giả dược, Tỷ lệ sốt, ói mửa, tiêu chảy hay bứt rứt nói chung tương tự như nhau ở nhóm dùng vắc-xin và nhóm dùng giả dược.
Trong một nghiên cứu nhánh gồm 204 trẻ chủng ngừa (99 trẻ trong nhóm sử dụng vắc-xin), đánh giá hiệu quả bảo vệ dựa trên sự giảm tỷ lệ viêm dạ dày-ruột ở mức độ nặng bất kỳ do nhiễm týp rotavirus (G1-G4) trong thành phần vắc-xin, ít nhất 14 ngày sau liều 3, qua mùa dịch thứ nhất sau khi chủng ngừa, là 70,3 % [95 % CI < 0; 94,7]. Trong số 2070 trẻ chủng ngừa (1007 trẻ sử dụng vắc-xin) trong nghiên cứu REST, đánh giá hiệu quả bảo vệ dựa trên tỷ lệ giảm các trường hợp viêm dạ dày-ruột phải nhập viện và khám bệnh cấp cứu do týp G1-G4 sau khi chủng liều 3 từ 14 ngày cho đến 2 năm sau là 100% [95 % CI 74, 100]. Tương tự, hiệu quả bảo vệ được đánh giá qua sự giảm tỷ lệ nhập viện điều trị nội trú và khám ngoại trú tại khoa cấp cứu do viêm dạ dày-ruột do týp huyết thanh bất kỳ từ ngày thứ 14 cho đến 2 năm sau liều 3 là 100% [95% CI 82, 100].
Nghiên cứu với vắc-xin khác
Tính sinh miễn dịch của RotaTeq và vắc-xin bạch hầu, uốn ván, ho gà (DTaP); vắc-xin vi-rút bại liệt bất hoạt (IPV), vắc-xin cộng hợp Haemophilus influenzae týp b (Hib), vắc-xin viêm gan B, và vắc-xin cộng hợp phế cầu khuẩn đã được đánh giá trên 1.358 trẻ nhỏ. Đáp ứng miễn dịch đối với những vắc-xin trên không bị ảnh hưởng bởi RotaTeq. Thêm vào đó, những nghiên cứu trên cho thấy hiệu quả của RotaTeq (89,5%) khi dùng đồng thời với các vắc-xin trên.
Sử dụng đồng thời RotaTeq và vắc-xin ngừa bại liệt uống (OPV) không ảnh hưởng đến đáp ứng miễn dịch của kháng nguyên bại liệt trong một nghiên cứu kiểm soát trên 735 trẻ nhỏ đã được chủng ngừa. Mặc dù dùng đồng thời OPV làm giảm một vài đáp ứng miễn dịch với RotaTeq, tỷ lệ chuyển đổi huyết thanh (gấp ≥ 3 lần so với khởi điểm) đối với lgA huyết thanh là > 93%. Có bằng chứng cho thấy mức độ hiệu quả cao chống lại viêm dạ dày-ruột nặng do rotavirus được duy trì. Đáp ứng miễn dịch đối với RotaTeq không bị ảnh hưởng nếu OPV được dùng hai tuần sau RotaTeq.
Tính an toàn, bao gồm tỷ lệ sốt, ói mửa, tiêu chảy, bứt rứt, thường tương đương ở các đối tượng sử dụng những vắc-xin chỉ định đồng thời với RotaTeq và những đối tượng sử dụng những vắc-xin chỉ định đồng thời với giả dược.
Trong một nghiên cứu gồm 7.367 trẻ nhỏ sử dụng vắc-xin lục giá (hexavalent) (DTaP, IPV, HIB, và viêm gan B) đồng thời với vắc-xin RotaTeq. Tỷ lệ tác dụng ngoại ý nghiêm trọng (serious adverse experiences: SAEs), không kể có liên quan với vắc-xin hay không, là 2,9% ở nhóm dùng RotaTeq và 3,2% ở nhóm dùng giả dược. Các thông tin chi tiết hơn về tính an toàn đã được đánh giá trong một nghiên cứu nhánh trên 638 trẻ nhỏ dùng RotaTeq đồng thời với vắc-xin lục giá. Tính an toàn, bao gồm tỷ lệ sốt, ói mửa, tiêu chảy, bứt rứt, thường tương đương ở các đối tượng dùng vắc-xin lục giá cùng với RotaTeq và những đối tượng sử dụng vắc-xin lục giá cùng với giả dược.
Trong một nghiên cứu nhãn mở, ngẫu nhiên, so sánh, đa trung tâm đánh giá tính sinh miễn dịch và tính an toàn của việc sử dụng đồng thời RotaTeq và một vắc xin liên hợp meningococcal nhóm C thực hiện trên 246 trẻ nhỏ khỏe mạnh. Việc sử dụng đồng thời này không ảnh hưởng trên đáp ứng miễn dịch với cả hai loại vắc-xin và cả hai loại vắc-xin đều được dung nạp tốt.
Tính sinh miễn dịch
Cơ chế miễn dịch bảo vệ của RotaTeq đối với rotavirus trong phòng ngừa viêm dạ dày-ruột chưa rõ. Chưa rõ có mối tương quan giữa đáp ứng kháng thể với RotaTeq và khả năng bảo vệ chống lại viêm dạ dày-ruột do rotavirus hay không. Tuy nhiên, RotaTeq kích thích sinh kháng thể trung hòa týp G1, G2, G3, G4 và P1A[8] ở người. Trong những nghiên cứu pha III, từ 92,9% đến 100% cá thể sử dụng RotaTeq đã đạt được nồng độ IgA tăng cao đáng kể trong huyết thanh sau liệu trình 3 liều.
Dược động học
Việc đánh giá của các nghiên cứu dược động học không đòi hỏi cho các vắc-xin.
Độc tính
Một nghiên cứu độc tính học đường uống liều duy nhất và liều lặp lại trên chuột cho thấy không có mối nguy hiểm đặc biệt cho con người. Liều dùng trên chuột khoảng 2,79 x 108 đơn vị gây nhiễm/kg (cao hơn gấp khoảng 14 lần liều lượng cho trẻ nhỏ dự kiến).
Chỉ định/Công dụng
RotaTeq là một vắc-xin ngũ giá dùng đường uống, chỉ định cho phòng ngừa viêm dạ dày-ruột do rotavirus ở trẻ nhỏ gây ra bởi các týp vi-rút G1, G2, G3, G4 và các týp vi-rút G có chứa P1A[8] (ví dụ như G9). RotaTeq có thể dùng từ khi trẻ được 7,5 tuần tuổi.
Liều lượng & Cách dùng
CHỈ DÙNG ĐƯỜNG UỐNG, KHÔNG DÙNG ĐƯỜNG TIÊM.
Mỗi lịch trình đầy đủ của vắc-xin bao gồm ba liều dung dịch RotaTeq pha sẵn dùng được ngay theo đường uống cho trẻ nhỏ.
Cần cho trẻ uống liều RotaTeq đầu tiên khi trẻ được khoảng 7,5-12 tuần tuổi; những liều tiếp theo cần được sử dụng cách nhau tối thiểu 4 tuần. Liều thứ ba cần được hoàn thành trước khi trẻ được 32 tuần tuổi.
Không có hạn chế nào về chế độ ăn và uống của trẻ, kể cả sữa mẹ, dù trước hay sau khi dùng RotaTeq.
RotaTeq có thể dùng cho trẻ sinh thiếu tháng căn cứ trên tuổi đời của trẻ.
Nếu vì bất cứ lý do nào mà liều dùng không được đủ (ví dụ trẻ bị trớ hoặc nhổ ra), thì không nên dùng liều khác để thay, do việc thay liều khác như vậy chưa được nghiên cứu lâm sàng. Trẻ cần tiếp tục dùng các liều còn lại trong lịch trình khuyến cáo.
Vắc-xin cần được dùng đường uống mà không trộn với bất kỳ dung dịch hay vắc-xin nào khác. Không được pha loãng hay cho thêm nước.
Mỗi liều được đóng trong một hộp trong đó có chứa tuýp định liều có thể bóp được, tuýp làm bằng plastic không có latex, có nắp vặn rời, để có thể dùng uống trực tiếp. Tuýp định liều được để trong một túi.
Để sử dụng vắc-xin
Xé túi để lấy tuýp ra
Giữ tuýp thẳng đứng và gõ nhẹ đầu ống để dung dịch xuống hết khỏi đầu tuýp.
Mở tuýp định liều bằng hai động tác đơn giản:
- Vặn nắp theo chiều kim đồng hồ cho tới khi thật chặt
- Vặn nắp rời ra bằng cách xoay ngược chiều kim đồng hồ.
Cho trẻ dùng bằng cách bóp nhẹ tuýp cho dung dịch vào miệng trẻ ở phần má trong cho tới khi tuýp hết dung dịch. (Có thể còn một giọt ở đầu tuýp.)
Bỏ tuýp rỗng và nắp vào trong thùng rác sinh học theo đúng quy chế.
Dùng cùng với các vắc-xin khác
RotaTeq có thể dùng chung với các vắc-xin bạch hầu, biến độc tố uốn ván và vắc-xin ho gà vô tế bào (DTaP), vắc-xin vi-rút bại liệt bất hoạt (IPV), vắc-xin cộng hợp Haemophilus influenzae týp b, vắc-xin viêm gan B, vắc-xin cộng hợp phế cầu khuẩn và các vắc-xin lục giá.
Việc sử dụng đồng thời RotaTeq với vắc-xin vi-rút bại liệt bất hoạt hoặc vắc-xin ngừa bại liệt uống (IPV hoặc OPV) không ảnh hưởng đến đáp ứng miễn dịch đối với kháng nguyên vi-rút bại liệt. Mặc dù dùng đồng thời OPV có thể làm giảm một phần các đáp ứng miễn dịch đối với vắc-xin rotavirus, có bằng chứng là hiệu quả chống lại viêm dạ dày-ruột nặng do rotavirus được duy trì ở mức độ cao. Các đáp ứng miễn dịch đối với RotaTeq không bị ảnh hưởng khi OPV được dùng hai tuần sau RotaTeq.
Quá Liều
Đã có những báo cáo về dùng RotaTeq quá liều khuyến cáo. Nói chung, các tác dụng bất lợi được báo cáo khi dùng quá liều cũng tương tự như khi dùng các liều đơn RotaTeq theo khuyến cáo.
Chống chỉ định
Mẫn cảm với bất cứ thành phần nào của vắc-xin.
Những trẻ xuất hiện các triệu chứng giống mẫn cảm sau khi dùng một liều RotaTeq thì không nên dùng các liều RotaTeq tiếp theo.
Những trẻ bị suy giảm miễn dịch kết hợp trầm trọng (SCID). Đã có báo cáo về trường hợp viêm dạ dày ruột khi dùng vắc-xin ở trẻ bị suy giảm miễn dịch kết hợp trầm trọng.
Sử dụng ở phụ nữ có thai và cho con bú
Phụ nữ có thai: RotaTeq là vắc-xin dùng cho trẻ em và không có chỉ định dùng cho người lớn. Chưa có nghiên cứu đầy đủ, có đối chứng ở phụ nữ hoặc động vật.
Phụ nữ cho con bú: RotaTeq là vắc-xin dùng cho trẻ em và không có chỉ định dùng cho người lớn, không có thông tin về tính an toàn của vắc-xin khi sử dụng trong thời kỳ cho con bú.
Tương tác
Đến nay chưa thấy có tương tác thuốc nào (Xem Liều lượng & Cách dùng, Sử dụng với các vắc-xin khác).
Tác dụng ngoại ý
71.725 trẻ nhỏ đã được đánh giá trong 3 thử nghiệm lâm sàng đối chứng placebo (giả dược), trong đó có 36.165 trẻ được dùng RotaTeq và 35.560 trẻ được dùng giả dược. Cha mẹ/người giám hộ được liên hệ vào ngày thứ 7, 14 và 42 sau mỗi liều dùng để hỏi về hiện tượng lồng ruột và bất kỳ tác dụng phụ nghiêm trọng nào khác.
Vắc-xin nhìn chung được dung nạp tốt.
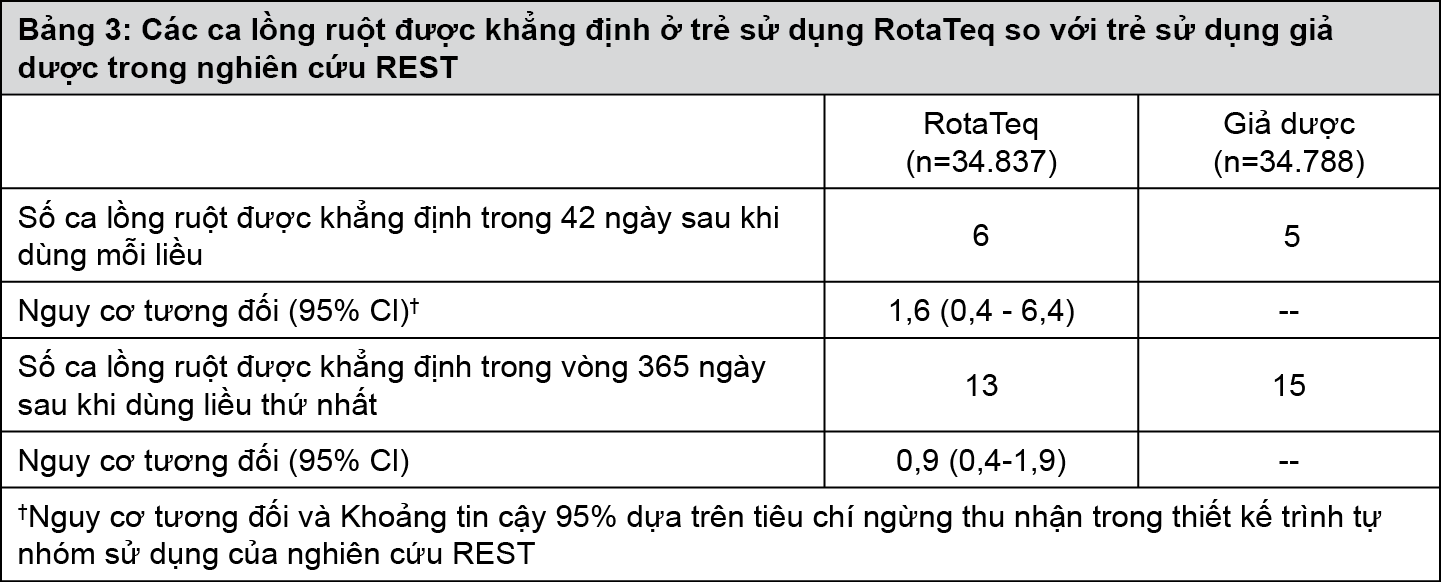
Trong Thử nghiệm về An toàn và Hiệu quả Ngừa Rotavirus (REST) có đối chứng giả dược với quy mô lớn (34.837 trẻ dùng vắc-xin và 34.788 trẻ dùng giả dược), RotaTeq không làm tăng nguy cơ lồng ruột tương đối so với giả dược (xem Bảng 3). Giám sát tích cực được tiến hành để xác định các ca lồng ruột tiềm tàng ở ngày thứ 7, 14 và 42 sau mỗi liều sử dụng và cứ 6 tuần một lần trong vòng 1 năm sau khi dùng liều thứ nhất. Không có ca lồng ruột nào được khẳng định trong 42 ngày đầu sau khi dùng liều thứ nhất, và hiện tượng lồng ruột không tập trung vào bất kỳ nhóm nào trong số trẻ dùng vắc-xin vào bất kỳ thời điểm nào sau bất kỳ liều vắc-xin nào. Trong giai đoạn 1 năm theo dõi về an toàn, chỉ có 4 trường hợp bị lồng ruột được báo cáo trong nhóm trẻ sử dụng giả dược trong nghiên cứu.
- xem Bảng 3.
Bệnh Kawasaki đã được báo cáo trong các thử nghiệm lâm sàng giai đoạn III < 0,1% (5/36, 150) ở các cá thể tiếp nhận vắc-xin và < 0,1% ở những người tiếp nhận giả dược trong vòng 42 ngày sau bất kỳ liều nào (không có ý nghĩa thống kê).
Trong số 11.711 trẻ (6.138 trẻ dùng RotaTeq) từ 3 nghiên cứu, trong đó cha mẹ/người giám hộ của trẻ được sử dụng một Thẻ Báo cáo Tiêm chủng để ghi lại nhiệt độ và hiện tượng tiêu chảy và nôn hàng ngày của trẻ trong tuần đầu sau mỗi liều vắc-xin. Bảng 4 tóm tắt tần suất của các sự kiện bất lợi không tính đến nguyên nhân.
- xem Bảng 4.

Cha mẹ/người giám hộ của 11.711 trẻ cũng được yêu cầu báo cáo về các sự kiện bất lợi khác trên Phiếu báo cáo tiêm chủng trong 42 ngày sau mỗi liều sử dụng. Những trải nghiệm bất lợi có liên quan đến vắc-xin sau đây được thấy xuất hiện với tần suất cao hơn ít nhất là 0,3% trong số những trẻ sử dụng RotaTeq so với trẻ dùng giả dược.
Rất thường gặp (≥ 1/10); Thường gặp (≥ 1/100, < 1/10); Không thường gặp (≥ 1/1000, < 1/100); Hiếm gặp (≥ 1/10.000, < 1/1000); Rất hiếm gặp (< 1/10.000).
Bệnh nhiễm khuẩn và ký sinh trùng: Không thường gặp: Viêm mũi họng (0,6% ở trẻ dùng vắc-xin; 0,3% ở trẻ dùng giả dược).
Bệnh lý dạ dày-ruột: Rất thường gặp: Tiêu chảy (17,6% ở trẻ dùng vắc-xin; 15,1% ở trẻ dùng giả dược), nôn (10,1% ở trẻ dùng vắc-xin, 8,2% ở trẻ dùng giả dược).
Bệnh lý toàn thân và bất thường tại chỗ: Rất thường gặp: Sốt (20,9% ở trẻ dùng vắc-xin; 18,7% ở trẻ dùng giả dược).
Các tác dụng bất lợi khác
Về tổng thể, viêm tai giữa và co thắt phế quản xảy ra nhiều hơn ở trẻ dùng vắc-xin so với trẻ dùng giả dược (tương ứng là 14,5% so với 13,0% và 1,1% so với 0,7%); tuy nhiên, trong số những ca được coi là có liên quan đến vắc-xin theo quan điểm của các nhà nghiên cứu, thì tỷ lệ này tương tự nhau giữa trẻ dùng vắc-xin và dùng giả dược đối với viêm tai giữa (0,3%) và co thắt phế quản (< 0,1%).
Trong tất cả các thử nghiệm, có cho phép việc sử dụng các vắc-xin đã được lưu hành khác. Cả 3 nghiên cứu pha 3 có đối chứng giả dược đã đánh giá về tính an toàn của RotaTeq khi sử dụng đồng thời với các vắc-xin đã được phép lưu hành nêu ở trên, bao gồm vắc-xin Haemophilus influenzae týp b và viêm gan B, vắc-xin bạch hầu, biến độc tố uốn ván và vắc-xin ho gà vô tế bào (DTaP), vắc-xin vi-rút bại liệt bất hoạt (IPV), vắc-xin cộng hợp phế cầu khuẩn và các vắc-xin lục giá.
Một nghiên cứu có đối chứng tiến hành sau đó đã đánh giá về tính an toàn của RotaTeq khi dùng cùng với vắc-xin ngừa bại liệt uống. RotaTeq được dung nạp tốt; tần suất các trải nghiệm bất lợi quan sát được nhìn chung tương tự như ở nhóm chứng.
Các báo cáo sau khi đưa sản phẩm ra thị trường
Những dấu hiệu bất lợi sau đây được tự động báo cáo sau khi RotaTeq được phép lưu hành trên thị trường. Vì những trải nghiệm này đã được báo cáo tự nguyện từ một quần thể có kích cỡ không xác định, nên không thể ước lượng một cách đáng tin cậy tần xuất của chúng hoặc cho rằng chúng có liên quan tới việc sử dụng vắc-xin.
Các rối loạn da và mô dưới da: Chứng mày đay.
Bệnh lý dạ dày ruột: Viêm dạ dày ruột khi dùng vắc-xin ở trẻ bị suy giảm miễn dịch kết hợp trầm trọng (SCID).
Nghiên cứu giám sát an toàn sau khi đưa sản phẩm ra thị trường
Trong một nghiên cứu quan sát tiền cứu sau khi sản phẩm được đưa ra thị trường thực hiện bằng cách sử dụng một lượng lớn cơ sở dữ liệu y tế tuyên bố, các nguy cơ của lồng ruột, bệnh Kawasaki ở những lần khám tại khoa cấp cứu hoặc nhập viện trong 30 ngày sau bất cứ liều vắc-xin được phân tích trong số 85.150 trẻ nhỏ nhận được một hoặc nhiều liều RotaTeq.
Biểu đồ y khoa đã được xem xét để xác nhận các chẩn đoán này. Ngoài ra, an toàn nói chung còn được theo dõi bởi rà soát điện tử các cơ sở dữ liệu hồ sơ tự động của tất cả các lần khám tại khoa cấp cứu và nhập viện. Nghiên cứu được một Ủy ban Giám sát an toàn bên ngoài đánh giá độc lâp.
Trong thời gian từ 0-30 ngày sau khi chủng ngừa, không có khác biệt có ý nghĩa thống kê về tỷ lệ của lồng ruột hoặc bệnh Kawasaki so với tỉ lệ cơ bản dự kiến.
Ngoài ra, không có sự tăng có ý nghĩa thống kê nguy cơ của những tác dụng bất lợi trong thời gian 0-30 ngày theo dõi khi so sánh 17.433 người-năm theo dõi ở các trẻ nhỏ sử dụng RotaTeq (n = 85.150) với 12.339 người năm theo dõi trong một nhóm chứng đồng thời trẻ nhỏ được sử dụng DTaP chứ không phải RotaTeq (n = 62.617).
Có 6 trường hợp ở nhóm trẻ chủng ngừa RotaTeq được xác nhận bị lồng ruột so với 5 trẻ trong nhóm chứng dùng vắc-xin DTaP (nguy cơ tương đối = 0,8, 95% CI: 0,22-3,52).
Có một trường hợp bệnh Kawasaki được xác định bằng biểu đồ y khoa trong số các trẻ được chủng ngừa bằng RotaTeq và một trường hợp bệnh Kawasaki được xác định bằng biểu đồ y khoa trong số các trẻ ở nhóm chứng được chủng ngừa với DTaP (nguy cơ tương đối = 0,7, 95% CI: 0,01-55,56). Trong các phân tích an toàn chung, Ủy ban Giám sát an toàn không nhận thấy bất kỳ mối quan ngại an toàn cụ thể nào.
Thận trọng
Chưa có các số liệu về tính an toàn và hiệu quả khi dùng RotaTeq cho:
(1). Người bệnh suy giảm chức năng miễn dịch, ví dụ như:
- Những người có u ác tính hoặc bị suy giảm miễn dịch do nguyên nhân khác;
- Những người đang được điều trị ức chế miễn dịch;
(2). Những người bị nhiễm HIV; hoặc
(3). Những người mới được truyền máu hoặc dùng sản phẩm từ máu, kể cả globumin miễn dịch, chưa quá 42 ngày.
Không thấy có chủng vắc-xin trong phân của một số ít trẻ được phát hiện có bệnh nặng sau khi đã tham gia nghiên cứu (ví dụ như bị xơ nang tụy, kém phát triển, ung thư, bệnh tim bẩm sinh, và bệnh giảm bạch cầu trung tính). Các cơ sở cung cấp dịch vụ y tế có thể cần cân nhắc những số liệu này khi đánh giá lợi ích và nguy cơ tiềm tàng của việc sử dụng RotaTeq cho trẻ nhỏ có bệnh nặng, nhưng cần lưu ý là gần như tất cả trẻ em đến 5 tuổi đều bị nhiễm rotavirus từ nguồn tự nhiên.
Trong các nghiên cứu lâm sàng, RotaTeq không sử dụng cho trẻ được biết là trong gia đình có người bị suy giảm chức năng miễn dịch. Trong những nghiên cứu này, RotaTeq được thải ra trong phân của 8,9% trẻ sử dụng vắc-xin, chủ yếu ở tuần đầu sau khi dùng liều thứ nhất, và có ở 1 trẻ (0,3%) sau liều thứ 3. Về lý thuyết có nguy cơ vắc-xin vi-rút sống có thể được truyền qua tiếp xúc cho những đối tượng không tiêm chủng. Vì thế, RotaTeq phải được sử dụng rất thận trọng cho những trẻ có tiếp xúc gần với người suy giảm chức năng miễn dịch, ví dụ như:
- Người có u ác tính hoặc suy giảm chức năng miễn dịch vì nguyên nhân khác; hoặc
- Người đang được điều trị ức chế miễn dịch.
Tuy nhiên, do hầu hết trẻ em cho đến khi lên 5 tuổi đều nhiễm rotavirus trong tự nhiên, nên việc tiêm chủng cho trẻ nhỏ có thể giúp giảm nguy cơ phơi nhiễm rotavirus trong tự nhiên cho những người suy giảm chức năng miễn dịch có tiếp xúc trực tiếp với trẻ. Các cơ sở cung cấp dịch vụ y tế cần đánh giá nguy cơ tiềm tàng và lợi ích của việc dùng RotaTeq cho trẻ nhỏ có tiếp xúc với người suy giảm chức năng miễn dịch.
Trẻ đang có bệnh đường dạ dày-ruột tiến triển, tiêu chảy mãn tính hoặc chậm phát triển hoặc có tiền sử lồng ruột hoặc bệnh lý ổ bụng bẩm sinh không được đưa vào các nghiên cứu. Có thể cân nhắc sử dụng RotaTeq một cách thận trọng đối với những trẻ này nếu như theo đánh giá của bác sỹ việc không sử dụng vắc-xin sẽ dẫn đến nguy cơ lớn hơn.
Có thể sử dụng RotaTeq muộn hơn trong trường hợp trẻ bị nhiễm khuẩn cấp hoặc sốt trừ khi theo đánh giá của bác sỹ nếu như không sử dụng vắc-xin sẽ dẫn đến nguy cơ lớn hơn. Sốt nhẹ và nhiễm khuẩn hô hấp trên ở thể nhẹ không phải là chống chỉ định đối với việc uống RotaTeq.
Cũng như bất kỳ vắc-xin nào, việc chủng ngừa bằng RotaTeq không đem đến kết quả bảo vệ hoàn toàn đối với tất cả những người sử dụng.
Mức độ bảo vệ khi chỉ dùng một hoặc hai liều RotaTeq không được nghiên cứu trong các thử nghiệm lâm sàng. Phân tích các dữ liệu của một nghiên cứu lâm sàng quy mô lớn cho thấy RotaTeq có hiệu quả giảm tỷ lệ nhập viện điều trị nội trú và khám ngoại trú tại khoa cấp cứu do viêm dạ dày-ruột trong suốt thời gian tiêm các loạt vắc xin liều 3 tính từ thời điểm 14 ngày sau khi tiêm liều 1.
Không có số liệu nghiên cứu lâm sàng về việc sử dụng RotaTeq sau khi đã phơi nhiễm rotavirus.
Dùng cho trẻ em:
RotaTeq đã được chứng minh là nhìn chung dung nạp tốt và có hiệu quả cao trong phòng ngừa viêm dạ dày-ruột do rotavirus khi sử dụng cho trẻ từ 6 tuần đến 32 tuần tuổi. (Xem Liều lượng & Cách dùng để biết lịch trình sử dụng).
Chưa có dữ liệu về tính an toàn và hiệu quả đối với trẻ dưới 6 tuần tuổi.
Bảo quản
Bảo quản và vận chuyển trong điều kiện lạnh ở 2°C đến 8°C. Tránh ánh sáng.
RotaTeq cần được sử dụng ngay sau khi lấy ra khỏi tủ bảo quản lạnh. Khi ở bên ngoài tủ bảo quản lạnh và nhiệt độ trong phòng không quá 25°C, có thể sử dụng vắc-xin trong vòng 48 giờ. Quá thời hạn đó, cần phải hủy vắc-xin trong các thùng rác sinh học theo đúng quy chế hiện hành.
Phân loại ATC
J07BH01
Trình bày/Đóng gói
Dung dịch uống: tuýp 2mL.
- Abacavir
- Abernil
- Abiiogran
- Acarbose
- ACC
- Acebutolol
- Acenocoumarol
- Acetate Ringer's
- Acetazolamide
- Acetylcystein
- Acetylsalicylic acid
- Aciclovir
- Acid acetylsalicylic
- Acid aminocaproic
- Acid ascorbic
- Acid boric
- Acid chenodeoxycholic
- Acid ethacrynic
- Acid folic
- Acid fusidic
- Acid iopanoic
- Acid ioxaglic
- Acid nalidixic
- Acid pantothenic
- Acid para-aminobenzoic
- Acid salicylic
- Acid tranexamic
- Acid valproic
- Acid zoledronic
- Acitretin
- Aclasta
- Aclon
- Actapulgite
- Actelsar
- Actelsar HCT
- Actemra
- Actilyse
- Acular
- Acupan
- Acuvail
- Acyclovir STADA
- Acyclovir STADA Cream
- Adalat
- Adenosin
- Adenosin Ebewe
- Adipiodon
- Advagraf
- Aerius
- Afinitor
- Agicarvir
- Agifovir-E
- Agilosart
- Agilosart-H
- Agimepzol
- Agimosarid
- Agimstan
- Agimstan-H
- Agiremid
- Agivastar
- Aibezym
- Air-X
- Alaxan
- Albendazol
- Albiomin
- Albumin
- Albumin người Grifols 20%
- Albuminar
- AlbuRx
- Albutein
- Alcuronium chloride
- Aldesleukin
- Alendronat
- Alertin
- Alfa-Lipogamma 600 Oral
- Alfuzosin hydrochlorid
- Algotra
- Alimemazin
- Alimta
- Allipem
- Allopurinol
- Allopurinol STADA
- Aloxi
- Alprazolam
- Alpha Chymotrypsin
- Alpha tocopherol
- Alphachymotrypsin Glomed
- Alphagan-P
- Aluvia
- Alzental
- Amaryl
- Ambroco
- Ambroxol
- Amcinol-Paste
- Amigold
- Amikacin
- Aminocaproic acid
- Aminoleban
- Aminoleban Oral
- Aminosteril N-Hepa
- Amiparen
- Amitriptyline
- Amiyu
- Amlodipine
- Amlor
- Amoxicillin
- Amoxicillin & clavulanate
- Ampicillin
- Amquitaz
- Anaferon for children
- Anargil
- Anaropin
- Andriol Testocaps
- Anepzil
- Anyfen
- Apaisac
- Apidra SoloStar
- Apitim 5
- Aprovel
- Aquaphil
- Arcalion
- Arcoxia
- Aricept Evess
- Arimidex
- Arnetine
- Artrodar
- A-Scabs
- Ascorbic acid
- Asperlican/Candinazol
- Aspilets EC
- Aspirin
- Asthmatin
- Atelec
- Atocib 120
- Atocib 90
- Atosiban PharmIdea
- Atozet
- Attapulgite
- Atussin
- Atropin
- Augbactam
- Augmentin Sachet
- Augmentin SR
- Augmentin Tablets
- Augmex
- Avamys
- Avastin
- Avelox Dịch truyền
- Avelox Viên nén
- Avodart
- Axcel Cefaclor-125 Suspension
- Axcel Cetirizine Syrup
- Axcel Chlorpheniramine
- Axcel Dexchlorpheniramine
- Axcel Dicyclomine-S Syrup
- Axcel Diphenhydramine Paediatric Syrup
- Axcel Erythromycin ES
- Axcel Eviline
- Axcel Fungicort Cream
- Axcel Fusidic acid Cream
- Axcel Fusidic acid-B Cream
- Axcel Hydrocortisone Cream
- Axcel Lignocaine 2% Sterile Gel
- Axcel Loratadine
- Axcel Miconazole Cream
- Axcel Paracetamol
- Axcel Urea Cream
- Axitan
- Azenmarol
- Azicine
- Aziphar
- Azithromycin







