Nhà sản xuất
Novartis Pharma
Nhà phân phối
Phytopharma / Zuellig Pharma
Thành phần
Mỗi viên: Everolimus 2,5 mg, 5mg hoặc 10mg.
Mô tả
Viên nén hình thon dài, màu trắng đến vàng nhạt, có gờ xiên và không có vạch.
2,5mg: Viên nén có khắc chữ “LCL” trên một mặt và chữ “NVR” ở mặt kia.
5mg: Viên nén có khắc số "5" trên một mặt và chữ "NVR" trên mặt kia.
10mg: Viên nén có khắc chữ "UHE" trên một mặt và chữ "NVR" trên mặt kia.
Dược lý
Nhóm dược lý: Tác nhân chống ung thư, các tác nhân chống ung thư khác, thuốc ức chế protein kinase.
Mã ATC: L01XE10.
Cơ chế tác động (MOA)
Everolimus là một chất ức chế dẫn truyền tín hiệu nhắm đến mTOR (đích của rapamycin ở động vật có vú) hoặc đặc hiệu hơn là mTORC1 ('đích rapamycin' ở động vật có vú- phức hợp 1). mTOR là một serine-threonine kinase chủ chốt, đóng vai trò trung tâm trong việc điều hòa sự phát triển, tăng sinh và sống sót của tế bào. Sự điều hòa truyền tín hiệu mTORC1 phức tạp, được điều hòa bởi các chất gây phân bào, các yếu tố tăng trưởng, năng lượng và chất dinh dưỡng. mTORC1 là chất điều hòa chủ yếu sự tổng hợp chung protein xuôi chiều theo con đường PI3K/AKT là con đường bị rối loạn điều hòa trong đa số các loại ung thư ở người.
Sự hoạt hóa con đường mTOR là thay đổi thích ứng chính dẫn đến sự đề kháng với liệu pháp nội tiết trong ung thư vú. Nhiều con đường dẫn truyền tín hiệu khác nhau đã được hoạt hóa để thoát khỏi tác động của liệu pháp nội tiết. Một con đường là PI3K/Akt/mTOR được hoạt hóa chủ yếu trong tế bào ung thư vú thiếu hụt estrogen dài hạn và đề kháng chất ức chế aromatase (AI). Các nghiên cứu in vitro cho thấy các tế bào ung thư vú phụ thuộc estrogen và HER2+ nhạy cảm với các tác động ức chế của everolimus, và cho thấy việc điều trị kết hợp everolimus với các chất ức chế Akt, HER2, hoặc aromatase tăng cường hoạt động chống khối u của everolimus theo cách đồng vận. Trong tế bào ung thư vú, sự đề kháng chất ức chế aromatase do việc hoạt hóa Akt có thể được khắc phục bởi việc dùng kết hợp với everolimus.
Hai chất điều hòa chính truyền tín hiệu mTORC1 là oncogene đè nén bướu tuberin-sclerosis complexes 1 & 2 (TSC1, TSC2). Mất hoặc bất hoạt TSC1 hoặc TSC2 dẫn đến tăng mức rheb-GTP - là một men GTPase thuộc họ Ras - tương tác với phức hợp mTORC1 để gây hoạt hóa phức hợp này. Sự hoạt hóa mTORC1 dẫn đến một dòng thác truyền tín hiệu kinase xuôi chiều, bao gồm cả hoạt hóa S6K1. S6K1 là một cơ chất của phức hợp mTOR 1 (mTORC1) sẽ phosphoryl hóa vùng 1 có chức năng hoạt hóa của thụ thể estrogen là chất chịu trách nhiệm hoạt hóa thụ thể không phụ thuộc phối tử.
Đặc tính dược lực học (PD)
Everolimus là một chất ức chế chọn lọc mTOR (đích của rapamycin ở động vật có vú), đặc biệt nhắm đến phức hợp dẫn truyền tín hiệu mTOR-raptor (mTORC1). mTOR là một serine-threonine kinase chính trong dòng thác truyền tín hiệu PI3K/AKT là con đường được biết bị rối loạn điều hòa trong đa số các loại ung thư ở người. Everolimus tác động thông qua sự tương tác có ái lực cao với protein thụ thể nội bào là FKBP12. Phức hợp FKBP12/everolimus gắn kết với mTORC1, ức chế khả năng truyền tín hiệu của mTORC1. Khả năng truyền tín hiệu của mTORC1 bị ảnh hưởng thông qua sự điều hòa phosphoryl hóa của các chất tác động xuôi chiều mà đặc trưng nhất là các chất điều hòa sự dịch mã ribosome protein S6 kinase (S6K1) và yếu tố khởi phát eukaryote 4E-protein gắn kết (4E-BP). Sự phá vỡ chức năng của S6K1 và 4E-BP1 do hậu quả của sự ức chế mTORC1, cản trở sự dịch mã các protein then chốt mã hóa mRNA có vai trò trong sự điều hòa chu kỳ tế bào, sự phân hủy đường và sự thích ứng với tình trạng thiếu oxy (giảm oxy mô). Điều này ức chế sự phát triển của khối u và ức chế sự biểu hiện của các yếu tố cảm ứng tình trạng thiếu oxy (ví dụ yếu tố phiên mã HIF-1); tiến trình sau dẫn đến giảm biểu hiện của các yếu tố liên quan đến tăng quá trình tạo mạch của khối u (ví dụ yếu tố tăng trưởng nội mô mạch máu - VEGF). Everolimus là chất ức chế mạnh sự phát triển và tăng sinh của tế bào khối u, tế bào nội mô, nguyên bào sợi và tế bào cơ trơn liên quan đến mạch máu. Phù hợp với vai trò điều hòa trung tâm của mTORC1, everolimus cho thấy làm giảm sự tăng sinh tế bào khối u, sự phân hủy đường và sự tạo mạch trong các khối u đặc in vivo, vì vậy dẫn đến hai cơ chế độc lập ức chế sự tăng trưởng khối u: Hoạt tính chống khối u trực tiếp trên tế bào khối u và ức chế khoang mô đệm của khối u.
Các nghiên cứu lâm sàng
Ung thư vú tiến xa có thụ thể hormone dương tính
Nghiên cứu BOLERO-2 (Nghiên cứu CRAD001Y2301) phase III đa trung tâm, ngẫu nhiên, mù đôi về Afinitor + exemestane so với giả dược + exemestane đã được thực hiện ở phụ nữ sau mãn kinh bị bệnh ung thư vú tiến xa có thụ thể estrogen dương tính, HER 2-neu/không khuếch đại, tái phát hoặc tiến triển sau khi điều trị ban đầu bằng letrozole hoặc anastrozole. Các bệnh nhân được chọn ngẫu nhiên theo tỷ lệ 2:1 cho dùng everolimus (10 mg/ngày) hoặc giả dược tương ứng cộng với exemestane (25 mg/ngày) nhãn mở. Sự chọn ngẫu nhiên được phân tầng theo tính nhạy cảm được ghi nhận với điều trị trước bằng hormone (có so với không có) và theo sự hiện diện di căn tạng (có so với không có). Tính nhạy cảm với điều trị trước bằng hormone được định nghĩa là (1) lợi ích lâm sàng được ghi nhận (đáp ứng hoàn toàn [CR], đáp ứng một phần [PR], bệnh ổn định ≥ 24 tuần) với ít nhất ở một trị liệu hormone trước đó trong trường hợp bệnh tiến xa hoặc (2) điều trị bổ trợ bằng hormone ít nhất 24 tháng trước khi tái phát.
Tiêu chí đánh giá chính cho thử nghiệm là thời gian sống thêm không bệnh tiến triển (PFS) được đánh giá theo Tiêu chí đánh giá đáp ứng về khối u đặc (RECIST), dựa trên đánh giá của các nghiên cứu viên (nhờ khoa quang tuyến tại bệnh viện). Phân tích hỗ trợ về thời gian sống thêm không bệnh tiến triển dựa trên việc kiểm lại chẩn đoán hình ảnh ở một trung tâm độc lập.
Các tiêu chí phụ bao gồm thời gian sống thêm toàn bộ (OS), tỷ lệ đáp ứng toàn bộ (ORR), tỷ lệ có lợi ích lâm sàng (CBR), độ an toàn, thay đổi chất lượng cuộc sống (QoL) và thời gian dẫn đến suy giảm tình trạng hoạt động cơ thể (PS) theo thang điểm ECOG. Các tiêu chí bổ sung bao gồm thay đổi các chỉ điểm về chuyển hóa xương lúc 6 tuần và 12 tuần.
Tổng cộng 724 bệnh nhân được chọn ngẫu nhiên theo tỷ số 2:1 vào nhóm dùng phối hợp everolimus (10 mg/ngày) + exemestane (25 mg/ngày) (n = 485) hoặc nhóm giả dược + exemestane (25 mg/ngày) (n = 239). Hai nhóm điều trị nói chung cân bằng về đặc tính dân số thời điểm ban đầu đối với đặc điểm bệnh và tiền sử điều trị chống khối u trước đó. Tuổi trung vị của bệnh nhân là 61 tuổi (từ 28-93) và 75% là người da trắng. Khoảng thời gian điều trị trung vị là 24 tuần đối với bệnh nhân dùng Afinitor kết hợp exemestane và 13,4 tuần đối với các bệnh nhân dùng giả dược kết hợp exemestane.
Kết quả về hiệu quả đã đạt được từ phân tích cuối cùng về PFS sau khi quan sát thấy 510 trường hợp có biến cố PFS theo đánh giá tại điểm nghiên cứu và 320 biến cố PFS theo đánh giá độc lập. Các bệnh nhân trong nhóm giả dược + exemestane không chuyển sang dùng everolimus tại thời điểm tiến triển.
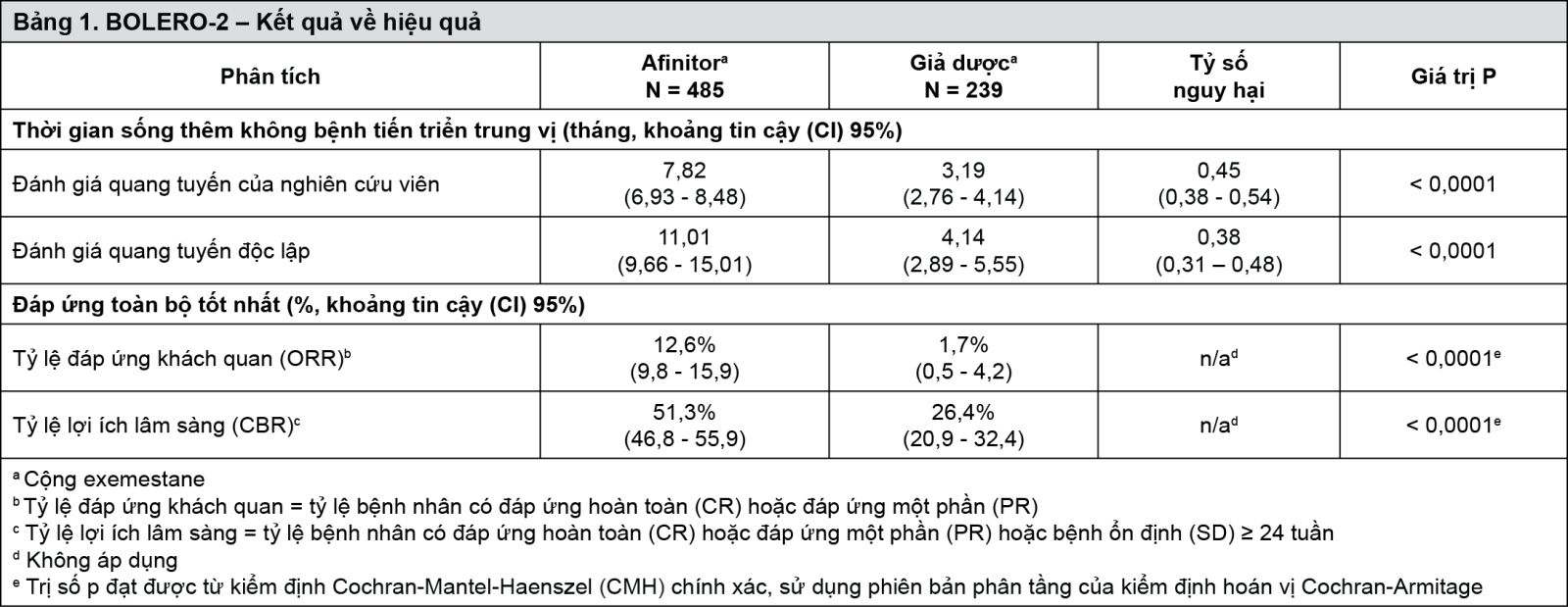
Nghiên cứu này đã cho thấy lợi ích lâm sàng có ý nghĩa thống kê của everolimus + exemestane cao hơn giả dược + exemestane bởi sự kéo dài gấp 2,5 lần về PFS trung vị (trung vị: 7,82 tháng so với 3,19 tháng), dẫn đến giảm nguy cơ 55% về tiến triển bệnh hoặc tử vong (tỷ số nguy hại (HR) cho PFS là 0,45; khoảng tin cậy (CI) 95%: 0,38-0,54; trị số p trong kiểm định log-rank một phía < 0,0001 theo đánh giá của nghiên cứu viên (xem Bảng 1 và Hình 1).
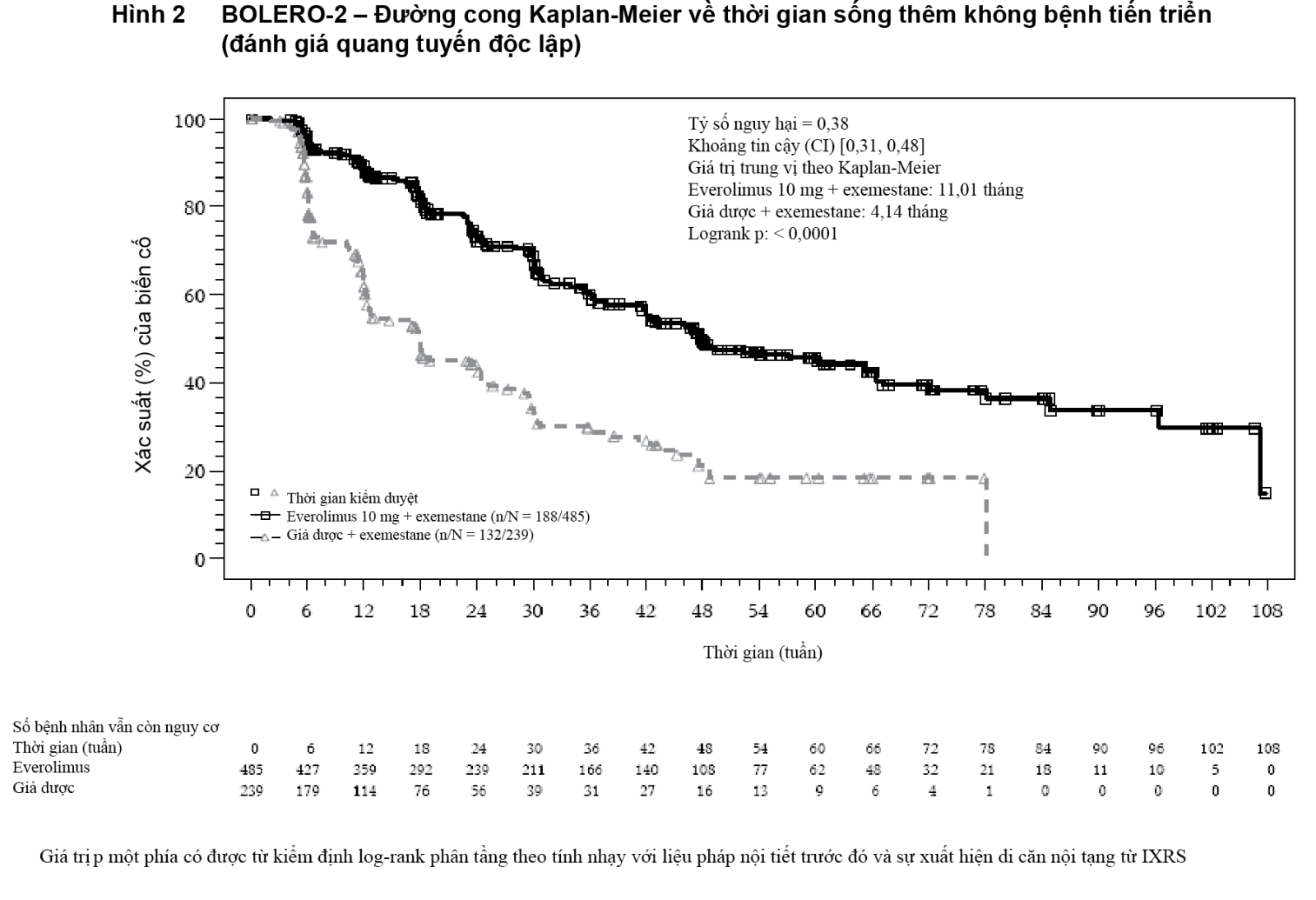
Phân tích về PFS dựa trên đánh giá quang tuyến của trung tâm độc lập ủng hộ kết quả trên và cho thấy sự kéo dài gấp 2,7 lần về thời gian sống thêm không bệnh tiến triển trung vị (11,01 tháng so với 4,14 tháng), dẫn đến giảm nguy cơ 62% về tiến triển bệnh hoặc tử vong (PFS HR là 0,38; khoảng tin cậy (CI) 95%: 0,31-0,48; trị số p trong kiểm định log-rank một phía < 0,0001 (xem Bảng 1 và Hình 2).
Đáp ứng khách quan theo đánh giá của nghiên cứu viên dựa trên RECIST được quan sát ở 12,6% bệnh nhân (khoảng tin cậy (CI) 95%: 9,8-15,9) ở nhóm everolimus + exemestane so với 1,7% (khoảng tin cậy (CI) 95%: 0,5-4,2) ở nhóm giả dược + exemestane (p < 0,0001 khi so sánh giữa các nhóm). Tỷ lệ lợi ích lâm sàng đối với everolimus + exemestane là 51,3% so với 26,4% ở nhóm chứng; p < 0,0001 (xem Bảng 1).
- xem Bảng 1.
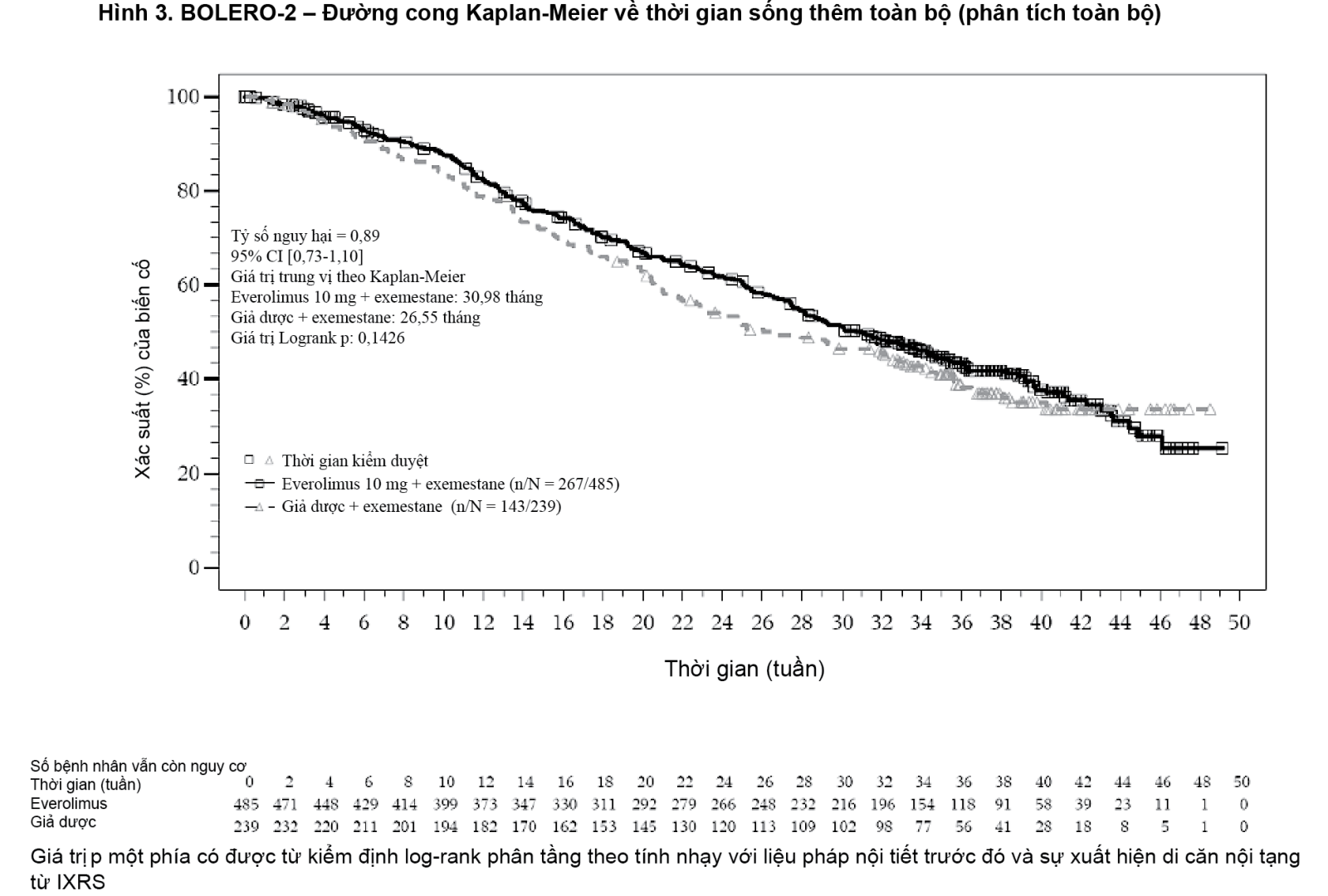
Tại thời điểm phân tích dữ liệu về thời gian sống thêm toàn bộ (OS), khoảng thời gian sống thêm toàn bộ trung vị là 31 tháng ở nhóm everolimus + exemestane so với 26,6 tháng ở nhóm giả dược + exemestane [HR=0,89 (CI 95%: 0,73-1,10; p = 0,1426)] (xem Hình 3).
Tỷ lệ PFS 12 tháng là 33% bệnh nhân dùng everolimus + exemestane so với 11% ở nhóm dùng giả dược + exemestane.
- xem Hình 1, Hình 2 & Hình 3.

Hiệu quả điều trị về PFS ước tính được củng cố bởi phân tích phân nhóm theo đề cương về PFS theo đánh giá của nghiên cứu viên. Đối với tất cả phân nhóm được phân tích, đã ghi nhận hiệu quả tích cực của việc điều trị bằng everolimus + exemestane với tỷ số nguy hại ước tính so với giả dược + exemestane trong khoảng từ 0,25-0,62 (xem Bảng 2). Các phân tích phân nhóm đã chứng minh hiệu quả điều trị đồng nhất và nhất quán bất kể tính nhạy cảm với trị liệu nội tiết trước đó và sự hiện diện của di căn tạng, và ở các phân nhóm chính về nhân khẩu học và tiên lượng.
- xem Bảng 2.
Sự thu nhỏ khối u cũng rõ rệt từ biểu đồ thác nước (waterfall plot) tương ứng. Các kết quả cho thấy 70,8% bệnh nhân ở nhóm everolimus + exemestane có khối u thu nhỏ lại so với 29,7% ở nhóm giả dược + exemestane.
Không quan sát thấy các khác biệt có ý nghĩa lâm sàng hoặc có ý nghĩa thống kê giữa 2 nhóm điều trị về thời gian dẫn đến tình trạng hoạt động của cơ thể (PS) xấu đi theo thang điểm ECOG (≥ 1 điểm) và thời gian trung vị dẫn đến giảm (≥ 5%) điểm số thành phần trong QLQ-C30.
Tác dụng trên xương
Không có các dữ liệu dài hạn về tác dụng của everolimus trên xương. Dữ liệu so sánh từ nghiên cứu BOLERO-2 cho thấy sự cải thiện rõ rệt các chỉ điểm trong huyết thanh về chuyển hóa xương trong thời gian 12 tuần đầu của điều trị, thể hiện một hiệu quả thuận lợi trên chuyển hóa xương.
Khối u thần kinh nội tiết tiến xa có nguồn gốc tiêu hóa, phổi hoặc tụy
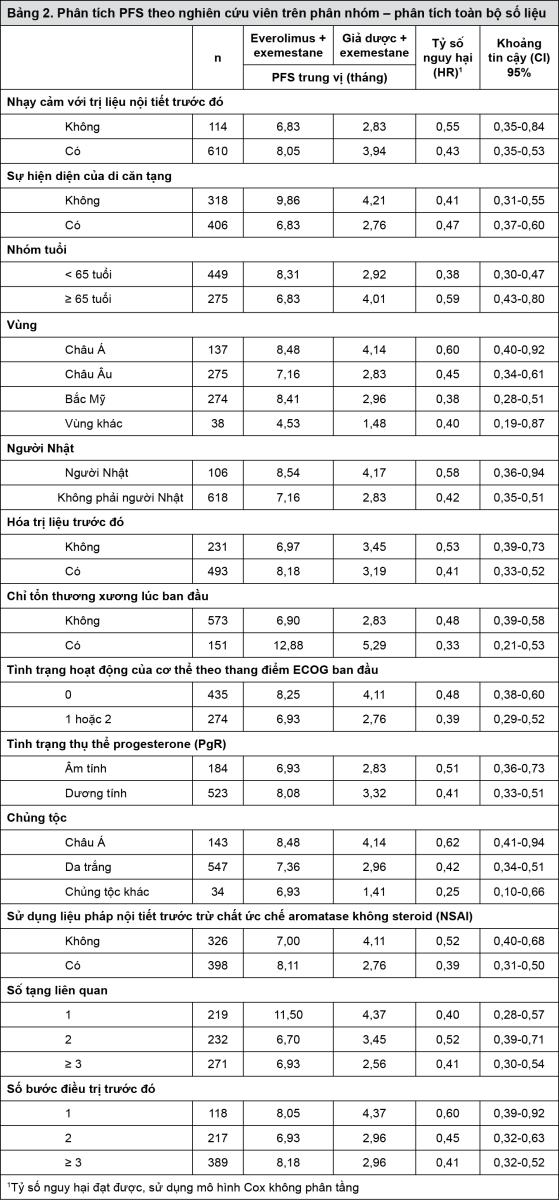
Nghiên cứu RADIANT-3 (Nghiên cứu CRAD001C2324) phase III đa trung tâm, ngẫu nhiên, mù đôi về Afinitor cộng với chăm sóc hỗ trợ tốt nhất (BSC) so với giả dược cộng với chăm sóc hỗ trợ tốt nhất ở những bệnh nhân bị khối u thần kinh nội tiết tiến xa có nguồn gốc ở tụy (pNET) đã cho thấy lợi ích lâm sàng có ý nghĩa thống kê của Afinitor cao hơn giả dược bởi sự kéo dài gấp 2,4 lần về thời gian sống thêm không bệnh tiến triển (PFS) trung vị (11,04 tháng so với 4,6 tháng), dẫn đến giảm 65% nguy cơ đối với PFS (HR 0,35; khoảng tin cậy (CI) 95%: 0,27-0,45; p < 0,0001) (xem Bảng 3 và Hình 4).
Nghiên cứu RADIANT-3 đưa vào nghiên cứu những bệnh nhân bị khối u thần kinh nội tiết tiến xa có nguồn gốc ở tụy (pNET) có bệnh đã tiến triển trong vòng 12 tháng trước. Bệnh nhân được phân tầng theo hóa trị liệu độc tế bào trước đó (có/không) và tình trạng hoạt động của cơ thể theo Tổ chức Y tế thế giới (WHO) (0 so với 1 và 2). Việc điều trị bằng các chất tương tự somatostatin được cho phép như một phần của chăm sóc hỗ trợ tốt nhất.
Tiêu chí đánh giá chính đối với thử nghiệm là thời gian sống thêm không tiến triển bệnh (PFS) được đánh giá theo RECIST (Tiêu chuẩn đánh giá đáp ứng về khối u đặc, phiên bản 1.0). Sau khi bệnh tiến triển về mặt hình ảnh quang tuyến đã được ghi nhận, bệnh nhân có thể được nghiên cứu viên cho biết thông tin: Những bệnh nhân được chọn ngẫu nhiên cho dùng giả dược sau đó có thể được dùng Afinitor nhãn mở.
Các tiêu chí phụ bao gồm độ an toàn, tỷ lệ đáp ứng khách quan (ORR) (đáp ứng hoàn toàn (CR) hoặc đáp ứng một phần (PR)), thời gian đáp ứng và thời gian sống thêm toàn bộ (OS).
Tổng cộng, 410 bệnh nhân được chọn ngẫu nhiên 1:1 cho dùng Afinitor 10 mg/ngày (n = 207) hoặc giả dược (n = 203). Đặc tính dân số cân bằng (tuổi trung vị là 58, 55% nam, 78,5% người da trắng). Thời gian điều trị trung vị trong nghiên cứu mù là 37,8 tuần ở những bệnh nhân sử dụng Afinitor và 16,1 tuần ở bệnh nhân dùng giả dược.
- xem Bảng 3 & Hình 4.

Tỷ lệ sống thêm không tiến triển bệnh 18 tháng là 34,2% đối với điều trị bằng Afinitor so với 8,9% đối với giả dược.
Tỷ lệ đáp ứng khách quan theo đánh giá của nghiên cứu viên là 4,8% đối với nhóm everolimus so với 2% đối với nhóm giả dược. Sự thu nhỏ khối u rõ rệt từ biểu đồ thác nước (waterfall plot) tương ứng. Các kết quả cho thấy 64,4% bệnh nhân ở nhóm everolimus có khối u co nhỏ lại so với 20,6% đối với nhóm giả dược.
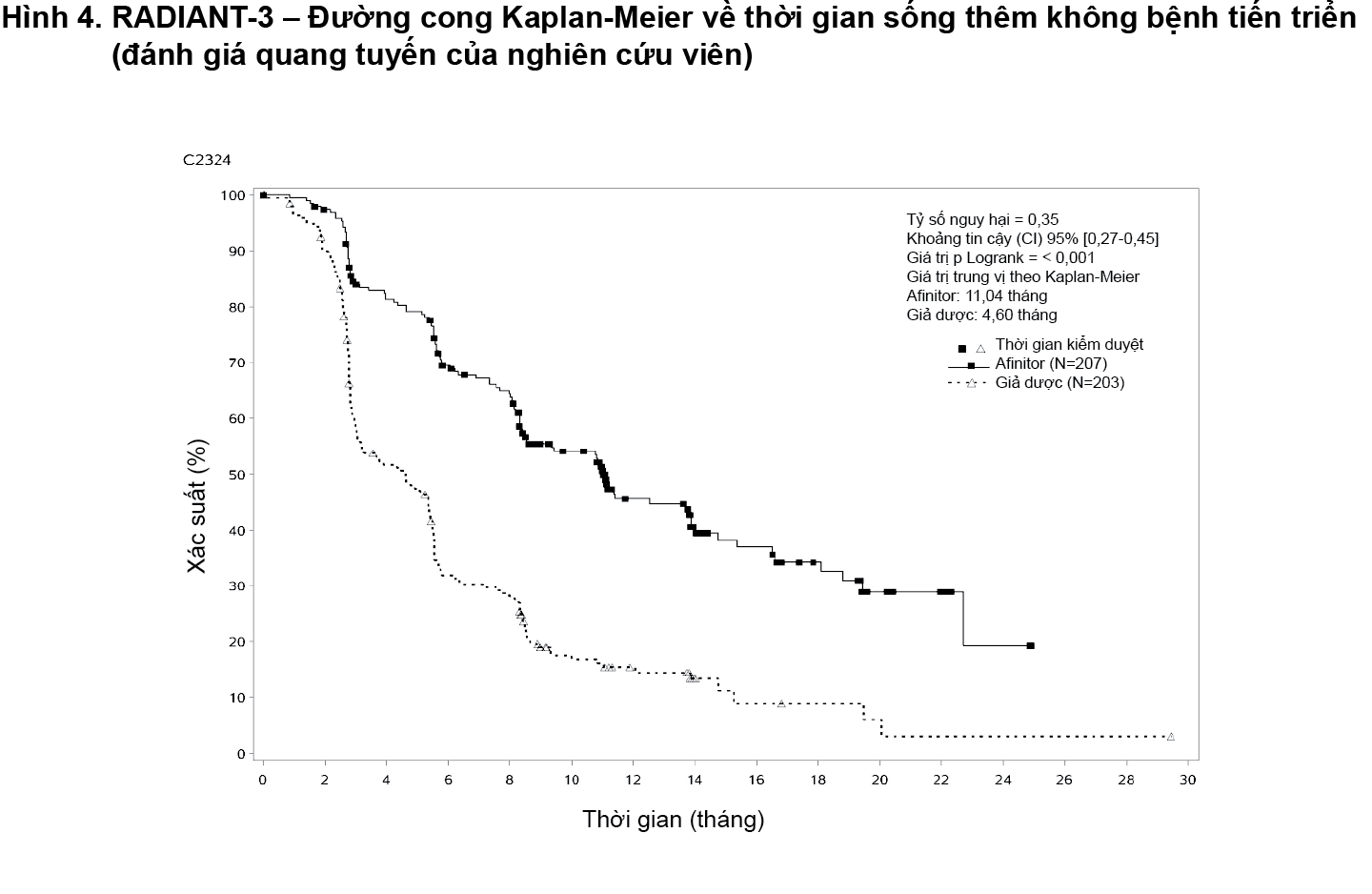
Tại thời điểm phân tích dữ liệu thời gian sống thêm toàn bộ (OS) cuối cùng, khoảng thời gian sống thêm toàn bộ trung vị lần lượt là 44 tháng ở nhóm dùng everolimus so với 37,7 tháng ở nhóm giả dược (tỷ số nguy hại (HR)=0,94; khoảng tin cậy (CI) 95% là 0,73 đến 1,20; p = 0,300 (Hình 5). Có 172 bệnh nhân trong số 203 bệnh nhân nhóm giả dược được chuyển sang sử dụng everolimus nhãn mở (84,7%) khi bệnh tiến triển và điều này có thể gây nhiễu cho việc phát hiện sự khác biệt liên quan điều trị trong sống thêm toàn bộ.
- xem Hình 5.
Nghiên cứu RADIANT-4 (Nghiên cứu CRAD001T2302) phase III đa trung tâm, ngẫu nhiên, mù đôi về Afinitor kết hợp với chăm sóc hỗ trợ tốt nhất (BSC) so với giả dược kết hợp với chăm sóc hỗ trợ tốt nhất được thực hiện ở những bệnh nhân có khối u thần kinh nội tiết không chức năng tiến xa (NET) có nguồn gốc tiêu hóa hay phổi mà không có tiền sử và không có triệu chứng hoạt động liên quan đến hội chứng carcinoid. Phân tầng ngẫu nhiên theo việc sử dụng chất tương tự somatostatin (SSA) trước đó, nguồn gốc khối u và tình trạng hoạt động của cơ thể theo Tổ chức Y tế Thế giới (WHO).
Tiêu chí đánh giá chính đối với thử nghiệm là thời gian sống thêm không tiến triển bệnh (PFS) được đánh giá theo Tiêu chuẩn đánh giá đáp ứng về khối u đặc (Tiêu chuẩn RECIST sửa đổi phiên bản 1.0), dựa trên đánh giá quang tuyến độc lập. Phân tích PFS hỗ trợ dựa trên xem xét của nghiên cứu viên địa phương.
Các tiêu chí phụ bao gồm thời gian sống thêm toàn bộ (OS), tỷ lệ đáp ứng toàn bộ (ORR), tỷ lệ kiểm soát được bệnh (DCR = tỷ lệ bệnh nhân có đáp ứng tổng thể tốt nhất của đáp ứng đầy đủ, đáp ứng một phần hoặc bệnh ổn định), tính an toàn, thay đổi chất lượng cuộc sống (QoL) qua FACT-G và thời gian dẫn đến suy giảm tình trạng hoạt động cơ thể theo Tổ chức Y tế Thế giới WHO.
Tổng cộng 302 bệnh nhân được chọn ngẫu nhiên theo tỷ số 2:1 vào nhóm dùng everolimus (10 mg/ngày) (n = 205) hoặc nhóm giả dược (n = 97). Hai nhóm điều trị nói chung cân bằng về đặc tính dân số ban đầu, đặc điểm bệnh và tiền sử dùng chất tương tự somatostatin (SSA) trước đó. Tuổi trung vị của bệnh nhân là 63 tuổi (từ 22-86) và 76% là người da trắng. Khoảng thời gian điều trị mù trung vị là 40,4 tuần đối với bệnh nhân dùng Afinitor và 19,6 tuần đối với bệnh nhân dùng giả dược. Bệnh nhân trong nhóm giả dược không chuyển sang dùng everolimus tại thời điểm tiến triển.
Kết quả về hiệu quả đã đạt được từ phân tích cuối cùng về PFS sau khi quan sát thấy 178 trường hợp có biến cố PFS theo đánh giá quang tuyến độc lập.
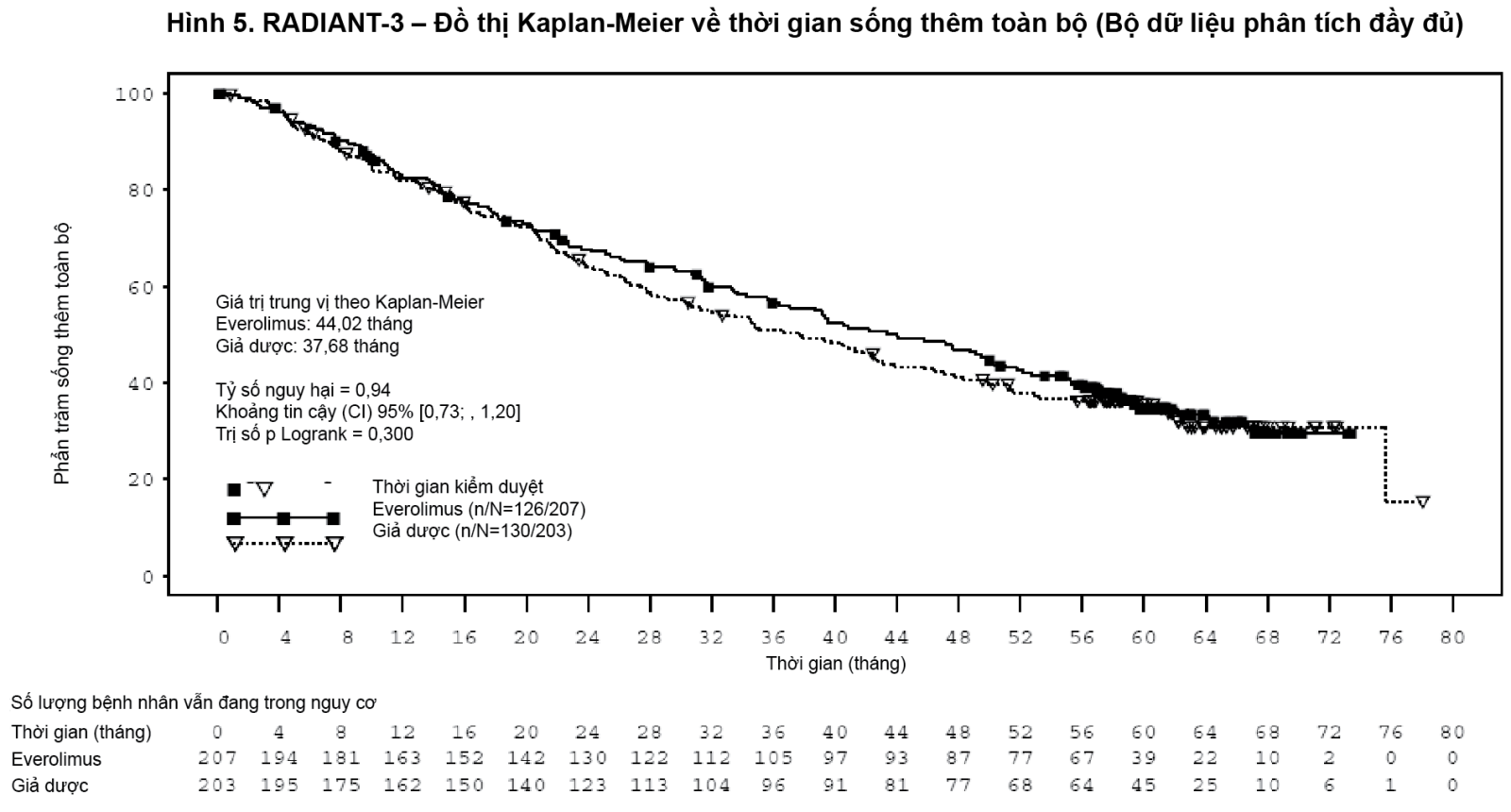
Nghiên cứu này đã cho thấy lợi ích lâm sàng có ý nghĩa thống kê của everolimus cao hơn giả dược bởi sự kéo dài gấp 2,8 lần về PFS trung vị (trung vị: 11,01 tháng so với 3,91 tháng), dẫn đến giảm 52% nguy cơ tiến triển bệnh hoặc tử vong (tỷ số nguy hại (HR) cho PFS là 0,48; khoảng tin cậy (CI) 95%: 0,35 - 0,67; trị số p trong kiểm định log-rank một phía < 0,0001 theo đánh giá độc lập (xem Bảng 4 và Hình 6).
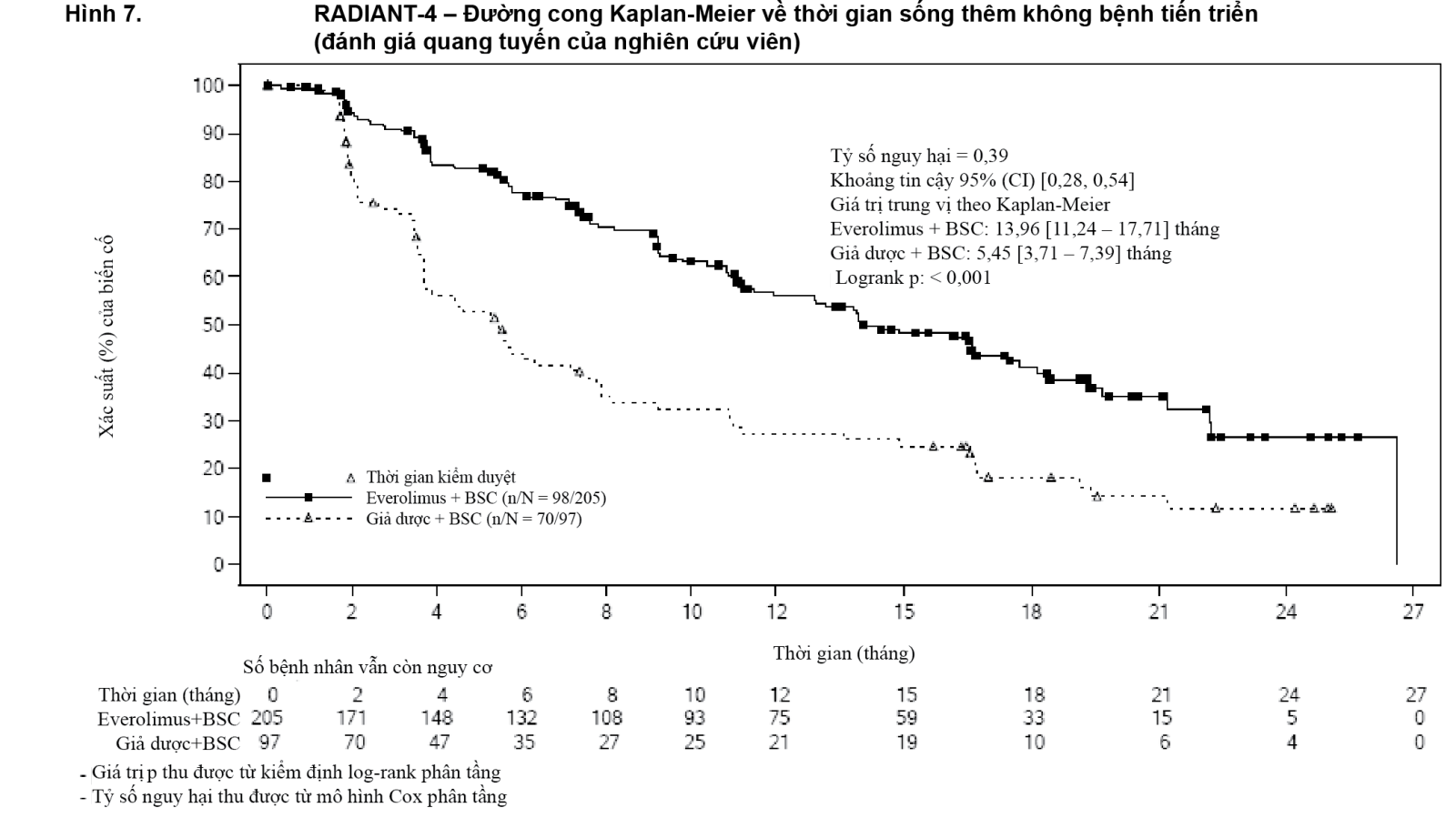
Phân tích về PFS dựa trên đánh giá của nghiên cứu viên địa phương đã chứng minh kết quả trên và cho thấy sự kéo dài gấp 2,5 lần về thời gian sống thêm không bệnh tiến triển trung vị (13,96 tháng so với 5,45 tháng), dẫn đến giảm 61% nguy cơ tiến triển bệnh hoặc tử vong (PFS HR là 0,39; khoảng tin cậy (CI) 95%: 0,28 - 0,54; trị số p trong kiểm định log-rank một phía < 0,0001 (xem Bảng 4 và Hình 7).
- xem Bảng 4, Hình 6 & Hình 7

Các lợi ích tổng thể về PFS cho thấy ưu thế của Afinitor qua các phân nhóm phân tầng tiên lượng và nhân khẩu học được định trước (xem hình 8). Phân tích phân nhóm không định trước về PFS cho các cơ quan có nguồn gốc khối u do đường tiêu hóa, phổi và ung thư biểu mô không rõ nguyên nhân/ nguồn gốc khác cho thấy lợi ích tích cực về PFS (xem hình 9).
- xem Hình 8 & Hình 9

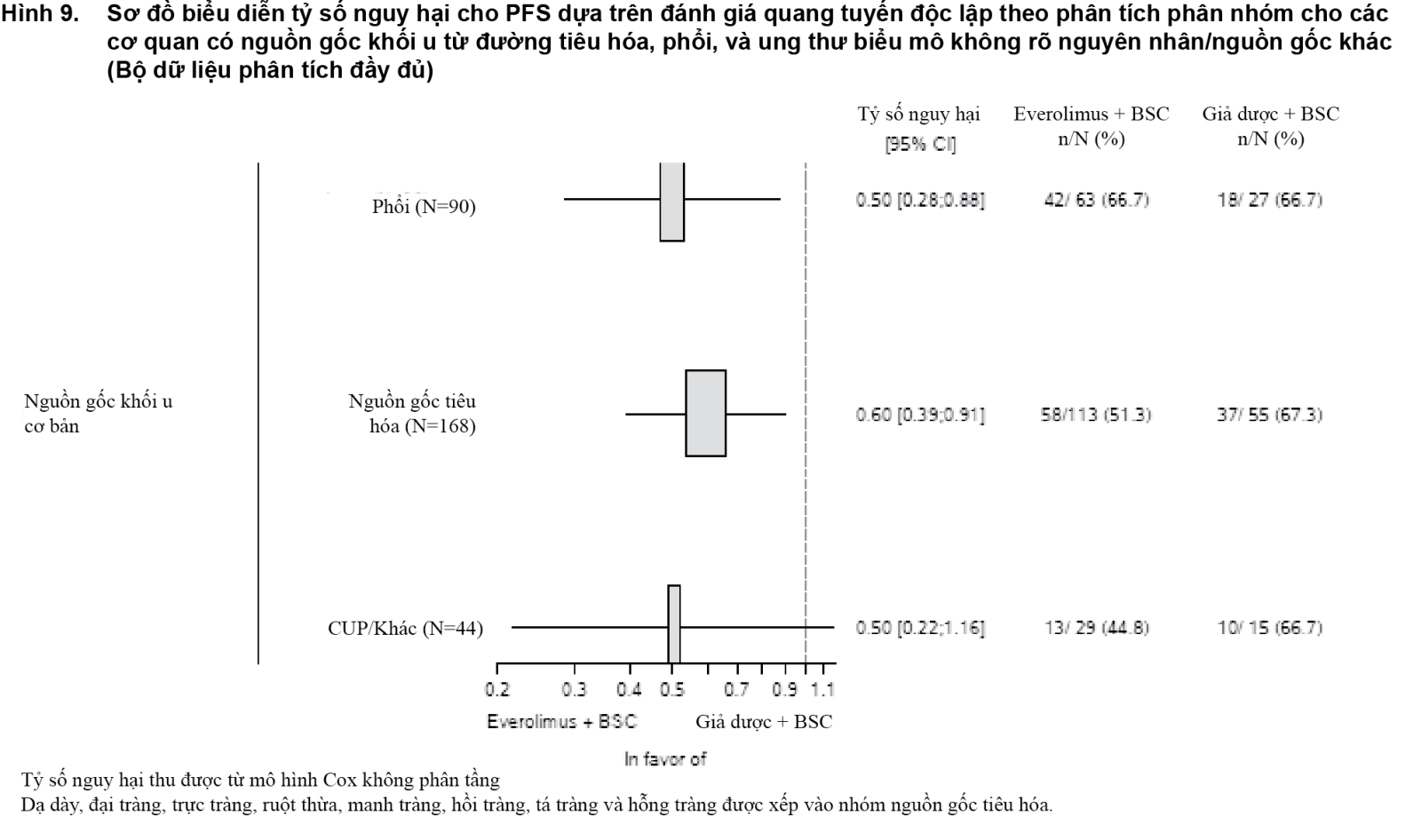
Tỷ lệ đáp ứng toàn bộ theo đánh giá độc lập là 2% ở nhóm dùng everolimus so với 1% ở nhóm dùng giả dược. Tỷ lệ kiểm soát được bệnh (CR hoặc PR hoặc SD) ở nhóm dùng everolimus là 82,4% so với 64,9% ở nhóm dùng giả dược. Giảm kích thước khối u cũng được thể hiện qua biểu đồ hình thác nước tương ứng. Kết quả cho thấy 63,6% số bệnh nhân ở nhóm dùng everolimus đều có kích thước khối u giảm đi so với 25,9% ở nhóm dùng giả dược (xem Hình 10).
- xem Hình 10
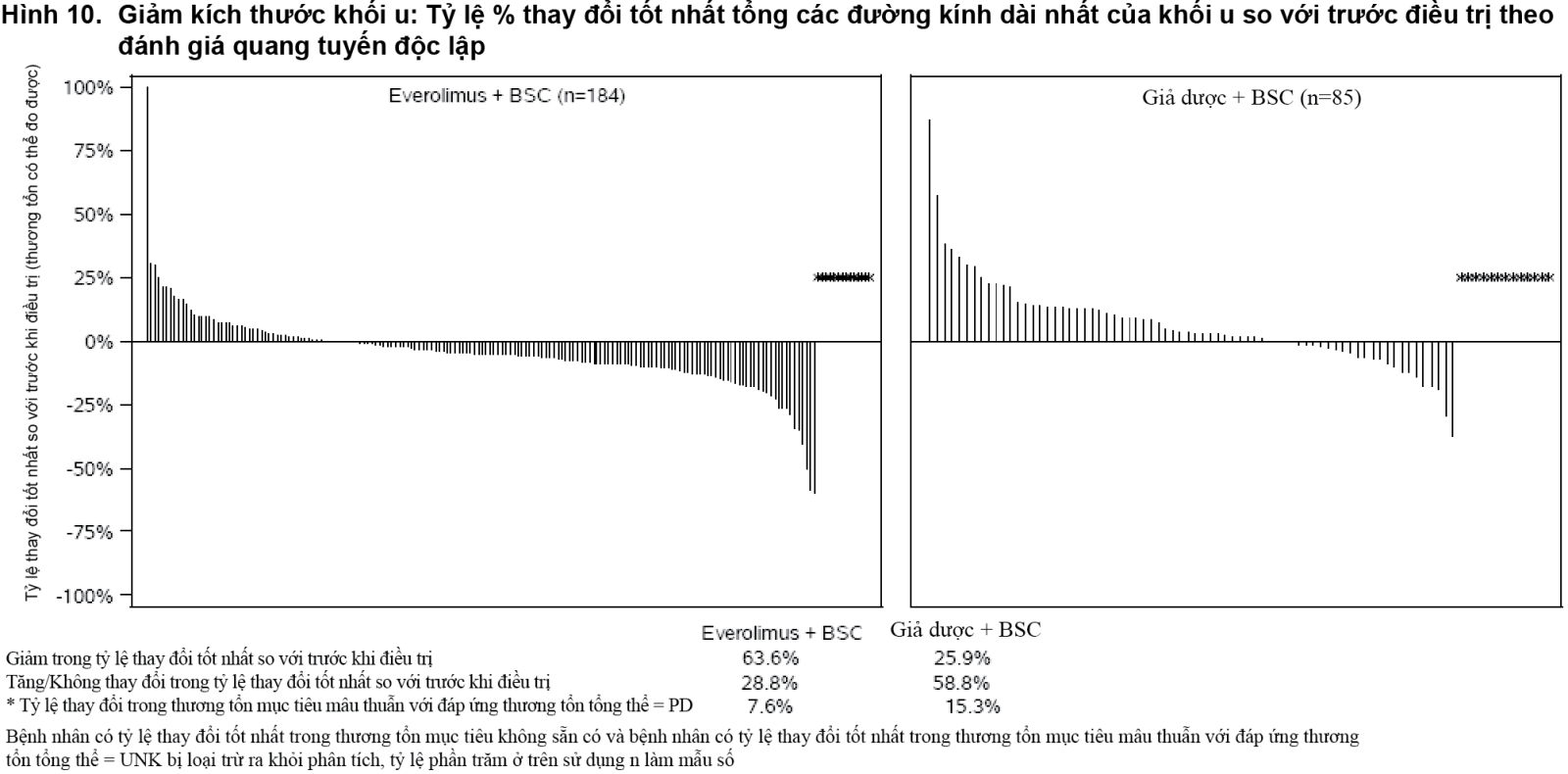
Phân tích thời gian sống thêm toàn bộ (OS) vẫn chưa được hoàn thiện. Tại thời điểm phân tích giữa kỳ đầu tiên, đã ghi nhận 42 trường hợp tử vong (20,5%) trong nhóm dùng Afinitor so với 28 trường hợp tử vong (28,9%) trong nhóm dùng giả dược; tuy nhiên kết quả của phân tích này không đáp ứng được tiêu chí ngừng nghiên cứu đã được xác định trước đó về ý nghĩa thống kê [Tỷ số nguy hại HR = 0,64 (khoảng tin cậy (CI) 95%: 0,40 - 1,05; p = 0,037)] (xem Hình 11).
- xem Hình 11
Không quan sát thấy các khác biệt có ý nghĩa lâm sàng hoặc có ý nghĩa thống kê giữa 2 nhóm điều trị về thời gian dẫn đến suy giảm tình trạng hoạt động của cơ thể (PS) theo WHO (≥ 1 điểm) và thời gian dẫn đến giảm tổng điểm FACT-G (≥ 7 điểm).
Nghiên cứu RADIANT-2 (Nghiên cứu CRAD001C2325) pha III đa trung tâm, ngẫu nhiên, mù đôi về Afinitor kết hợp octreotide depot (Sandostatin LAR) so với giả dược kết hợp octreotide depot ở những bệnh nhân bị khối u thần kinh nội tiết tiến xa (khối u carcinoid) chủ yếu có nguồn gốc ở đường tiêu hóa hoặc phổi cho thấy bằng chứng lợi ích lâm sàng của Afinitor cao hơn giả dược bởi sự kéo dài 5,1 tháng về trung vị PFS (16,43 tháng so với 11,33 tháng; HR 0,77; khoảng tin cậy (CI) 95%: 0,59-1,00; trị số p một phía = 0,026), dẫn đến giảm nguy cơ 23% đối với tiêu chí đánh giá chính PFS (xem Bảng 5 và Hình 12). Mặc dù không đạt được ý nghĩa thống kê đối với phân tích chính (ranh giới có ý nghĩa thống kê là p = 0,0246), nhưng các phân tích đã được điều chỉnh cho việc kiểm duyệt thông tin và sự mất cân bằng ở 2 nhóm điều trị cho thấy hiệu quả điều trị thiên về everolimus.
RADIANT-2 đưa vào nghiên cứu những bệnh nhân bị khối u thần kinh nội tiết tiến xa (khối u carcinoid) chủ yếu có nguồn gốc ở đường tiêu hóa hoặc phổi có bệnh tiến triển trong vòng 12 tháng trước đó và tiền sử có triệu chứng tiết dịch. 80,1% bệnh nhân ở nhóm Afinitor được điều trị bằng chất tương tự somatostatin trước khi đưa vào nghiên cứu so với 77,9% ở nhóm giả dược.
Tiêu chí đánh giá chính là PFS được đánh giá theo RECIST. Sau khi ghi nhận sự tiến triển dựa trên quang tuyến, bệnh nhân có thể được nghiên cứu viên cho biết thông tin: Những bệnh nhân được chọn ngẫu nhiên cho dùng giả dược sau đó có thể được dùng Afinitor nhãn mở.
Các tiêu chí phụ bao gồm độ an toàn, đáp ứng khách quan, thời gian đáp ứng và sống thêm toàn bộ.
Tổng cộng 429 bệnh nhân được chọn ngẫu nhiên 1:1 cho dùng Afinitor 10 mg/ngày (n = 216) hoặc giả dược (n = 213), cộng với octreotide depot (Sandostatin LAR, được dùng tiêm bắp) 30mg mỗi 28 ngày. Thời gian trung vị điều trị nghiên cứu mù đôi là 37 tuần trong nhóm dùng Afinitor và 36,6 tuần ở nhóm giả dược. Sự mất cân bằng đáng chú ý rõ rệt về một số yếu tố tiên lượng cơ bản quan trọng, chủ yếu thiên về nhóm giả dược.
- xem Bảng 5.

Các phân tích bổ sung đối với đánh giá quang tuyến độc lập được hiệu chỉnh cho việc kiểm duyệt thông tin và sự mất cân bằng ở 2 nhóm điều trị đã cho thấy hiệu quả điều trị thiên về everolimus. Kết quả có thêm từ một phân tích đa biến được hiệu chỉnh cho sự mất cân bằng giữa 2 nhóm cho HR là 0,73 (khoảng tin cậy (CI) 95%: 0,56-0,97). Mô hình Cox với phương pháp Xác suất Nghịch đảo của Trọng số Kiểm duyệt (IPCW =Inverse Probability of Censoring Weights) được sử dụng để giải quyết và hiệu chỉnh cho việc kiểm duyệt thông tin và sự mất cân bằng về các đặc tính cơ bản giữa 2 nhóm nghiên cứu. Tỷ số nguy hại (HR) ước tính (khoảng tin cậy (CI) 95%) từ phân tích IPCW là 0,60 (0,44 - 0,84) thiên về Afinitor.
- xem Hình 12.
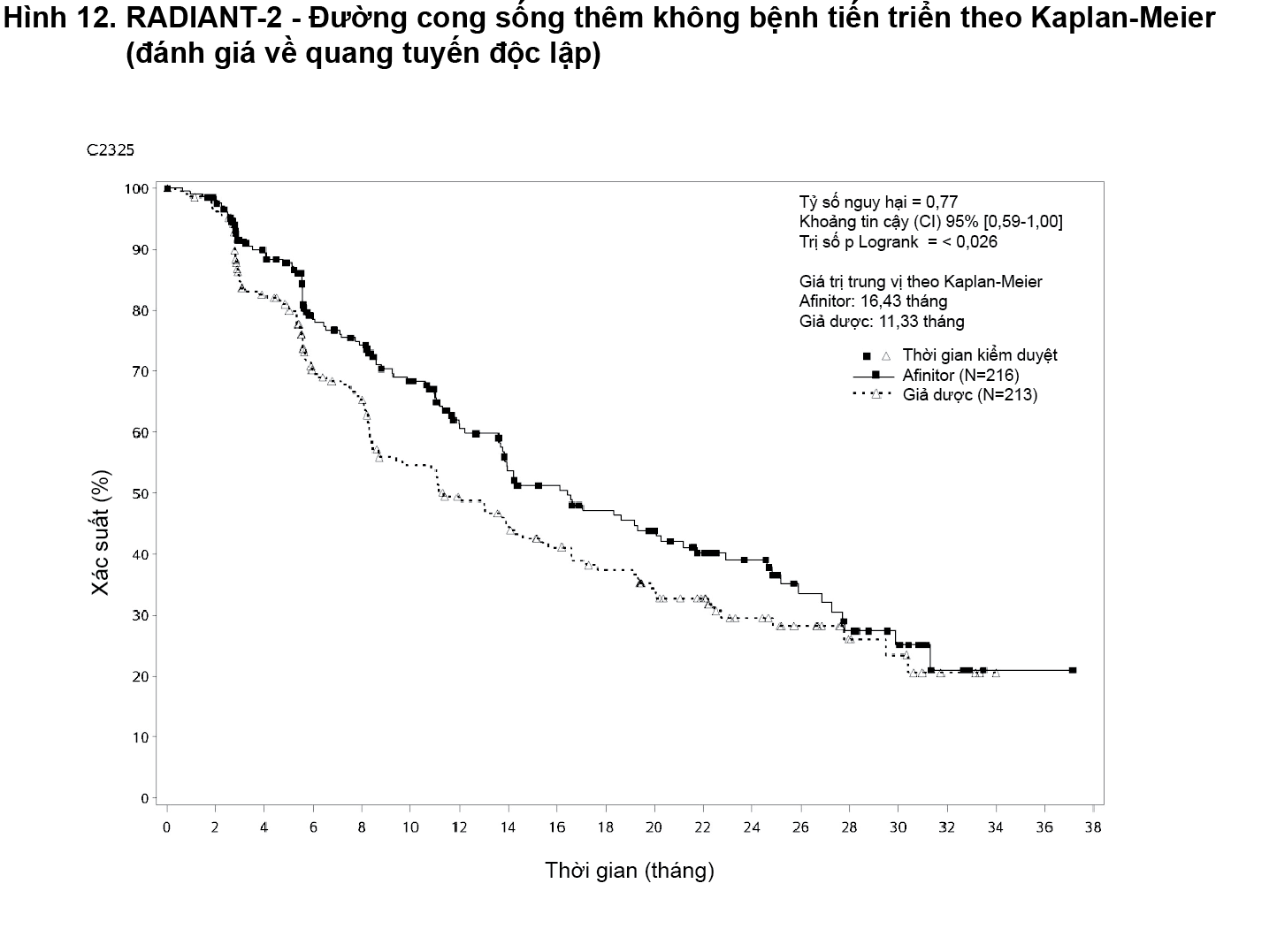
Tỷ lệ PFS 18 tháng là 47,2% đối với điều trị bằng everolimus cộng octreotide depot (Sandostatin LAR) so với 37,4% đối với giả dược cộng octreotide depot (Sandostatin LAR).
Tỷ lệ đáp ứng khách quan theo đánh giá của trung tâm là 2,3% đối với nhóm everolimus cộng octreotide depot (Sandostatin LAR) so với 1,9% đối với nhóm giả dược cộng octreotide depot (Sandostatin LAR). Sự thu nhỏ khối u rõ rệt từ biểu đồ thác nước (waterfall plot) tương ứng. Các kết quả cho thấy 75% bệnh nhân ở nhóm everolimus cộng octreotide depot (Sandostatin LAR) có khối u co nhỏ lại so với 44,8% ở nhóm giả dược cộng octreotide depot (Sandostatin LAR).
Phân tích cuối cùng về sống thêm toàn bộ không cho thấy sự khác biệt có ý nghĩa thống kê về OS (HR=1,16; khoảng tin cậy 95%: 0,91-1,49). Có 133 trường hợp tử vong (61,6%) ở nhóm dùng everolimus cộng với octreotide depot và 120 trường hợp tử vong (56,3%) ở nhóm giả dược cộng với octreotide depot. Sự chuyển nhóm > 58% số bệnh nhân từ dùng giả dược đến dùng Afinitor nhãn mở sau khi bệnh tiến triển, sự mất cân bằng giữa các nhóm điều trị trong việc sử dụng octreotide sau đó và sự mất cân bằng về các yếu tố tiên lượng chính lúc ban đầu có thể làm nhiễu việc phát hiện bất kỳ sự khác biệt nào về OS liên quan đến điều trị. Khi điều chỉnh các yếu tố tiên lượng quan trọng, tỷ số nguy hại cho OS thiên về hướng không khác biệt (HR 1,06; khoảng tin cậy 95%: 0,82-1,36).
Carcinôm tế bào thận tiến xa
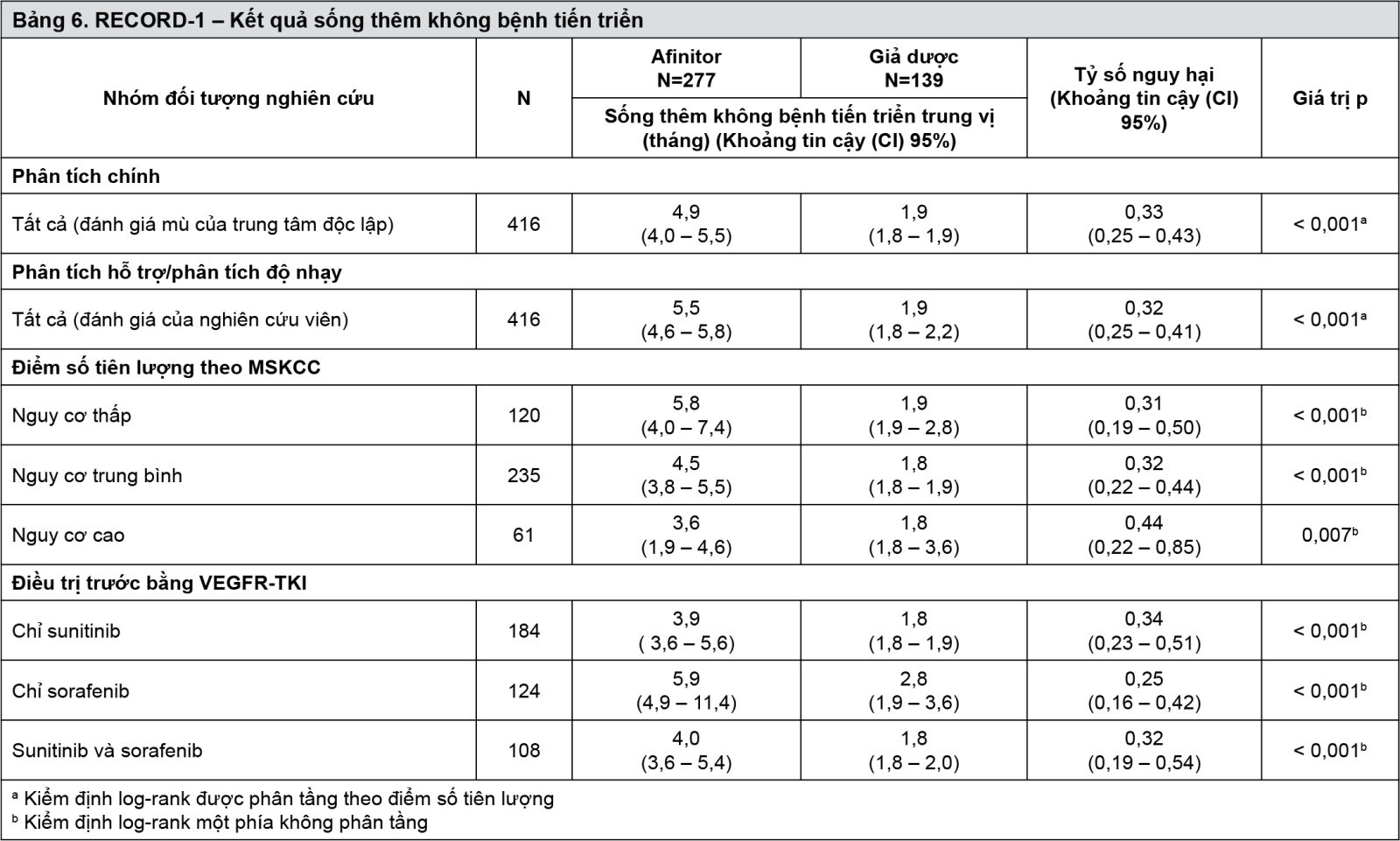
Nghiên cứu RECORD-1 (CRAD001C2240) phase III, quốc tế, đa trung tâm, ngẫu nhiên, mù đôi, so sánh Afinitor 10 mg/ngày và giả dược, cả hai kết hợp với chăm sóc hỗ trợ tốt nhất đã được thực hiện ở những bệnh nhân bị carcinôm tế bào thận di căn có bệnh tiến triển mặc dù đã điều trị trước bằng VEGFR-TKI (chất ức chế tyrosine kinase của thụ thể yếu tố tăng trưởng nội mô mạch máu) (sunitinib, sorafenib hoặc cả sunitinib và sorafenib). Điều trị trước bằng bevacizumab và interferon-alpha cũng được cho phép. Bệnh nhân được phân tầng theo điểm số tiên lượng của Trung tâm ung thư Memorial Sloan-Kettering (MSKCC) (các nhóm nguy cơ – nguy cơ thấp so với nguy cơ trung bình so với nguy cơ cao) và điều trị chống ung thư trước đó (1 so với 2 VEGFR-TKI trước đó).
Tiêu chí đánh giá chính là thời gian sống thêm không bệnh tiến triển, được ghi nhận sử dụng tiêu chí đánh giá đáp ứng về khối u đặc (RECIST) và được đánh giá qua sự xem xét theo phương thức mù của một trung tâm độc lập. Các tiêu chí phụ bao gồm tính an toàn, tỷ lệ đáp ứng khách quan của khối u, sống thêm toàn bộ, các triệu chứng liên quan với bệnh và chất lượng cuộc sống. Sau khi ghi nhận tiến triển dựa trên quang tuyến, bệnh nhân có thể được nghiên cứu viên cho biết thông tin: Những bệnh nhân được chọn ngẫu nhiên cho dùng giả dược sau đó có thể được dùng Afinitor nhãn mở 10 mg/ngày. Ủy ban độc lập giám sát dữ liệu khuyến cáo chấm dứt thử nghiệm này vào thời điểm phân tích gian kỳ thứ hai vì tiêu chí đánh giá chính đã được đáp ứng.
Tổng cộng có 416 bệnh nhân được chọn ngẫu nhiên 2:1 cho dùng Afinitor (n = 277) hoặc giả dược (n = 139). Đặc tính dân số cân bằng (tuổi trung vị gộp của bệnh nhân là 61 tuổi [từ 27-85], 77% là nam giới, 88% là người da trắng, 74% đã dùng một liệu pháp VEGFR-TKI trước đó). Thời gian điều trị trung vị của nghiên cứu theo phương pháp mù là 141 ngày đối với bệnh nhân dùng Afinitor và 60 ngày đối với bệnh nhân dùng giả dược.
Kết quả từ một phân tích gian kỳ theo kế hoạch cho thấy Afinitor trội hơn giả dược đối với tiêu chí đánh giá chính là sống thêm không bệnh tiến triển, với sự giảm nguy cơ 67% về tiến triển bệnh hoặc tử vong có ý nghĩa thống kê (xem Bảng 6 và Hình 13).
- xem Bảng 6 & Hình 13.
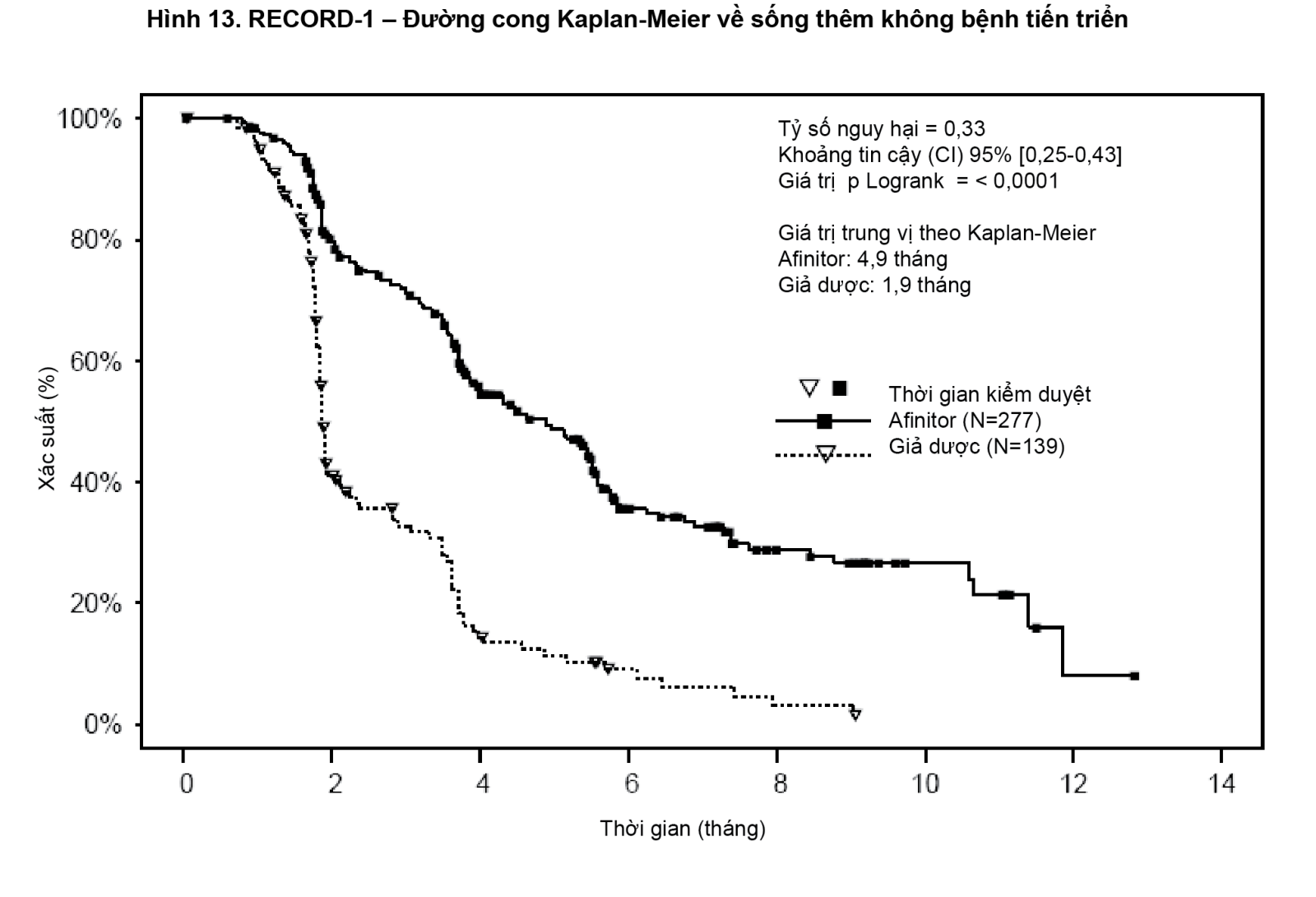
Tỷ lệ sống thêm không bệnh tiến triển 6 tháng là 36% đối với điều trị bằng Afinitor so với 9% đối với giả dược.
Đã ghi nhận có đáp ứng khách quan của khối u được xác nhận ở 5 bệnh nhân (2%) dùng Afinitor trong khi không quan sát thấy đáp ứng khách quan ở bệnh nhân dùng giả dược. Vì vậy lợi thế sống còn không tiến triển bệnh chủ yếu phản ánh nhóm đối tượng nghiên cứu có bệnh ổn định (tương ứng với 67% của nhóm điều trị bằng Afinitor).
Không ghi nhận sự khác biệt liên quan đến điều trị có ý nghĩa thống kê về sống thêm toàn bộ, mặc dù có xu hướng thiên về Afinitor (HR 0,90; khoảng tin cậy (CI) 95%: 0,71-1,14; p = 0,183). Sự chuyển nhóm sang dùng Afinitor nhãn mở sau khi bệnh tiến triển ở 111 trong số 139 bệnh nhân (79,9%) được cho dùng giả dược có thể đã làm nhiễu việc phát hiện bất kỳ sự khác biệt nào về sống còn toàn bộ liên quan đến điều trị. Có một xu hướng mạnh rõ rệt ủng hộ cho chất lượng cuộc sống tốt hơn ở những bệnh nhân dùng Afinitor theo đánh giá bởi các triệu chứng liên quan đến bệnh (HR 0,75; khoảng tin cậy (CI) 95%: 0,53-1,06; p = 0,053).
Đặc tính dược động học (PK)
Hấp thu
Ở bệnh nhân có khối u đặc tiến xa sau khi dùng viên nén Afinitor, nồng độ đỉnh của everolimus đạt được 1-2 giờ sau khi uống một liều 5-70 mg everolimus khi đói hoặc sau khi ăn nhẹ không chất béo. Cmax tỷ lệ với liều dùng từ 5-10 mg theo chế độ dùng thuốc hàng ngày. Ở liều đơn 20 mg/tuần trở lên, sự tăng Cmax theo tỷ lệ ít hơn so với liều dùng, tuy nhiên AUC cho thấy tăng tỷ lệ với liều dùng từ 5-70 mg.
Ảnh hưởng của thức ăn
Ở người khỏe mạnh, các bữa ăn giàu chất béo làm giảm 22% nồng độ toàn thân với viên nén Afinitor 10mg (dựa vào đo AUC) và 54% nồng độ đỉnh Cmax trong máu. Bữa ăn nhẹ ít chất béo làm giảm 32% AUC và 42% Cmax.
Tuy nhiên thức ăn không có ảnh hưởng rõ rệt đến đường biểu diễn nồng độ thuốc theo thời gian của pha sau hấp thu 24 tiếng.
Phân bố
Tỷ số nồng độ trong máu so với trong huyết tương của everolimus, phụ thuộc vào nồng độ trong khoảng từ 5-5000 ng/mL, là 17% đến 73%. Đã quan sát thấy lượng everolimus trong huyết tương xấp xỉ 20% nồng độ trong máu ở bệnh nhân ung thư dùng Afinitor 10 mg/ngày. Sự gắn kết với protein huyết tương khoảng 74% ở cả người khỏe mạnh và bệnh nhân suy gan trung bình. Với bệnh nhân bị khối u đặc tiến xa, Vd ở các khoang trung tâm biểu kiến là 191 lít và 517 lít ở các khoang ngoại vi biểu kiến.
Sau khi tiêm tĩnh mạch trên mô hình chuột cống, everolimus đi qua hàng rào máu não theo cách phụ thuộc liều không tuyến tính, cho thấy sự bão hoà của bơm đẩy thuốc ở hàng rào máu não. Sự thâm nhập của everolimus vào não cũng đã được chứng minh ở chuột cống dùng các liều uống everolimus.
Biến đổi sinh học/Chuyển hóa
Everolimus là một cơ chất của CYP3A4 và PgP. Sau khi uống, everolimus là thành phần lưu hành chính trong máu ở người. 6 chất chuyển hóa chính của everolimus đã được phát hiện trong máu ở người, bao gồm 3 chất chuyển hóa monohydroxyl hóa, 2 sản phẩm thủy phân mở vòng và một chất liên hợp phosphatidylcholin của everolimus. Các chất chuyển hóa này cũng được xác định ở các loài động vật được dùng trong nghiên cứu độc tính và cho thấy có hoạt tính kém hơn everolimus khoảng 100 lần. Vì vậy, chất mẹ được xem là đóng góp phần lớn vào hoạt tính dược lý của everolimus.
Thải trừ
Chưa có các nghiên cứu thải trừ đặc hiệu của everolimus được thực hiện ở bệnh nhân ung thư; tuy nhiên, hiện có các dữ liệu từ chỉ định ghép tạng. Sau khi dùng liều duy nhất everolimus gắn phóng xạ kết hợp với ciclosporin, 80% hoạt tính phóng xạ được phát hiện ở phân trong khi 5% được thải trừ ở nước tiểu. Không phát hiện thấy chất mẹ trong nước tiểu hoặc phân.
Dược động học ở trạng thái ổn định
Sau khi sử dụng viên nén Afinitor cho bệnh nhân có khối u đặc tiến xa, AUC0-t ở trạng thái ổn định tỷ lệ với liều dùng trong khoảng từ 5-10 mg theo chế độ dùng thuốc hàng ngày. Trạng thái ổn định đạt được trong vòng 2 tuần. Cmax tỷ lệ với liều dùng từ 5-10 mg theo chế độ dùng thuốc hàng ngày. Tmax đạt được lúc 1-2 giờ sau liều. Có sự tương quan có ý nghĩa giữa AUC0-t và nồng độ đáy trước liều ở trạng thái ổn định theo chế độ dùng thuốc hàng ngày. Thời gian bán thải trung bình của everolimus khoảng 30 giờ.
Dân số đặc biệt
Bệnh nhân suy gan
Tính an toàn, khả năng dung nạp và dược động học của Afinitor đã được đánh giá trong hai nghiên cứu dùng viên nén Afinitor liều duy nhất ở người suy giảm chức năng gan so với những người có chức năng gan bình thường. Trong một nghiên cứu, AUC trung bình của everolimus ở 8 bệnh nhân suy giảm chức năng gan trung bình (Child-Pugh B) cao gấp đôi ở 8 bệnh nhân có chức năng gan bình thường. Trong nghiên cứu thứ hai trên 34 bệnh nhân suy giảm chức năng gan khác nhau, so với những người bình thường, có sự tăng gấp 1,6 lần đối với những người suy gan nhẹ (Child-Pugh A), 3,3 lần đối với những người suy gan trung bình (Child-Pugh B) và 3,6 lần đối với những người suy gan nặng (Child-Pugh C) về nồng độ (tức là AUC0-inf). Mô phỏng dược động học đa liều ủng hộ cho các khuyến cáo liều dùng ở những người suy gan dựa trên tình trạng Child Pugh của họ.
Căn cứ theo dữ liệu phân tích gộp của 2 nghiên cứu, việc điều chỉnh liều được khuyến cáo cho bệnh nhân suy gan (xem các phần Cảnh báo và Liều lượng và Cách dùng).
Bệnh nhân suy thận
Trong một phân tích dược động học theo nhóm đối tượng nghiên cứu ở 170 bệnh nhân bị ung thư tiến xa, không phát hiện ảnh hưởng đáng kể về độ thanh thải creatinine (25-178 mL/phút) trên độ thanh thải đường uống (CL/F) của everolimus. Suy thận sau ghép (độ thanh thải creatinine từ 11-107 mL/phút) không ảnh hưởng đến dược động học của everolimus ở bệnh nhân được ghép tạng.
Bệnh nhân trẻ em (dưới 18 tuổi)
Không có chỉ định sử dụng Afinitor ở nhóm bệnh nhân trẻ em bị ung thư (xem phần Liều lượng và Cách dùng).
Bệnh nhân cao tuổi (từ 65 tuổi trở lên)
Trong một đánh giá dược động học theo nhóm đối tượng nghiên cứu ở bệnh nhân ung thư, không phát hiện ảnh hưởng đáng kể của tuổi tác (27-85 tuổi) trên độ thanh thải đường uống của everolimus (CL/F: từ 4,8-54,5 lít/giờ).
Chủng tộc
Độ thanh thải đường uống (CL/F) tương tự nhau ở bệnh nhân ung thư người Nhật và người da trắng có chức năng gan tương tự.
Dựa trên phân tích dược động học theo nhóm đối tượng nghiên cứu, độ thanh thải đường uống (CL/F) của everolimus cao hơn trung bình 20% ở bệnh nhân da đen được ghép tạng.
Mối quan hệ giữa nồng độ và đáp ứng
Có một mối tương quan trung bình giữa sự giảm phosphoryl hóa của 4E-BP1 (P4E-BP1) ở mô khối u và Cmin trung bình của everolimus trong máu ở trạng thái ổn định sau khi dùng hàng ngày 5 hoặc 10mg everolimus. Các dữ kiện thêm cho thấy sự ức chế phosphoryl hóa của S6 kinase rất nhạy với sự ức chế mTOR bởi everolimus. Sự ức chế phosphoryl hóa của elF-4G là hoàn toàn ở tất cả các trị số Cmin sau khi dùng liều hàng ngày 10mg.
Một xu hướng gợi ý thời gian sống còn không tiến triển bệnh lâu hơn với Cmin của everolimus được chuẩn hóa theo thời gian cao hơn (được định nghĩa là diện tích dưới đường cong Cmin theo thời gian từ lúc bắt đầu nghiên cứu cho đến thời gian có biến cố/thời gian từ lúc bắt đầu nghiên cứu cho đến thời gian có biến cố) thể hiện rõ rệt ở những bệnh nhân bị khối u thần kinh nội tiết tiến xa có nguồn gốc tụy (pNET, tỷ số nguy hại 0,73; khoảng tin cậy (CI) 95%: 0,50-1,08) và ở những bệnh nhân bị khối u carcinoid tiến xa (tỷ số nguy hại 0,66; khoảng tin cậy (CI) 95%: 0,40-1,08). Cmin của everolimus ảnh hưởng đến xác suất giảm kích thước khối u (p < 0,001) với tỷ số chênh là 1,62 và 1,46 tương ứng với sự thay đổi mức nồng độ từ 5 ng/mL đến 10 ng/mL ở những bệnh nhân bị khối u thần kinh nội tiết tiến xa có nguồn gốc tụy và ở những bệnh nhân bị khối u carcinoid tiến xa.
An toàn tiền lâm sàng
Dữ liệu an toàn tiền lâm sàng của everolimus đã được đánh giá ở chuột nhắt, chuột cống, chuột lang, khỉ và thỏ. Các cơ quan đích chính là hệ sinh sản ở giống đực và cái (thoái hóa ống dẫn tinh, giảm lượng tinh trùng ở mào tinh hoàn và teo tử cung) ở một số loài, phổi chuột cống và chuột nhắt (tăng đại thực bào ở phế nang) và mắt (đục đường khớp trước thủy tinh thể) chỉ ở chuột cống. Đã ghi nhận những thay đổi nhỏ ở thận của chuột cống (tăng lipofuscin ở biểu mô ống thận liên quan với tuổi, tăng ứ nước thận) và chuột nhắt (nặng thêm tổn thương có sẵn). Không có dấu hiệu độc tính với thận ở khỉ hoặc chuột lang.
Everolimus dường như tự phát làm nặng thêm các bệnh có sẵn (viêm cơ tim mạn tính ở chuột cống, nhiễm virus coxsackie ở huyết tương và tim của khỉ, nhiễm ký sinh trùng coccidian ở đường tiêu hóa của chuột lang, tổn thương da ở chuột nhắt và khỉ). Các kết quả này thường được quan sát thấy ở mức nồng độ toàn thân trong phạm vi nồng độ điều trị hoặc cao hơn, ngoại trừ kết quả ở chuột cống xảy ra ở dưới mức nồng độ điều trị là do sự phân bố thuốc vào mô cao.
Trong các nghiên cứu trên chuột cống chưa trưởng thành với các liều thấp 0,15 mg/kg/ngày, độc tính toàn thân bao gồm giảm sự lên cân và tiêu thụ thức ăn và chậm đạt được một số mốc phát triển ở tất cả các liều, với sự hồi phục hoàn toàn hoặc một phần sau khi ngừng dùng thuốc. Trong trường hợp ngoại lệ có thể có những phát hiện ở thủy tinh thể đặc hiệu cho chuột cống, vị trí mà ở động vật còn non nhạy cảm hơn, dường như không có sự khác biệt đáng kể về tính nhạy cảm của động vật chưa trưởng thành với các tác dụng phụ của everolimus khi so với các động vật trưởng thành ở các liều từ 0,5-5 mg/kg/ngày. Không có độc tính liên quan rõ ràng ở khỉ chưa trưởng thành với các liều đến 0,5 mg/kg/ngày trong 4 tuần.
Các nghiên cứu về độc tính gen bao gồm các tiêu chí về độc tính gen liên quan cho thấy không có bằng chứng về hoạt tính gây gãy nhiễm sắc thể hoặc gây đột biến. Sử dụng everolimus đến 2 năm không thấy bất kỳ tiềm năng gây ung thư nào ở chuột nhắt và chuột cống với liều cao nhất, tương ứng lần lượt với 3,9 lần và 0,2 lần mức nồng độ lâm sàng ước tính với liều 10 mg/ngày.
Chỉ định/Công dụng
Viên nén Afinitor được chỉ định để điều trị cho:
- Phối hợp với exemestane cho phụ nữ sau mãn kinh bị ung thư vú tiến xa có thụ thể hormone dương tính, HER2/neu âm tính, sau khi tái phát hoặc tiến triển mà không có di căn nội tạng có triệu chứng và đã được điều trị trước bằng một thuốc ức chế aromatase không steroid.
- Bệnh nhân người lớn trong giai đoạn tiến triển bệnh u thần kinh nội tiết nguồn gốc tụy, biệt hóa tốt hoặc trung bình, không phẫu thuật được hoặc đã có di căn.
- Bệnh nhân người lớn trong giai đoạn tiến triển bệnh u thần kinh nội tiết không chức năng nguồn gốc tiêu hóa hoặc phổi, biệt hóa tốt (độ 1 hoặc độ 2), không phẫu thuật được hoặc đã có di căn.
- Bệnh nhân bị carcinôm tế bào thận tiến xa với tình trạng bệnh vẫn tiến triển khi đang điều trị hoặc sau điều trị bằng các thuốc nhắm đích VEGF.
Liều lượng & Cách dùng
Chế độ liều
Việc điều trị bằng Afinitor cần được bắt đầu bởi một bác sĩ có kinh nghiệm trong việc sử dụng các liệu pháp chống ung thư.
Nên điều trị liên tục khi vẫn còn ghi nhận được lợi ích lâm sàng hoặc cho đến khi xảy ra độc tính không chấp nhận được.
Nhóm bệnh nhân mục tiêu nói chung
Liều dùng trong ung thư vú tiến xa có thụ thể hormone dương tính, khối u thần kinh-nội tiết tiến xa có nguồn gốc tiêu hóa, phổi hoặc tụy và carcinôm tế bào thận tiến xa
Liều khuyến cáo của Afinitor là 10 mg, uống 1 lần/ngày (xem phần Cách dùng).
Thay đổi liều
Phản ứng bất lợi
Việc xử trí các phản ứng bất lợi của thuốc (ADR) nặng hoặc không dung nạp được có thể đòi hỏi phải tạm ngưng (có hoặc không có kết hợp với giảm liều) hay ngừng hẳn việc điều trị bằng Afinitor. Nếu cần phải giảm liều, liều đề nghị thấp hơn khoảng 50% so với liều dùng hàng ngày trước đây (xem phần Cảnh báo). Đối với việc giảm liều xuống dưới hàm lượng viên nén thấp nhất hiện có, nên xem xét dùng thuốc cách nhật.
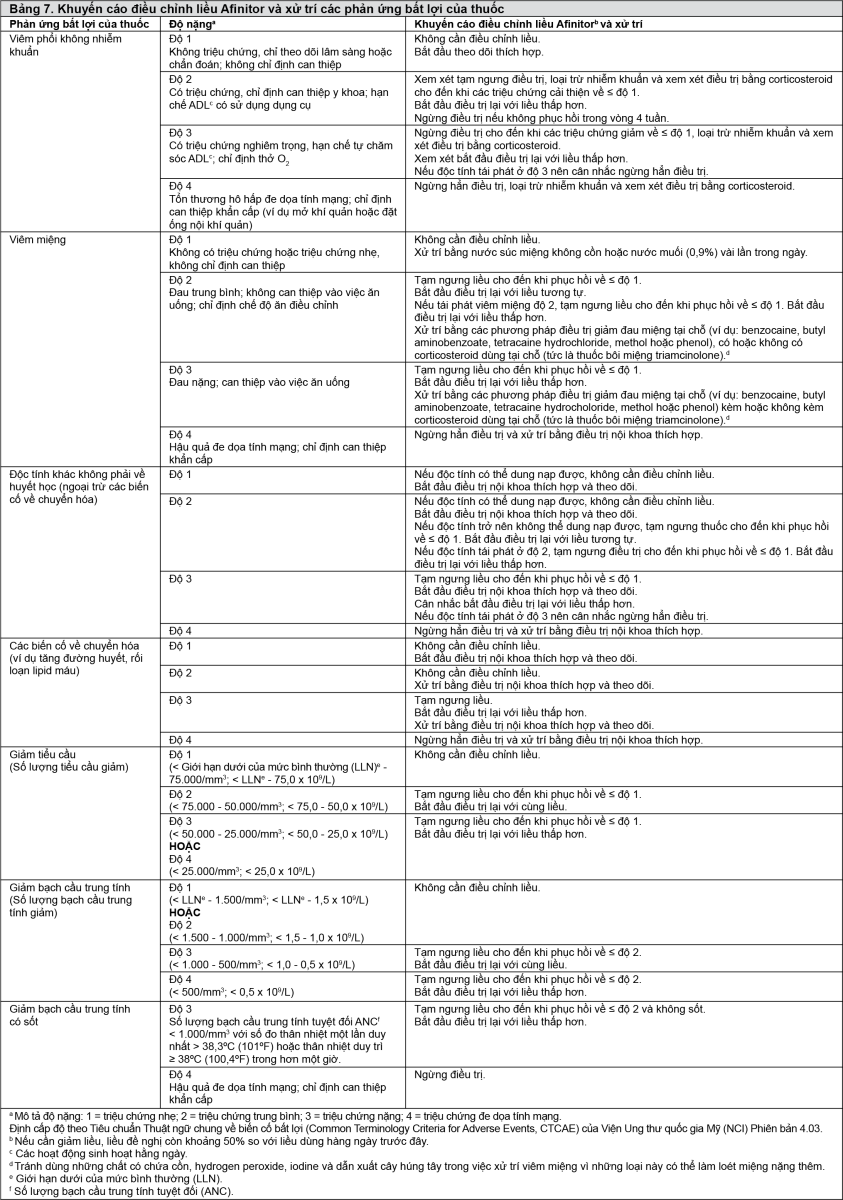
Bảng 6 tóm tắt các khuyến cáo về tạm ngưng, giảm liều hoặc ngừng hẳn việc điều trị bằng Afinitor trong việc xử trí các phản ứng bất lợi của thuốc, bao gồm cả các khuyến cáo xử trí chung khi phù hợp. Sự đánh giá lâm sàng của bác sĩ điều trị sẽ hướng dẫn kế hoạch xử trí cho mỗi bệnh nhân dựa trên đánh giá lợi ích so với nguy cơ trên từng bệnh nhân.
- xem Bảng 7.
Chất ức chế trung bình CYP3A4 hoặc P-glycoprotein (PgP)
Cần thận trọng khi dùng phối hợp với chất ức chế trung bình CYP3A4 hoặc PgP. Nếu bệnh nhân cần sử dụng kết hợp với một chất ức chế trung bình CYP3A4 hoặc PgP thì giảm liều Afinitor xuống còn khoảng 50% so với liều dùng hàng ngày trước đây. Có thể giảm liều nhiều hơn nữa để kiểm soát các phản ứng bất lợi của thuốc. Đối với việc giảm liều xuống dưới hàm lượng Afinitor thấp nhất hiện có, nên xem xét dùng thuốc cách nhật. Có thể cần phải giảm liều thêm để xử trí các phản ứng bất lợi của thuốc (xem các phần Cảnh báo và Tương tác thuốc).
Ung thư vú tiến xa có thụ thể hormone dương tính, bệnh u thần kinh nội tiết tiến xa có nguồn gốc tiêu hóa, phổi hoặc tụy, carcinôm tế bào thận tiến xa: Nếu ngưng sử dụng chất ức chế trung bình CYP3A4/PgP, nên xem xét đến giai đoạn thải thuốc ít nhất 2 đến 3 ngày (thời gian trung bình cho các thuốc ức chế trung bình thông dụng nhất) trước khi tăng liều Afinitor. Liều Afinitor có thể trở về mức liều trước đó khi bắt đầu sử dụng chất ức chế trung bình CYP3A4/PgP (xem phần Cảnh báo và Tương tác thuốc).
Chất gây cảm ứng mạnh CYP3A4
Tránh sử dụng đồng thời với chất gây cảm ứng mạnh CYP3A4.
Ung thư vú tiến xa có thụ thể hormone dương tính, bệnh u thần kinh nội tiết tiến xa có nguồn gốc tiêu hóa, phổi hoặc tụy, carcinôm tế bào thận tiến xa: Nếu bệnh nhân cần dùng kết hợp với một chất gây cảm ứng mạnh CYP3A4, cân nhắc việc gấp đôi liều Afinitor hằng ngày (dựa trên các dữ liệu dược động học) thêm không quá 5mg mỗi lần tăng liều. Dự đoán liều Afinitor này sẽ điều chỉnh diện tích dưới đường cong (AUC) đến phạm vi không có chất gây cảm ứng. Tuy nhiên, không có dữ liệu lâm sàng về sự điều chỉnh liều ở bệnh nhân đang dùng chất gây cảm ứng mạnh CYP3A4. Nếu ngừng sử dụng chất gây cảm ứng mạnh CYP3A4 thì cân nhắc giai đoạn thải thuốc ít nhất từ 3 đến 5 ngày (thời gian hợp lý cho quá trình loại bỏ cảm ứng enzyme quan trọng) trước khi giảm liều Afinitor trở về liều đã dùng trước khi bắt đầu sử dụng chất gây cảm ứng mạnh CYP3A4 (xem các phần Cảnh báo và Tương tác thuốc).
Liều dùng ở nhóm bệnh nhân đặc biệt
Nhóm bệnh nhân trẻ em (dưới 18 tuổi): Không khuyến cáo dùng Afinitor cho bệnh nhân trẻ em bị ung thư.
Bệnh nhân cao tuổi (65 tuổi trở lên): Không cần điều chỉnh liều (xem phần Dược lý).
Suy thận: Không cần điều chỉnh liều (xem phần Dược lý).
Suy gan
Ung thư vú tiến xa có thụ thể hormone dương tính, bệnh u thần kinh nội tiết tiến xa có nguồn gốc tiêu hóa, phổi hoặc tụy, carcinôm tế bào thận tiến xa:
• Suy gan nhẹ (Child-Pugh A): Liều khuyến cáo là 7,5 mg/ngày
• Suy gan trung bình (Child-Pugh B): Liều khuyến cáo là 5 mg/ngày, có thể giảm xuống đến liều 2,5mg nếu không dung nạp tốt.
• Suy gan nặng (Child-Pugh C): Không khuyến cáo sử dụng. Nếu lợi ích mong muốn vượt trội hơn nguy cơ thì liều dùng không được vượt quá 2,5 mg/ngày.
Cần điều chỉnh liều nếu tình trạng gan (Child-Pugh) của bệnh nhân thay đổi trong thời gian điều trị.
Cách dùng
Afinitor được uống mỗi ngày một lần vào cùng một thời điểm, cùng với thức ăn hoặc không (xem phần Dược lý).
Nên nuốt cả viên nén Afinitor với một ly nước. Không nên nhai hoặc nghiền nát.
Đối với bệnh nhân không thể nuốt cả viên thuốc thì có thể hòa tan hoàn toàn viên Afinitor trong một ly nước (chứa khoảng 30mL) bằng cách khuấy nhẹ đến khi viên thuốc tan hết (khoảng 7 phút), ngay trước khi uống. Nên tráng ly với cùng một lượng nước và nuốt hoàn toàn lượng nước tráng ly này để đảm bảo dùng toàn bộ liều thuốc (xem phần Dược lý).
Quên liều
Afinitor vẫn có thể được dùng đến 6 giờ sau thời điểm thường dùng. Sau hơn 6 giờ, nên bỏ qua liều cho ngày đó. Ngày hôm sau, nên uống Afinitor vào thời điểm dùng thuốc thường lệ. Không nên dùng liều gấp đôi để bù cho liều đã quên.
Hướng dẫn sử dụng, xử lý và hủy bỏ
Mức độ hấp thu của everolimus qua tiếp xúc tại chỗ chưa được biết. Do đó người chăm sóc nên tránh tiếp xúc với hỗn dịch của viên nén Afinitor. Rửa tay kỹ lưỡng trước và sau khi chuẩn bị các hỗn dịch.
Cảnh báo
Viêm phổi không nhiễm khuẩn
Viêm phổi không nhiễm khuẩn là một loại tác động của nhóm các dẫn xuất rapamycin. Các trường hợp viêm phổi không nhiễm khuẩn (bao gồm cả bệnh phổi kẽ) cũng đã được mô tả ở bệnh nhân dùng Afinitor (xem phần Tác dụng ngoại ý). Một số trong những trường hợp này ở mức nặng và trong trường hợp rất hiếm gặp đã ghi nhận kết cuộc tử vong.
Cần xem xét chẩn đoán viêm phổi không nhiễm khuẩn ở bệnh nhân có các dấu hiệu và triệu chứng hô hấp không đặc hiệu như giảm oxy mô, tràn dịch màng phổi, ho hoặc khó thở và ở những người mà các nguyên nhân nhiễm khuẩn, khối u tân sinh và các nguyên nhân khác không do thuốc đã được loại trừ bằng các xét nghiệm thích hợp. Cần chẩn đoán phân biệt để loại trừ các nhiễm trùng cơ hội như viêm phổi do Pneumocystis jirovecii (PJP: Pneumocystis jirovecii pneumonia) khi chẩn đoán viêm phổi không nhiễm khuẩn (xem phần "Nhiễm trùng").
Nên khuyên bệnh nhân báo cáo ngay tức thì bất kỳ triệu chứng nào về hô hấp mới xảy ra hoặc xấu đi.
Đối với những bệnh nhân có các thay đổi trên X-quang gợi ý viêm phổi không nhiễm khuẩn và có ít triệu chứng hoặc không có triệu chứng, có thể tiếp tục điều trị bằng Afinitor mà không cần thay đổi liều (xem phần Liều lượng và Cách dùng, Bảng 6).
Nếu các triệu chứng ở mức độ trung bình (độ 2), nên xem xét tạm ngưng điều trị cho đến khi các triệu chứng cải thiện. Có thể chỉ định dùng corticosteroid. Có thể sử dụng lại Afinitor với liều hàng ngày giảm còn khoảng 50% so với liều đã dùng trước đây.
Đối với các trường hợp viêm phổi độ 3 không nhiễm khuẩn, phải ngừng điều trị bằng Afinitor đến khi triệu chứng giảm xuống còn độ 1 trở xuống. Có thể sử dụng lại Afinitor với liều giảm còn khoảng 50% so với liều đã dùng trước đây tùy thuộc vào tình trạng lâm sàng của từng bệnh nhân. Nếu độc tính tái phát ở độ 3 thì cân nhắc ngừng hẳn Afinitor. Đối với các trường hợp viêm phổi độ 4 không nhiễm khuẩn thì nên ngừng hẳn Afinitor. Có thể chỉ định dùng corticosteroid cho đến khi các triệu chứng lâm sàng lui hẳn.
Cần xem xét phòng bệnh viêm phổi do Pneumocystis jirovecii (PJP) cho các bệnh nhân phải điều trị viêm phổi không nhiễm khuẩn bằng corticosteroid.
Sự xuất hiện viêm phổi cũng đã được báo cáo ở mức liều đã giảm (xem phần Liều lượng và Cách dùng, Bảng 6).
Nhiễm trùng
Afinitor có đặc tính ức chế miễn dịch và có thể làm cho bệnh nhân dễ bị nhiễm khuẩn, nhiễm nấm, nhiễm virus hoặc nhiễm sinh vật đơn bào kể cả nhiễm trùng do các tác nhân gây bệnh cơ hội (xem phần Tác dụng ngoại ý). Nhiễm trùng tại chỗ và toàn thân bao gồm cả viêm phổi, các nhiễm khuẩn khác, nhiễm nấm xâm lấn như bệnh nấm Aspergillus, nhiễm nấm Candida, hoặc viêm phổi do Pneumocystis jirovecii (PJP) và nhiễm virus kể cả tái kích hoạt virus viêm gan B đã được mô tả ở những bệnh nhân dùng Afinitor. Một số trong những trường hợp nhiễm trùng này có mức độ nặng (ví dụ: dẫn đến nhiễm trùng huyết [bao gồm cả sốc nhiễm khuẩn], suy hô hấp hoặc suy gan) và đôi khi đã có kết cuộc tử vong ở bệnh nhân người lớn và trẻ em (xem phần Tác dụng ngoại ý)
Bác sĩ và bệnh nhân cần phải nhận thức về sự tăng nguy cơ nhiễm trùng khi dùng Afinitor. Trước khi bắt đầu điều trị bằng Afinitor, cần xử trí nhiễm trùng có từ trước. Trong khi điều trị bằng Afinitor, phải cảnh giác với các dấu hiệu và triệu chứng nhiễm trùng; nếu đã chẩn đoán nhiễm trùng, phải tiến hành điều trị thích hợp ngay lập tức và xem xét tạm ngưng điều trị hoặc ngừng hẳn điều trị bằng Afinitor.
Nếu đã chẩn đoán nhiễm nấm xâm lấn toàn thân, phải ngừng dùng Afinitor và xử trí bằng liệu pháp kháng nấm thích hợp.
Các trường hợp bệnh nhân điều trị bằng everolimus bị tử vong vì viêm phổi do Pneumocystis jirovecii đã được báo cáo. Viêm phổi do Pneumocystis jirovecii có thể liên quan đến việc dùng đồng thời everolimus với corticosteroid hay các thuốc làm suy giảm miễn dịch. Xem xét phòng bệnh viêm phổi do Pneumocystis jirovecii khi phải dùng đồng thời everolimus với corticosteroid hay các thuốc làm suy giảm miễn dịch khác.
Phản ứng quá mẫn
Các phản ứng quá mẫn được biểu hiện bằng các triệu chứng bao gồm, nhưng không chỉ giới hạn ở phản vệ, khó thở, đỏ bừng mặt, đau ngực hoặc phù mạch (ví dụ: phù khí đạo hoặc lưỡi, có hoặc không có suy hô hấp) đã được quan sát thấy với everolimus (xem phần Chống chỉ định).
Phù mạch do dùng đồng thời everolimus và các thuốc ức chế men chuyển angiotensin (ACE: Angiotensin-converting enzyme)
Bệnh nhân điều trị đồng thời bằng everolimus với các thuốc ức chế men chuyển có thể làm tăng nguy cơ phù mạch (ví dụ: phù nề đường hô hấp hay lưỡi có thể đi kèm hoặc không đi kèm suy hô hấp.
Viêm miệng
Viêm miệng bao gồm loét miệng và viêm niêm mạc miệng, là phản ứng bất lợi được báo cáo thường gặp nhất ở những bệnh nhân được điều trị bằng Afinitor (xem phần Tác dụng ngoại ý). Viêm miệng thường xảy ra trong vòng 8 tuần điều trị đầu tiên. Nếu viêm miệng xảy ra, khuyến cáo nên điều trị tại chỗ, nhưng nên tránh dùng các sản phẩm có chứa cồn, hydro peroxid, iod hoặc cỏ xạ hương (thyme) vì chúng có thể làm trầm trọng thêm tình trạng này (xem phần Liều lượng và cách dùng, Bảng 6). Không nên dùng thuốc chống nấm trừ khi đã chẩn đoán nhiễm nấm (xem phần Tương tác thuốc).
Trong một nghiên cứu ở một nhóm gồm 92 bệnh nhân ung thư vú sau mãn kinh, dung dịch uống corticosteroid không cồn dùng tại chỗ đã được sử dụng như nước súc miệng trong 8 tuần đầu tiên bắt đầu điều trị bằng Afinitor kết hợp với exemestane. Trong nghiên cứu này, đã quan sát thấy giảm có ý nghĩa lâm sàng về tỷ lệ và mức độ nặng của viêm miệng (xem phần Tác dụng ngoại ý).
Các trường hợp suy thận
Các trường hợp suy thận (bao gồm cả suy thận cấp), một số có kết cuộc tử vong đã được quan sát thấy ở bệnh nhân điều trị bằng Afinitor. Cần theo dõi chức năng thận đặc biệt ở những bệnh nhân có thêm nhiều yếu tố nguy cơ có thể đưa đến suy chức năng thận (xem phần "Xét nghiệm và theo dõi" và Tác dụng ngoại ý).
Xét nghiệm và theo dõi
Chức năng thận
Tăng creatinine huyết thanh, thường nhẹ và protein niệu đã được báo cáo ở các bệnh nhân sử dụng Afinitor (xem phần Tác dụng ngoại ý). Khuyến cáo theo dõi chức năng thận, bao gồm cả đo lường nitơ urê huyết (BUN), protein niệu hoặc creatinine huyết thanh trước khi bắt đầu điều trị bằng Afinitor và theo dõi định kỳ sau đó.
Đường huyết
Tăng đường huyết đã được báo cáo ở các bệnh nhân sử dụng Afinitor (xem phần Tác dụng ngoại ý). Khuyến cáo theo dõi đường huyết lúc đói trước khi bắt đầu điều trị bằng Afinitor và theo dõi định kỳ sau đó. Khuyến cáo theo dõi thường xuyên hơn khi Afinitor được dùng đồng thời với các thuốc khác có thể làm tăng đường huyết. Cần đạt được sự kiểm soát đường huyết tối ưu trước khi bắt đầu điều trị bằng Afinitor cho bệnh nhân.
Lipid máu
Lipid máu bất thường (bao gồm tăng cholesterol máu và tăng triglyceride máu) đã được báo cáo ở những bệnh nhân sử dụng Afinitor. Khuyến cáo theo dõi cholesterol máu và triglyceride máu trước khi bắt đầu điều trị bằng Afinitor và định kỳ sau đó cũng như kiểm soát bằng liệu pháp nội khoa thích hợp.
Các thông số về huyết học
Đã có báo cáo giảm hemoglobin, lympho bào, tiểu cầu và bạch cầu trung tính ở những bệnh nhân dùng Afinitor (xem phần Tác dụng ngoại ý). Khuyến cáo theo dõi công thức máu toàn phần trước khi bắt đầu điều trị bằng Afinitor và theo dõi định kỳ sau đó.
Các yếu tố tiên lượng trong khối u thần kinh-nội tiết nguồn gốc từ đường tiêu hóa hoặc phổi
Ở những bệnh nhân có khối u thần kinh nội tiết không chức năng nguồn gốc từ đường tiêu hóa hoặc phổi và các yếu tố ban đầu tiên lượng tốt, ví dụ: hồi tràng là nguồn gốc ban đầu của khối u và trị số chromogranin A bình thường hoặc không có sự liên quan đến xương, nên thực hiện đánh giá nguy cơ-lợi ích trên từng bệnh nhân trước khi bắt đầu điều trị bằng Afinitor. Một bằng chứng còn hạn chế về lợi ích thời gian sống còn không tiến triển bệnh (PFS) đã được báo cáo trong phân nhóm bệnh nhân với hồi tràng là nguồn gốc ban đầu của khối u.
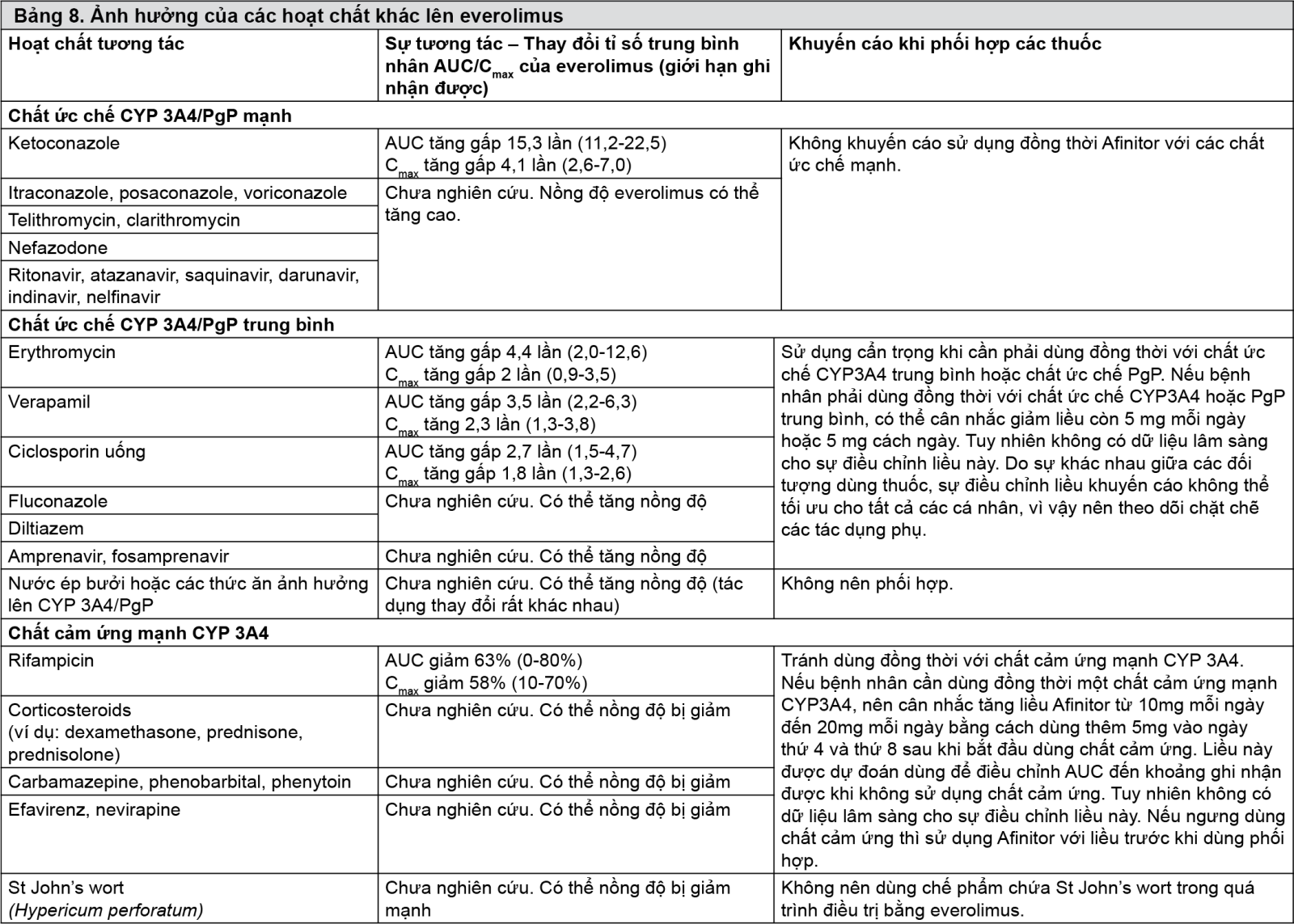
Tương tác
Tránh sử dụng kết hợp với các chất ức chế mạnh CYP3A4 hoặc PgP (xem phần Tương tác thuốc).
Thận trọng khi dùng phối hợp với chất ức chế CYP3A4 hoặc chất ức chế PgP trung bình. Nếu phải dùng kết hợp Afinitor với chất ức chế CYP3A4 hoặc chất ức chế PgP trung bình, cần theo dõi bệnh nhân cẩn thận về các tác dụng không mong muốn và giảm liều Afinitor nếu cần thiết (xem phần Liều lượng và Cách dùng và Tương tác thuốc).
Tránh dùng kết hợp với chất gây cảm ứng CYP3A4 hoặc PgP mạnh (xem phần Tương tác thuốc). Nếu phải dùng kết hợp Afinitor với chất gây cảm ứng CYP3A4 hoặc PgP mạnh, cần theo dõi bệnh nhân cẩn thận về đáp ứng lâm sàng. Xem xét tăng liều Afinitor khi dùng kết hợp với chất gây cảm ứng CYP3A4 hoặc PgP mạnh nếu không thể điều trị thay thế (xem phần Liều lượng và Cách dùng và phần Tương tác thuốc).
Do khả năng tương tác thuốc, cần thận trọng khi dùng Afinitor phối hợp với cơ chất của CYP3A4 dùng đường uống có chỉ số điều trị hẹp. Nếu Afinitor được dùng cùng với cơ chất của CYP3A4 dùng đường uống có chỉ số điều trị hẹp, cần theo dõi bệnh nhân để phát hiện các tác dụng không mong muốn được mô tả trong phần thông tin sản phẩm của cơ chất của CYP3A4 dùng đường uống (xem phần Tương tác thuốc).
Suy gan
Nồng độ everolimus tăng lên ở bệnh nhân suy gan nhẹ (Child-Pugh A), trung bình (Child-Pugh B) và nặng (Child-Pugh C) (xem phần Dược lý).
Không khuyến cáo dùng Afinitor ở bệnh nhân trên 18 tuổi bị suy gan nặng (Child-Pugh C) trừ khi lợi ích dự tính vượt trội hơn nguy cơ (xem các phần Liều lượng và Cách dùng và Dược lý).
Tiêm chủng
Cần tránh sử dụng vaccin sống và tiếp xúc gần với những người đã tiêm chủng vaccin sống trong thời gian điều trị bằng Afinitor (xem phần Tương tác thuốc).
Lactose
Những bệnh nhân có bệnh di truyền hiếm gặp không dung nạp galactose hoặc khiếm khuyết men lactase Lapp hoặc kém hấp thu glucose-galactose không nên sử dụng thuốc này.
Biến chứng liền sẹo vết thương
Tiến trình liền sẹo vết thương bị ảnh hưởng bởi các dẫn xuất rapamycin, bao gồm cả Afinitor. Cần thận trọng khi sử dụng Afinitor trong giai đoạn chu phẫu.
Khối u carcinoid
Tính hiệu quả và an toàn của Afinitor chưa được xác lập trên bệnh nhân có khối u carcinoid.
Ảnh hưởng của thuốc đối với công việc
Afinitor có thể gây ảnh hưởng nhẹ đến trung bình trên khả năng lái xe và vận hành máy móc. Bệnh nhân cần được cảnh báo thận trọng khi lái xe hoặc vận hành máy móc nếu có biểu hiện mệt mỏi khi điều trị với Afinitor.
Quá Liều
Quá liều
Trong các nghiên cứu trên động vật, everolimus cho thấy tiềm năng độc tính cấp thấp. Không quan sát thấy độc tính gây tử vong hoặc độc tính nặng ở chuột nhắt hoặc chuột cống được cho dùng liều đơn 2.000 mg/kg (thử giới hạn).
Kinh nghiệm được báo cáo về quá liều ở người còn rất hạn chế. Các liều đơn đến 70mg đã được dùng với khả năng dung nạp cấp có thể chấp nhận được.
Cách xử lý
Cần tiến hành các biện pháp hỗ trợ chung trong tất cả các trường hợp quá liều.
Chống chỉ định
Afinitor chống chỉ định cho các bệnh nhân quá mẫn với hoạt chất, với các dẫn xuất rapamycin khác hoặc với bất kỳ thành phần nào của tá dược (xem phần Cảnh báo).
Sử dụng ở phụ nữ có thai và cho con bú
Phụ nữ có thai
Tóm tắt nguy cơ
Không có dữ liệu đầy đủ từ việc sử dụng Afinitor ở phụ nữ mang thai. Chưa rõ nguy cơ có thể xảy ra đối với người. Các nghiên cứu trên động vật đã cho thấy ảnh hưởng độc tính đối với sinh sản bao gồm độc tính đối với phôi và độc tính đối với thai. Không nên dùng Afinitor cho phụ nữ mang thai trừ khi lợi ích có thể có lớn hơn nguy cơ có thể xảy ra đối với thai.
Dữ liệu trên động vật
Dùng everolimus cho chuột cống cái với liều uống ≥ 0,1 mg/kg (khoảng 4% AUC0-24h ở bệnh nhân dùng liều 10 mg/ngày) đã dẫn đến tăng tỷ lệ mất phôi trước khi làm tổ. Everolimus đi qua nhau thai và gây độc đối với thai. Ở chuột cống, everolimus gây độc đối với phôi/thai ở nồng độ toàn thân dưới nồng độ điều trị. Điều này được biểu hiện dưới dạng tử vong và giảm trọng lượng thai. Tỷ lệ biến đổi và dị dạng xương (ví dụ khe hở xương ức) tăng với liều 0,3 và 0,9 mg/kg. Ở thỏ, độc tính đối với phôi thể hiện rõ qua sự tăng tiêu thai ở cuối thai kỳ xảy ra với liều 0,8 mg/kg (9,6 mg/m2), khoảng 1,6 lần liều 10 mg/ngày ở người lớn, trên cơ sở diện tích bề mặt cơ thể. Ở chuột cống, không có bằng chứng về các phản ứng bất lợi do điều trị cho chuột đực bằng everolimus về các thông số của phôi-thai.
Dữ liệu trên người
Đã có báo cáo về phơi nhiễm everolimus trong thời kỳ mang thai, một số là do phơi nhiễm qua người mẹ và một số là qua người cha (mang thai ở một bạn tình nữ của một bệnh nhân nam trong khi điều trị bằng everolimus). Không có báo cáo về bất thường bẩm sinh. Trong một số trường hợp, thai kỳ tiến triển không có biến cố và sinh ra con khỏe mạnh, bình thường.
Phụ nữ cho con bú
Tóm tắt nguy cơ
Chưa rõ everolimus có được bài tiết vào sữa mẹ hay không. Không có trường hợp phơi nhiễm everolimus nào được báo cáo trong khi cho con bú ở người. Tuy nhiên trong các nghiên cứu trên động vật, everolimus và/hoặc các chất chuyển hóa của thuốc dễ dàng đi vào sữa của chuột cống cho con bú ở nồng độ cao hơn gấp 3,5 lần so với nồng độ trong huyết thanh của chuột mẹ.
Vì vậy phụ nữ dùng Afinitor không nên cho con bú trong khi điều trị và trong 2 tuần sau liều cuối cùng.
Phụ nữ và nam giới có khả năng sinh sản
Biện pháp tránh thai
Cần khuyên những phụ nữ có khả năng sinh sản rằng các nghiên cứu trên động vật đã được thực hiện cho thấy Afinitor có hại lên sự phát triển thai. Những phụ nữ có khả năng sinh sản có hoạt động tình dục nên sử dụng biện pháp tránh thai có hiệu quả cao (một biện pháp dẫn đến tỷ lệ mang thai hàng năm < 1% khi được sử dụng đúng cách) trong khi dùng Afinitor và trong 8 tuần sau khi kết thúc điều trị. Những bệnh nhân nam đang dùng Afinitor không nên bị cấm khi cố gắng có con (xem phần An toàn tiền lâm sàng).
Vô sinh
Phụ nữ và nam giới
Dữ liệu trên động vật
Trong các nghiên cứu về khả năng sinh sản ở động vật, khả năng sinh sản của động vật cái không bị ảnh hưởng. Tuy nhiên, đã quan sát thấy mất phôi trước khi làm tổ. Ở chuột cống đực, hình thái tinh hoàn bị ảnh hưởng với liều từ 0,5 mg/kg trở lên, sự di động của tinh trùng, số lượng tinh trùng và nồng độ testosteron trong huyết tương giảm với liều 5 mg/kg là liều nằm trong phạm vi nồng độ điều trị (theo thứ tự là 52 ng.giờ/mL và 414 ng.giờ/mL so với nồng độ ở người là 560 ng.giờ/mL với liều 10 mg/ngày) và làm giảm khả năng sinh sản ở chuột đực. Có bằng chứng cho thấy khả năng phục hồi.
Dữ liệu trên người
Khả năng sinh sản của cả nam và nữ có thể bị tổn thương do điều trị bằng everolimus (xem phần An toàn tiền lâm sàng).
Kinh nguyệt không đều, vô kinh thứ phát và mất cân bằng hormon hướng hoàng thể (LH)/hormon kích nang noãn (FSH) liên quan đã được quan sát thấy ở những bệnh nhân nữ được điều trị bằng everolimus. Đã quan sát thấy nồng độ FSH và LH trong máu tăng, nồng độ testosteron trong máu giảm và không có tinh trùng ở những bệnh nhân nam được điều trị bằng everolimus.
Tương tác
Everolimus là một cơ chất của CYP3A4 và cũng là một cơ chất và chất ức chế trung bình của P-glycoprotein (PgP) là bơm đẩy thuốc nhiều loại thuốc. Vì vậy, sự hấp thu và thải trừ sau đó của everolimus có thể bị ảnh hưởng bởi các sản phẩm ảnh hưởng đến CY3A4 và/hoặc PgP.
In vitro, everolimus là một chất ức chế cạnh tranh của CYP3A4 và là chất ức chế hỗn hợp của CYP2D6.
Các chất có thể làm tăng nồng độ everolimus trong máu
Nồng độ everolimus trong máu có thể tăng lên do các chất ức chế hoạt tính của CYP3A4 và do đó làm giảm chuyển hóa everolimus.
Nồng độ everolimus trong máu có thể tăng lên do các chất ức chế PgP có thể làm giảm sự đẩy thuốc everolimus ra khỏi tế bào ruột.
Nên tránh điều trị đồng thời với các chất ức chế mạnh CYP3A4 hoặc PgP (bao gồm nhưng không giới hạn ở các thuốc ketoconazole, itraconazole, ritonavir, clarithromycin và telithromycin).
Có sự tăng đáng kể về nồng độ everolimus (nồng độ cao nhất trong huyết tương (Cmax) tăng 3,9 lần và diện tích dưới đường cong (AUC) tăng 15 lần) ở những người khỏe mạnh khi everolimus được dùng kết hợp với ketoconazole (chất ức chế mạnh CYP3A4 và PgP).
Cần thận trọng khi điều trị đồng thời với chất ức chế trung bình CYP3A4 (bao gồm nhưng không giới hạn ở các thuốc erythromycin, verapamil, ciclosporin, fluconazole, diltiazem, amprenavir, fosamprenavir hoặc aprepitant) và chất ức chế PgP. Giảm liều Afinitor nếu dùng kết hợp với chất ức chế trung bình CYP3A4/PgP (xem các phần Liều lượng và Cách dùng và Cảnh báo).
Có sự tăng mức tiếp xúc với everolimus ở những người khỏe mạnh khi everolimus được dùng kết hợp với:
• erythromycin (chất ức chế trung bình CYP3A4 và chất ức chế PgP; Cmax tăng 2 lần và AUC tăng 4,4 lần).
• verapamil (chất ức chế trung bình CYP3A4 và chất ức chế PgP; Cmax tăng 2,3 lần và AUC tăng 3,5 lần).
• ciclosporin (cơ chất của CYP3A4 và chất ức chế PgP; Cmax tăng 1,8 lần và AUC tăng 2,7 lần).
Nên tránh dùng bưởi, nước bưởi, khế, cam Seville và các thức ăn khác đã biết ảnh hưởng đến hoạt tính của cytochrome P450 và PgP trong thời gian điều trị.
Không có sự khác biệt rõ về nồng độ thấp nhất trong huyết tương (Cmin) của everolimus khi được dùng cùng với hoặc không cùng với cơ chất của CYP3A4 và/hoặc PgP sau khi điều trị với liều 10mg hoặc 5mg mỗi ngày.
Sử dụng đồng thời chất ức chế yếu CYP3A4 cùng hoặc không cùng với chất ức chế PgP không có ảnh hưởng rõ đến Cmin của everolimus sau khi dùng chế độ điều trị với liều 10mg hoặc 5mg mỗi ngày.
Các chất có thể làm giảm nồng độ everolimus trong máu
Những chất là chất gây cảm ứng CYP3A4 hoặc PgP có thể làm giảm nồng độ everolimus trong máu do làm tăng sự chuyển hóa hoặc đẩy thuốc everolimus ra khỏi tế bào ruột.
Nên tránh điều trị đồng thời với các chất gây cảm ứng mạnh CYP3A4 hoặc PgP. Nếu phải dùng kết hợp Afinitor với một chất gây cảm ứng mạnh CYP3A4 hoặc PgP (ví dụ: rifampicin và rifabutin), có thể cần phải điều chỉnh liều Afinitor (xem các phần Liều lượng và Cách dùng và Cảnh báo).
Điều trị trước cho những người khỏe mạnh với nhiều liều rifampicin (một chất cảm ứng mạnh CYP3A4 và PgP) 600 mg/ngày trong 8 ngày, tiếp theo là một liều đơn everolimus, độ thanh thải của liều uống everolimus tăng gần 3 lần, Cmax giảm 58% và AUC giảm 63%.
Các chất gây cảm ứng mạnh khác của CYP3A4 và/hoặc PgP có thể làm tăng sự chuyển hóa của everolimus và làm giảm nồng độ everolimus trong máu bao gồm cỏ St. John’s (Hypericum perforatum), thuốc chống co giật (ví dụ: carbamazepine, phenobarbital, phenytoin) và các thuốc kháng HIV (ví dụ: efavirenz, nevirapine).
Các chất mà nồng độ huyết tương có thể bị thay đổi bởi everolimus
Các nghiên cứu ở người khỏe mạnh cho thấy không có tương tác dược động học có ý nghĩa lâm sàng giữa Afinitor và atorvastatin là chất ức chế HMG-CoA reductase (cơ chất của CYP3A4) và pravastatin (không phải cơ chất của CYP3A4) và các phân tích dược động học theo nhóm bệnh nhân cũng phát hiện simvastatin (cơ chất của CYP3A4) không ảnh hưởng đến độ thanh thải của Afinitor.
In vitro, everolimus ức chế cạnh tranh sự chuyển hóa của ciclosporin là cơ chất của CYP3A4 và là một chất ức chế hỗn hợp của dextromethorphan là cơ chất của CYP2D6. Cmax trung bình của everolimus ở trạng thái ổn định với liều uống 10 mg/ngày hoặc 70 mg/tuần thấp hơn 12-36 lần dưới trị số Ki của sự ức chế in vitro. Vì vậy, everolimus được cho là khó có thể ảnh hưởng đến sự chuyển hóa của các cơ chất CYP3A4 và CYP2D6.
Một nghiên cứu trên những người khỏe mạnh cho thấy dùng kết hợp một liều uống midazolam (cơ chất của CYP3A4) với everolimus dẫn đến Cmax của midazolam tăng 25% và AUC(0-inf) của midazolam tăng 30%, trong khi tỷ số chuyển hóa AUC(0-inf) (1-hydroxy-midazolam/midazolam) và t1/2 cuối của midazolam không bị ảnh hưởng. Điều này cho thấy sự tăng nồng độ midazolam là do tác dụng của everolimus ở hệ tiêu hóa khi cả hai thuốc được dùng đồng thời. Vì vậy everolimus có thể ảnh hưởng đến sinh khả dụng của các thuốc là cơ chất của CYP3A4 được dùng kết hợp đường uống. Everolimus khó có thể ảnh hưởng đến nồng độ của các thuốc khác là cơ chất của CYP3A4 được dùng không qua đường uống như đường tĩnh mạch, tiêm dưới da và qua da (xem phần Cảnh báo).
Sử dụng kết hợp everolimus và octreotide depot làm tăng Cmin của octreotide với tỷ số trung bình nhân (everolimus/giả dược) là 1,47 (khoảng tin cậy (CI) 90%: 1,32-1,64) khó có thể ảnh hưởng có ý nghĩa lâm sàng trên đáp ứng hiệu quả với everolimus ở bệnh nhân bị khối u thần kinh nội tiết tiến xa.
- xem Bảng 8.
Sử dụng kết hợp everolimus và exemestane làm tăng Cmin của exemestane là 45% và tăng C2h của exemestane là 71%. Tuy nhiên, nồng độ estradiol tương ứng ở trạng thái ổn định (4 tuần) không khác nhau giữa 2 nhóm điều trị. Không quan sát thấy tăng biến cố bất lợi liên quan với exemestane ở bệnh nhân bị ung thư vú tiến xa có thụ thể hormone dương tính sử dụng điều trị phối hợp này. Nồng độ exemestane tăng khó có thể ảnh hưởng đến hiệu quả hoặc tính an toàn.
Tiêm chủng
Các chất ức chế miễn dịch có thể ảnh hưởng đến đáp ứng với sự tiêm chủng, vì vậy việc tiêm chủng trong thời gian điều trị bằng Afinitor có thể kém hiệu quả hơn. Cần tránh sử dụng vaccine sống trong khi điều trị bằng Afinitor (xem phần Cảnh báo). Các ví dụ về vaccine sống là: Vaccine cúm dùng trong mũi, vaccine sởi, vaccine quai bị, vaccine rubella, vaccine bại liệt dạng uống, vaccine BCG, vaccine sốt vàng, vaccine thủy đậu và vaccine thương hàn TY21a.
Tác dụng ngoại ý
Sử dụng trong Ung thư - Tóm tắt dữ liệu an toàn
Các thông tin phản ứng bất lợi của thuốc (ADR, nghi ngờ có liên quan với điều trị theo các nghiên cứu viên) dựa trên các dữ liệu an toàn tổng hợp ở các bệnh nhân sử dụng Afinitor (N = 2672) trong các thử nghiệm lâm sàng bao gồm pha III ngẫu nhiên, mù đôi, có đối chứng với giả dược hoặc chất so sánh có hoạt tính và nghiên cứu pha II liên quan đến các chỉ định trong ung thư được duyệt.
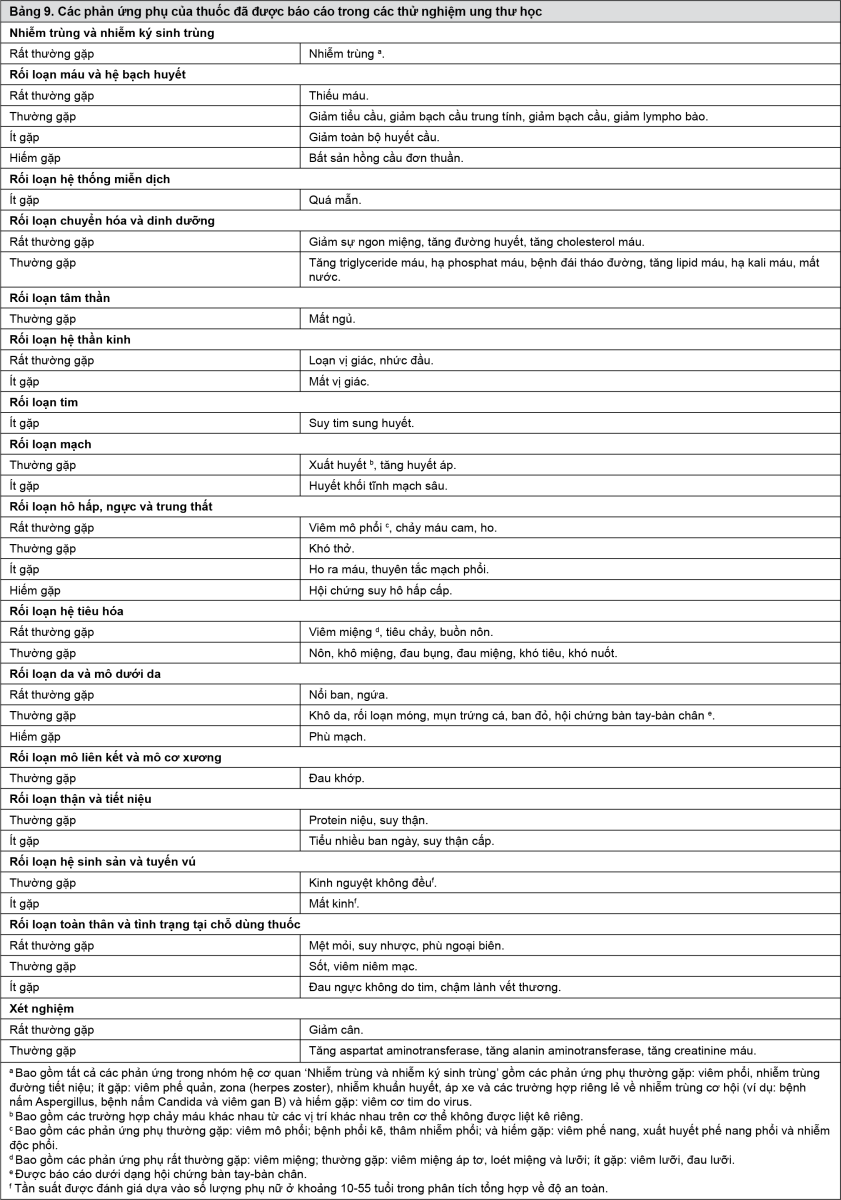
Các phản ứng phụ của thuốc thường gặp nhất (tỷ lệ ≥ 10% và nghi ngờ có liên quan với điều trị theo nghiên cứu viên) từ các dữ liệu gộp về an toàn (theo thứ tự giảm dần) là: viêm miệng, nổi ban, tiêu chảy, nhiễm trùng, buồn nôn, giảm sự ngon miệng, thiếu máu, loạn vị giác, viêm phổi, phù ngoại biên, tăng đường huyết, suy nhược, ngứa, giảm cân, tăng cholesterol máu, chảy máu cam, ho và nhức đầu.
Các phản ứng phụ của thuốc độ 3-4 thường gặp nhất (tỷ lệ ≥ 1/100 đến < 1/10 và nghi ngờ có liên quan với điều trị theo nghiên cứu viên) là viêm miệng, thiếu máu, tăng đường huyết, mệt mỏi, nhiễm trùng, viêm mô phổi, tiêu chảy, suy nhược, giảm tiểu cầu, giảm bạch cầu trung tính, khó thở, giảm lympho bào, protein niệu, xuất huyết, hạ phosphat máu, nổi ban, tăng huyết áp, tăng AST, tăng ALT, viêm phổi thùy và đái tháo đường.
Bảng tóm tắt các phản ứng phụ của thuốc từ các thử nghiệm lâm sàng trong ung thư
Bảng 8 trình bày loại tần suất về các phản ứng phụ của thuốc đã được báo cáo trong phân tích gộp về độ an toàn.
Các phản ứng phụ của thuốc được liệt kê theo phân loại nhóm cơ quan hệ thống của MedDRA. Trong mỗi nhóm cơ quan hệ thống, các phản ứng phụ được sắp xếp theo tần suất, đầu tiên là các phản ứng phụ thường gặp nhất. Trong mỗi nhóm tần suất, các phản ứng bất lợi của thuốc được trình bày theo thứ tự tần suất giảm dần. Ngoài ra, còn có loại tần suất tương ứng đối với mỗi phản ứng phụ, sử dụng quy ước sau đây (CIOMS III): Rất thường gặp (≥ 1/10); thường gặp (≥ 1/100 đến < 1/10); ít gặp (≥ 1/1.000 đến < 1/100); hiếm gặp (≥ 1/10.000 đến < 1/1.000); rất hiếm gặp (< 1/10.000).
- xem Bảng 9.
Các bất thường về xét nghiệm có ý nghĩa lâm sàng
Trong cơ sở dữ liệu gộp về an toàn của nghiên cứu pha III, mù đôi, các bất thường về xét nghiệm có ý nghĩa lâm sàng mới hoặc nặng thêm sau đây đã được báo cáo với tỷ lệ ≥ 1/10 (rất thường gặp, được liệt kê theo tần suất giảm dần):
• Huyết học: Giảm hemoglobin, giảm lympho bào, giảm bạch cầu, giảm tiểu cầu và giảm bạch cầu trung tính (hoặc gọi chung là giảm toàn bộ huyết cầu).
• Sinh hóa lâm sàng: Tăng glucose (lúc đói), tăng cholesterol, tăng triglycerid, tăng AST, giảm phosphat, tăng ALT, tăng creatinine, giảm kali và giảm albumin.
Hầu hết các bất thường được quan sát thấy (> 1/100) ở mức độ nhẹ (độ 1) hoặc trung bình (độ 2). Các bất thường về xét nghiệm huyết học và sinh hóa độ 3-4 bao gồm:
• Huyết học: Giảm lympho bào, giảm hemoglobin (rất thường gặp), giảm bạch cầu trung tính, giảm số lượng tiểu cầu, giảm bạch cầu (tất cả đều thường gặp).
• Sinh hóa lâm sàng: Tăng glucose (lúc đói) (rất thường gặp), giảm phosphat, giảm kali, tăng AST, tăng ALT, tăng creatinine, tăng cholesterol (toàn phần), tăng triglyceride, giảm albumin (tất cả đều thường gặp).
Mô tả các phản ứng phụ của thuốc chọn lọc
• Trong các thử nghiệm lâm sàng và các báo cáo hậu mãi tự phát, everolimus có liên quan đến các trường hợp viêm gan B tái hoạt nghiêm trọng, bao gồm cả kết cuộc tử vong. Sự tái hoạt nhiễm trùng là một phản ứng phụ được dự kiến trong các giai đoạn ức chế miễn dịch (xem phần Cảnh báo).
• Trong các thử nghiệm lâm sàng và các báo cáo hậu mãi tự phát, everolimus có liên quan đến các trường hợp suy thận (bao gồm cả trường hợp tử vong) và protein niệu. Khuyến cáo theo dõi chức năng thận (xem phần Cảnh báo).
• Trong các thử nghiệm lâm sàng và báo cáo hậu mãi tự phát, everolimus có liên quan đến các trường hợp vô kinh (bao gồm cả vô kinh thứ phát).
• Trong các thử nghiệm lâm sàng và các báo cáo hậu mãi tự phát, everolimus có liên quan đến bệnh viêm phổi do Pneumocystis jirovecii (PJP), một vài ca trong số đó bị tử vong (xem phần Cảnh báo).
• Trong các thử nghiệm lâm sàng và các báo cáo hậu mãi tự phát, đã có báo cáo về phù mạch khi dùng đồng thời hoặc không đồng thời everolimus với các thuốc ức chế men chuyển (xem phần Cảnh báo).
Trong một nghiên cứu hậu mãi ở một nhóm phụ nữ sau mãn kinh bị ung thư vú tiến triển có thụ thể hormon dương tính, HER2 âm tính (N = 92), điều trị tại chỗ bằng dung dịch uống không cồn dexamethason 0,5 mg/5 mL (10mL súc miệng trong 2 phút và sau đó nhổ ra, lặp lại 4 lần/ngày trong 8 tuần) được dùng như nước súc miệng cho bệnh nhân tại thời điểm bắt đầu điều trị bằng Afinitor (10 mg/ngày) cộng với exemestane (25 mg/ngày) để làm giảm tỷ lệ và mức độ nặng của viêm miệng. Không dùng thức ăn hoặc thức uống trong ít nhất 1 giờ sau khi súc miệng và nhổ dung dịch uống dexamethason. Tỷ lệ viêm miệng ≥ độ 2 lúc 8 tuần là 2,4% (n = 2/85 bệnh nhân được đánh giá) thấp hơn so với tỷ lệ được báo cáo trước đây là 27,4% (n = 132/482) trong nghiên cứu pha III ở nhóm bệnh nhân này (BOLERO-2). Tỷ lệ viêm miệng Độ 1 là 18,8% (n = 16/85) và không có báo cáo về viêm miệng Độ 3 hoặc Độ 4.
Bảo quản
Không bảo quản trên 30oC. Giữ thuốc trong bao bì gốc. Tránh ánh sáng. Tránh ẩm.
Phân loại ATC
L01XE10 - everolimus
Trình bày/Đóng gói
Viên nén: hộp 3 vỉ x 10 viên.
- Abacavir
- Abernil
- Abiiogran
- Acarbose
- ACC
- Acebutolol
- Acenocoumarol
- Acetate Ringer's
- Acetazolamide
- Acetylcystein
- Acetylsalicylic acid
- Aciclovir
- Acid acetylsalicylic
- Acid aminocaproic
- Acid ascorbic
- Acid boric
- Acid chenodeoxycholic
- Acid ethacrynic
- Acid folic
- Acid fusidic
- Acid iopanoic
- Acid ioxaglic
- Acid nalidixic
- Acid pantothenic
- Acid para-aminobenzoic
- Acid salicylic
- Acid tranexamic
- Acid valproic
- Acid zoledronic
- Acitretin
- Aclasta
- Aclon
- Actapulgite
- Actelsar
- Actelsar HCT
- Actemra
- Actilyse
- Acular
- Acupan
- Acuvail
- Acyclovir STADA
- Acyclovir STADA Cream
- Adalat
- Adenosin
- Adenosin Ebewe
- Adipiodon
- Advagraf
- Aerius
- Afinitor
- Agicarvir
- Agifovir-E
- Agilosart
- Agilosart-H
- Agimepzol
- Agimosarid
- Agimstan
- Agimstan-H
- Agiremid
- Agivastar
- Aibezym
- Air-X
- Alaxan
- Albendazol
- Albiomin
- Albumin
- Albumin người Grifols 20%
- Albuminar
- AlbuRx
- Albutein
- Alcuronium chloride
- Aldesleukin
- Alendronat
- Alertin
- Alfa-Lipogamma 600 Oral
- Alfuzosin hydrochlorid
- Algotra
- Alimemazin
- Alimta
- Allipem
- Allopurinol
- Allopurinol STADA
- Aloxi
- Alprazolam
- Alpha Chymotrypsin
- Alpha tocopherol
- Alphachymotrypsin Glomed
- Alphagan-P
- Aluvia
- Alzental
- Amaryl
- Ambroco
- Ambroxol
- Amcinol-Paste
- Amigold
- Amikacin
- Aminocaproic acid
- Aminoleban
- Aminoleban Oral
- Aminosteril N-Hepa
- Amiparen
- Amitriptyline
- Amiyu
- Amlodipine
- Amlor
- Amoxicillin
- Amoxicillin & clavulanate
- Ampicillin
- Amquitaz
- Anaferon for children
- Anargil
- Anaropin
- Andriol Testocaps
- Anepzil
- Anyfen
- Apaisac
- Apidra SoloStar
- Apitim 5
- Aprovel
- Aquaphil
- Arcalion
- Arcoxia
- Aricept Evess
- Arimidex
- Arnetine
- Artrodar
- A-Scabs
- Ascorbic acid
- Asperlican/Candinazol
- Aspilets EC
- Aspirin
- Asthmatin
- Atelec
- Atocib 120
- Atocib 90
- Atosiban PharmIdea
- Atozet
- Attapulgite
- Atussin
- Atropin
- Augbactam
- Augmentin Sachet
- Augmentin SR
- Augmentin Tablets
- Augmex
- Avamys
- Avastin
- Avelox Dịch truyền
- Avelox Viên nén
- Avodart
- Axcel Cefaclor-125 Suspension
- Axcel Cetirizine Syrup
- Axcel Chlorpheniramine
- Axcel Dexchlorpheniramine
- Axcel Dicyclomine-S Syrup
- Axcel Diphenhydramine Paediatric Syrup
- Axcel Erythromycin ES
- Axcel Eviline
- Axcel Fungicort Cream
- Axcel Fusidic acid Cream
- Axcel Fusidic acid-B Cream
- Axcel Hydrocortisone Cream
- Axcel Lignocaine 2% Sterile Gel
- Axcel Loratadine
- Axcel Miconazole Cream
- Axcel Paracetamol
- Axcel Urea Cream
- Axitan
- Azenmarol
- Azicine
- Aziphar
- Azithromycin