Nhà sản xuất
Roche
Thành phần
Mỗi mL dung dịch cô đặc: Tocilizumab* 20mg.
Mỗi bơm tiêm: Tocilizumab* 162mg.
(*là kháng thể đơn dòng kháng thụ thể interleukin-6 (IL-6) ở người được nhân hóa tái tổ hợp là thành phần của phân nhóm globulin miễn dịch (Ig) IgG1.
Mô tả
Mã ATC: L04AC07.
Dung dịch cô đặc: Là chất lỏng trong đến trắng đục, không màu đến vàng nhạt, đóng trong lọ liều đơn, không chất bảo quản, không chất gây sốt.
Dung dịch tiêm: Dung dịch màu vàng nhạt, không chứa chất bảo quản được đóng gói dưới dạng bơm tiêm đóng sẵn sử dụng một lần có kèm kim tiêm an toàn.
Dược lý
Đặc điểm dược lực học
Trong các thử nghiệm lâm sàng với tocilizumab, đã ghi nhận có sự giảm nhanh chóng C-reactive protein (CRP), tốc độ máu lắng (ESR) và amyloid A huyết thanh (SAA). Ghi nhận có tăng nồng độ haemoglobin, qua việc tocilizumab làm giảm tác động chi phối bởi IL-6 lên sự sản xuất hepcidin để làm tăng tạo sắt.
Ở người khỏe mạnh dùng tocilizumab liều 2-28 mg/kg, số lượng tuyệt đối bạch cầu trung tính giảm xuống mức thấp nhất từ 3 đến 5 ngày sau khi truyền. Sau đó, bạch cầu trung tính phục hồi về mức ban đầu theo cách phụ thuộc vào liều. Các bệnh nhân viêm khớp dạng thấp biểu hiện một kiểu thay đổi số lượng tuyệt đối bạch cầu trung tính sau khi truyền tocilizumab tương tự nhau (xem phần "Các xét nghiệm").
Cơ chế hoạt động
Tocilizumab là kháng thể đơn dòng nhân hóa tái tổ hợp kháng thụ thể interleukin-6 (IL-6) ở người là thành phần của phân nhóm globulin miễn dịch (Ig) IgG1. Tocilizumab gắn chuyên biệt với cả phần thụ thể gắn kết hòa tan và thụ thể gắn kết màng của IL-6 (sIL-6R, mIL-6R), và đã cho thấy ức chế được tín hiệu điều hòa bởi sIL-6R và mIL-6R. IL-6 là cytokine đa chức năng, được sản xuất bởi nhiều loại tế bào liên quan đến chức năng cận tiết tại chỗ cũng như sự điều hòa của các tiến trình bệnh học và sinh lý học của cơ thể như sự kích thích tiết ra globulin miễn dịch, hoạt hóa tế bào T, kích thích các protein giai đoạn cấp của gan và kích thích tiến trình tạo máu. IL-6 có liên quan đến bệnh sinh của các bệnh bao gồm bệnh lý viêm, loãng xương và ung thư.
Sự tồn tại của tocilizumab giúp bảo vệ vật chủ chống lại nhiễm trùng và bệnh lý ác tính. Vai trò của thụ thể IL-6 trong việc ức chế sự phát triển của khối u ác tính hiện chưa được biết.
Các nghiên cứu đánh giá hiệu quả lâm sàng
Dịch truyền tĩnh mạch
Viêm khớp dạng thấp
Hiệu quả của Actemra làm giảm bớt các triệu chứng và dấu hiệu của viêm khớp dạng thấp được đánh giá qua 5 thử nghiệm ngẫu nhiên, mù đôi, đa trung tâm. Nghiên cứu I-IV đòi hỏi bệnh nhân phải ≥18 tuổi được chẩn đoán là viêm đa khớp dạng thấp tiến triển dựa vào tiêu chí của Hội Khớp Học Hoa Kỳ (ACR) có ít nhất 8 khớp đau và 6 khớp sưng so với lúc vào nghiên cứu.
Actemra dùng đơn trị truyền tĩnh mạch mỗi 4 tuần (Nghiên cứu I), kết hợp với MTX (Nghiên cứu II, III, V) hoặc với các thuốc chống thấp khớp làm cải thiện bệnh (DMARD) khác (Nghiên cứu IV).
Nghiên cứu I đánh giá 673 bệnh nhân chưa được điều trị với MTX trong 6 tháng trước khi được chọn ngẫu nhiên, và những bệnh nhân trước đó chưa ngừng điều trị với MTX vì những độc tính quan trọng về mặt lâm sàng hoặc đáp ứng kém. Phần lớn bệnh nhân (67%) chưa điều trị với MTX. Actemra được dùng đơn trị với liều 8 mg/kg mỗi 4 tuần. Nhóm so sánh là MTX mỗi tuần (liều được chỉnh từ 7,5 đến liều tối đa hàng tuần là 20 mg trong chu kỳ 8 tuần). Kết cục chính là tỉ lệ bệnh nhân đạt đáp ứng theo tiêu chí ACR20 ở tuần thứ 24.
Nghiên cứu II, một nghiên cứu 2 năm đánh giá 1196 bệnh nhân đáp ứng lâm sàng kém với MTX. Điều trị mù đôi với Tocilizumab với liều 4 mg/kg hoặc 8 mg/kg hoặc giả dược được dùng mỗi 4 tuần trong 52 tuần, kết hợp với MTX ở liều ổn định (10 mg-25 mg hàng tuần). Kết cục chính là tỉ lệ bệnh nhân đạt đáp ứng theo tiêu chí ACR20 ở tuần thứ 24. Ở tuần 52 các kêt cục chính là phòng ngừa tổn thương và cải thiện chức năng vật lý của khớp.
Nghiên cứu III đánh giá 623 bệnh nhân đáp ứng lâm sàng kém với MTX. Dùng Tocilizumab với liều 4 mg/kg hoặc 8 mg/kg hoặc giả dược mỗi 4 tuần trong 52 tuần, trong kết hợp với MTX ở liều ổn định (10 mg-25 mg hàng tuần).
Nghiên cứu IV đánh giá 1220 bệnh nhân đáp ứng kém với điều trị chống thấp hiện tại của họ, bao gồm một hoặc nhiều DMARD. Tocilizumab với liều 8 mg/kg được dùng mỗi 4 tuần trong 52 tuần, kết hợp với DMARD ở liều ổn định.
Nghiên cứu V đánh giá 499 bệnh nhân đáp ứng lâm sàng kém hoặc không dung nạp với 1 hoặc nhiều liệu pháp chống TNF (Yếu tố hoại tử u). Thuốc kháng TNF phải được ngừng trước khi chia nhóm ngẫu nhiên. Tocilizumab với liều 4 mg/kg hoặc 8 mg/kg hoặc giả dược được dùng mỗi 4 tuần trong 52 tuần, trong kết hợp với MTX ở liều ổn định (10 mg-25 mg hàng tuần). Kết cục chính của nghiên cứu III, IV là tỉ lệ bệnh nhân đạt đáp ứng theo tiêu chí ACR 20 ở tuần thứ 24.
Tỉ lệ bệnh nhân đạt đáp ứng theo tiêu chí ACR 20, 50 và 70 trong nghiên cứu I tới V được trình bày trong Bảng 1.
- xem Bảng 1.
Trong tất cả các nghiên cứu, bệnh nhân điều trị với Tocilizumab 8mg/kg có tỉ lệ đáp ứng các tiêu chí ACR 20, 50, 70 cao hơn có ý nghĩa về mặt thống kê ở thời điểm 6 tháng so với nhóm chứng. Hiệu quả điều trị tương tự ở các nhóm bệnh nhân không phụ thuộc vào yếu tố tuổi, giới, chủng tộc, số lần điều trị trước đó hoặc tình trạng bệnh. Thời gian bắt đầu có đáp ứng (sớm nhất ở tuần thứ 2) và mức độ đáp ứng tiếp tục cải thiện trong quá trình điều trị. Các đáp ứng kéo dài tiếp tục được quan sát trong hơn 3 năm trong các nghiên cứu I-V nhãn mở mở rộng đang tiến hành.
Ở các bệnh nhân điều trị với Tocilizumab 8mg/kg có sự cải thiện quan trọng được ghi nhận trên tất cả các thông số thành phần của đáp ứng tiêu chí ACR (số khớp sưng đau, đánh giá toàn bộ của bác sĩ điều trị và bệnh nhân, điểm chỉ số tàn tật (HAQ), đánh giá đau và CRP so với bệnh nhân dùng giả dược + MTX/DMARDs trong tất cả nghiên cứu.
Những bệnh nhân điều trị với Tocilizumab 8mg/kg có điểm diễn tiến bệnh (DAS 28) giảm nhiều hơn có ý nghĩa thống kê so với những bệnh nhân điều trị với giả dược + DMARD. Tỷ lệ bệnh nhân có đáp ứng EULAR (điểm đánh giá của Hội Điều trị bệnh Thấp khớp Châu Âu) tốt đến trung bình nhiều hơn có ý nghĩa ở bệnh nhân điều trị với Tocilizumab so với những bệnh nhân điều trị giả dược + DMARD (Bảng 2).
- xem Bảng 2.
Đáp ứng lâm sàng chính
Sau 2 năm điều trị bằng tocilizumab/MTX, 14% bệnh nhân đạt được đáp ứng lâm sàng chính (duy trì được đáp ứng theo tiêu chí ACR 70 trong vòng 24 tuần hoặc hơn).
Đáp ứng trên hình ảnh phóng xạ
Trong nghiên cứu II, ở những bệnh nhân đáp ứng kém với MTX, sự ức chế tổn thương cấu trúc khớp được đánh giá trên X quang và thể hiện qua thay đổi điểm số thang Sharp sửa đổi và các thành phần của thang này, điểm số của sự xói mòn và điểm số thu hẹp khoảng gian khớp. Sự ức chế tổn thương cấu trúc khớp đã được thể hiện với sự tiến triển trên hình ảnh phóng xạ ít hơn đáng kể ở các bệnh nhân điều trị tocilizumab so với nhóm đối chứng (Bảng 3).
Trong phần mở rộng, nhãn mở của nghiên cứu II, sự ức chế tiến triển tổn thương cấu trúc khớp ở nhóm điều trị tocilizumab/MTX được duy trì trong năm điều trị thứ hai.
- xem Bảng 3.

Sau 1 năm điều trị với tocilizumab/MTX, 83% bệnh nhân không có sự tiến triển của tổn thương cấu trúc khớp, được định nghĩa là sự thay đổi điểm số TSS bằng không hoặc ít hơn, so với 67% bệnh nhân dùng giả dược/MTX. Điều này vẫn duy trì sau 2 năm điều trị (83%). Chín mươi ba phần trăm (93%) bệnh nhân không có tiến triển giữa tuần 52 và tuần 104.
Kết cục về chất lượng cuộc sống
Những cải thiện có ý nghĩa về mặt lâm sàng trong chỉ số tàn tật (HAQ-DI, Chỉ số tàn tật qua bảng câu hỏi đánh giá sức khoẻ), mệt mỏi (FACIT-Fatigue, Đánh giá chức năng về tình trạng mệt mỏi - Liệu pháp điều trị liên quan bệnh lý mạn tính), và cải thiện cả về lĩnh vực sức khoẻ thể chất (PCS, Tóm tắt thành phần thể chất) và sức khoẻ tâm thần (MCS, Tóm tắt thành phần tâm thần) của SF-36 (điều tra sức khoẻ theo Mẫu Ngắn 36) được ghi nhận ở bệnh nhân điều trị Tocilizumab 8 mg/kg (đơn trị hoặc kết hợp với DMARDs) so với bệnh nhân điều trị MTX/DMARDs (Bảng 4).
Vào tuần thứ 24, tỉ lệ bệnh nhân điều trị với Tocilizumab 8 mg/kg biểu hiện cải thiện có ý nghĩa lâm sàng HAQ-DI (được định nghĩa là tổng số điểm giảm >0,25) cao hơn có ý nghĩa so với các bệnh nhân dùng giả dược + MTX/DMARDs trong tất cả các nghiên cứu. Trong giai đoạn nhãn mở của nghiên cứu II, sự cải thiện chức năng vật lý của khớp đã được duy trì cho đến 2 năm.
- xem Bảng 4.
Trong nghiên cứu II, những thay đổi PCS, MCS và FACIT-Fatigue ở tuần thứ 52 là 10,1***, 5,4 và 8,4**, tương ứng, trong nhóm TCZ 8 mg/kg + MTX so với 5,6, 3,8 và 5,5, tương ứng, trong nhóm giả dược cộng với MTX. Ở tuần 52, sự thay đổi trung bình HAQ-DI là -0,58 trong nhóm TCZ 8 mg/kg + MTX so với -0,39 trong nhóm dùng giả dược + MTX. Thay đổi trung bình HAQ-DI được duy trì ở tuần 104 trong nhóm TCZ 8 mg/kg + MTX (-0,61).
Đánh giá xét nghiệm
Điều trị bằng tocilizumab 8 mg/kg kết hợp với DMARD/MTX hoặc đơn trị đem lại cải thiện rất có ý nghĩa về mặt thống kê về nồng độ hemoglobin so với giả dược + DMARD/MTX (p<0,0001) ở tuần thứ 24. Sự cải thiện lớn nhất được ghi nhận ở bệnh nhân thiếu máu mạn tính do viêm khớp dạng thấp; nồng độ trung bình của hemoglobin tăng từ tuần thứ 2 và duy trì ở mức bình thường trong suốt tuần 24.
Sự giảm đáng kể nồng độ trung bình của những chất phản ứng giai đoạn cấp, CRP, ESR, và amyloid A huyết thanh (SAA) xuất hiện một cách nhanh chóng sau khi truyền tocilizumab. Và điều này phù hợp với tác động của thuốc lên các chất phản ứng giai đoạn cấp, điều trị với Tocilizumab có liên quan đến giảm số lượng tiểu cầu trong giới hạn bình thường.
Viêm khớp dạng thấp giai đoạn sớm, chưa điều trị với MTX
Nghiên cứu VI, một nghiên cứu 2 năm với phân tích chủ yếu ở tuần 52 đánh giá 1162 bệnh nhân trưởng thành bị viêm khớp dạng thấp giai đoạn sớm, thể hoạt động, mức độ từ trung bình đến nặng (khoảng thời gian bị bệnh dưới 6 tháng) mà chưa dùng MTX. Nghiên cứu này đánh giá hiệu quả của tocilizumab truyền tĩnh mạch liều 4 hoặc 8 mg/kg mỗi 4 tuần kết hợp với MTX, tocilizumab đơn trị truyền tĩnh mạch liều 8 mg/kg và MTX đơn trị trong việc làm giảm các dấu hiệu và triệu chứng, tỷ lệ tiến triển của tổn thương khớp trong 104 tuần. Kết cục chính là đánh giá tỷ lệ bệnh nhân đạt được sự giảm DAS28 (DAS28 < 2,6) ở tuần 24. Kết quả đạt được ở nhóm tocilizumab 8 mg/kg + MTX và nhóm tocilizumab đơn trị, có tỷ lệ cao hơn đáng kể so với nhóm MTX đơn trị. Kết quả đánh giá những kết cục phụ quan trọng ở nhóm tocilizumab 8 mg/kg + MTX có ý nghĩa thống kê. Nhóm tocilizumab 8 mg/kg đơn trị, có số lượng đáp ứng cao hơn so với nhóm MTX đơn trị ở tất cả các kết cục phụ bao gồm cả hình ảnh X-quang. Trong nghiên cứu này, sự giảm ACR/EULAR (Boolean và Index) được phân tích như là mục tiêu thăm dò được chỉ định trước, và tỷ lệ đáp ứng ở nhóm dùng tocilizumab đạt cao hơn. Kết quả nghiên cứu VI được trình bày trong Bảng 5.
- xem Bảng 5.
Đơn trị: tocilizumab so với adalimumab
Nghiên cứu WA19924 đánh giá 326 bệnh nhân viêm khớp không dung nạp với MTX hoặc tiếp tục điều trị với MTX nhưng không thích hợp (bao gồm cả những bệnh nhân đáp ứng không hoàn toàn với MTX). Nhóm bệnh nhân dùng tocilizumab truyền tĩnh mạch 8 mg/kg mỗi 4 tuần và tiêm dưới da giả dược mỗi 2 tuần. Nhóm bệnh nhân dùng adalimumab tiêm dưới da 40 mg mỗi 2 tuần và truyền tĩnh mạch giả dược mỗi 4 tuần.
Hiệu quả điều trị có ý nghĩa thống kê đã được ghi nhận ở nhóm tocilizumab cao hơn nhóm adalimumab trong việc kiểm soát bệnh từ lúc ban đầu đến tuần 24 ở kết cục chính của sự thay đổi DAS28 và tất cả các kết cục phụ quan trọng (Bảng 6).
- xem Bảng 6.

Viêm khớp thiếu niên tự phát thể đa khớp
Hiệu quả của tocilizumab đã được đánh giá trong một nghiên cứu ba giai đoạn bao gồm một nghiên cứu mở rộng nhãn mở ở trẻ em mắc pJIA tiến triển. Giai đoạn I được điều trị tấn công tocilizumab 16 tuần (N=188) sau đó tiếp tục bằng giai đoạn II, mù đôi ngẫu nhiên 24 tuần dùng giả dược có kiểm soát giai đoạn từ bỏ (ITT, N=163), rồi tiếp tục bằng giai đoạn III, giai đoạn mở nhãn 64 tuần. Những bệnh nhân ≥30kg được tuyển chọn được dùng tocilizumab 4 liều 8 mg/kg. Những bệnh nhân <30kg được dùng ngẫu nhiên 1:1 tocilizumab 8 mg/kg hoặc 10 mg/kg truyền tĩnh mạch mỗi 4 tuần cho 4 liều. Những bệnh nhân đã hoàn thành giai đoạn I của nghiên cứu và đạt được ít nhất một đáp ứng tiêu chí ACR 30 của JIA ở tuần thứ 16 so với lúc mới vào nghiên cứu được bước vào giai đoạn mù từ bỏ (giai đoạn II) của nghiên cứu. Ở giai đoạn II, bệnh nhân được ngẫu nhiên dùng tocilizumab (liều tương tự như đã dùng trong giai đoạn I) hoặc giả dược với tỷ lệ 1:1 đã được phân nhóm là dùng đồng thời với methotrexate và dùng đồng thời với corticosteroid. Mỗi bệnh nhân tiếp tục trong giai đoạn II của nghiên cứu cho đến tuần thứ 40 hoặc đến khi bệnh nhân đạt được tiêu chí ACR 30 JIA (tương đối đến tuần thứ 16) và đủ tiêu chuẩn để kết thúc.
Kết cuộc chính là tỷ lệ bệnh nhân đạt được tiêu chí ACR 30 JIA ở tuần thứ 40 tỷ lệ đối với tuần thứ 16. Bốn mươi tám phần trăm (48,1%, 39/81) bệnh nhân điều trị bằng giả dược so với 25,6% (21/82) bệnh nhân điều trị TCZ. Những tỷ lệ này khác biệt có ý nghĩa thống kê (p=0,0024).
Ở thời điểm kết thúc giai đoạn I, đáp ứng các tiêu chí JIA ACR 30/50/70/90 lần lượt là 89,4%, 83,0%, 62,2%, và 26,1%.
Trong giai đoạn từ bỏ (giai đoạn II), tỷ lệ phần trăm bệnh nhân đạt được đáp ứng các tiêu chí JIA ACR 30, 50, và 70 ở tuần thứ 40 tỷ lệ với lúc bước vào nghiên cứu được trình bày trong Bảng 7.
- xem Bảng 7.

Viêm khớp thiếu niên tự phát thể hệ thống
Hiệu quả của truyền tĩnh mạch tocilizumab trong điều trị sJIA tiến triển được đánh giá qua một nghiên cứu 2 nhánh, nhóm song song, ngẫu nhiên, mù đôi, giả dược có kiếm soát, kéo dài 12 tuần. Bệnh nhân (điều trị với hoặc không điều trị với MTX) được xếp ngẫu nhiên vào một trong hai nhóm (TCZ:giả dược = 2:1), 75 bệnh nhân được truyền Tocilizumab mỗi 2 tuần với liều 8 mg/kg với bệnh nhân ≥30kg hoặc 12 mg/kg với bệnh nhân <30kg và 37 bệnh nhân được chỉ định truyền giả dược mỗi 2 tuần. Việc giảm dần corticosteroid có thể thực hiện từ tuần thứ sáu ở những bệnh nhân đạt được một đáp ứng JIA theo tiêu chí ACR70. Sau 12 tuần hoặc tại thời điểm kết thúc, do bệnh ngày càng xấu đi, bệnh nhân được điều trị trong giai đoạn nhãn mở mở rộng với liều lượng phù hợp với cân nặng. Kết cục chính là tỷ lệ bệnh nhân có cải thiện ít nhất 30% theo tiêu chí điểm số JIA ACR (đáp ứng JIA theo tiêu chí ACR 30) lúc 12 tuần và không có sốt (không ghi nhận thấy nhiệt độ ≥37,5°C trong 7 ngày liên tiếp). 85% (64/75) bệnh nhân được điều trị với TCZ và 24,3% (9/37) bệnh nhân dùng giả dược đã đạt được kết cục này. Các tỷ lệ này có sự khác biệt đáng kể (p<0,0001).
Tỉ lệ bệnh nhân đạt đáp ứng JIA theo tiêu chí ACR 30, 50, 70 và 90 được trình bày trong Bảng 8. Các đáp ứng được duy trì trong giai đoạn mở nhãn mở rộng.
- xem Bảng 8.

Các đặc tính toàn thân
Trong những bệnh nhân được điều trị với tocilizumab, 85% người bị sốt do sJIA lúc ban đầu hoàn toàn không sốt (không ghi nhận thấy nhiệt độ ≥37,5°C trong 14 ngày trước đó) ở tuần 12 so với chỉ có 21% bệnh nhân dùng giả dược (p<0,0001) và 64% bệnh nhân điều trị tocilizumab lúc ban đầu có biểu hiện phát ban do sJIA hoàn toàn không còn phát ban ở tuần 12 so với 11% bệnh nhân dùng giả dược (p=0,0008).
Có sự giảm đau đớn ở tuần 12 có ý nghĩa thống kê cao ở các bệnh nhân điều trị tocilizumab so với bệnh nhân dùng giả dược. Mức điều chỉnh trung bình ở chỉ số đau VAS sau 12 tuần điều trị tocilizumab là giảm 41 điểm trên thang điểm từ 0-100 so với giảm 1 ở bệnh nhân dùng giả dược (p<0,0001).
Các đáp ứng với tính năng hệ thống được duy trì trong giai đoạn mở rộng mở nhãn tiếp diễn.
Sự giảm dần corticosteroid
Trong số 31 bệnh nhân dùng giả dược và 70 bệnh nhân dùng tocilizumab dùng corticosteroid đường uống lúc ban đầu, 8 bệnh nhân dùng giả dược và 48 bệnh nhân dùng tocilizumab đạt được một đáp ứng JIA ACR 70 tại thời điểm 6 hoặc 8 tuần cho phép giảm liều corticosteroid. 17 (24%) bệnh nhân dùng tocilizumab so với 1 (3%) bệnh nhân dùng giả dược đã có thể giảm liều corticosteroid ít nhất là 20% mà không cần trải qua một đáp ứng JIA ACR 30 bùng phát tiếp theo hoặc xuất hiện các triệu chứng toàn thân đến tuần 12 (p=0,028). Tiếp tục giảm corticosteroid, với 44 bệnh nhân không còn uống corticosteroid, vào tuần thứ 44, trong khi vẫn duy trì các đáp ứng ACR.
Chất lượng cuộc sống
Ở tuần thứ 12, tỷ lệ các bệnh nhân điều trị tocilizumab cho thấy một sự cải thiện lâm sàng quan trọng tối thiểu CHAQ-DI (định nghĩa là sự giảm tổng số điểm của cá nhân ≥0,13) cao hơn đáng kể hơn so với các bệnh nhân nhận giả dược, 77% so với 19% (p<0,0001). Các đáp ứng được duy trì trong giai đoạn mở rộng mở nhãn đang tiến hành.
Các thông số xét nghiệm
50 trong số 75 (67%) bệnh nhân được điều trị với tocilizumab có hemoglobin < LLN lúc ban đầu. 40 (80%) trong số những bệnh nhân có giảm hemoglobin này đã tăng hemoglobin trong phạm vi bình thường ở tuần 12, so với chỉ có 2 trong 29 (7%) bệnh nhân dùng giả dược có hemoglobin < LLN lúc ban đầu (p<0,0001). Bốn mươi bốn (88%) bệnh nhân dùng tocilizumab có giảm hemoglobin lúc ban đầu có tăng hemoglobin ≥10g/L ở tuần 6 so với 1 (3%) bệnh nhân dùng giả dược (p<0,0001).
Tỷ lệ các bệnh nhân dùng tocilizumab có tăng tiểu cầu lúc ban đầu có số lượng tiểu cầu bình thường ở tuần 12 cao hơn đáng kể hơn so với các bệnh nhân dùng giả dược, 90% so với 4%, (p<0,0001).
Có sự giảm đáng kể về trung bình mức độ của phản ứng giai đoạn cấp tính, CRP, ESR, và amyloid A huyết thanh một cách nhanh chóng sau khi dùng tocilizumab.
Dung dịch tiêm dưới da
Hiệu quả của tocilizumab tiêm dưới da được đánh giá qua một nghiên cứu đa trung tâm, mù đôi, có đối chứng trên các bệnh nhân bị viêm khớp dạng thấp thể hoạt động. Nghiên cứu SC-I chọn những bệnh nhân ≥18 tuổi được chẩn đoán là viêm khớp dạng thấp thể hoạt động dựa vào tiêu chí của Hội Thấp Khớp Học Hoa Kỳ (ACR) và có ít nhất 4 khớp đau và 4 khớp sưng ở thời điểm tham gia vào nghiên cứu. Tất cả bệnh nhân đều không có tiền căn sử dụng các DMARD không có nguồn gốc sinh học trước đó.
Đối với nghiên cứu SC II, bệnh nhân tham gia nghiên cứu yêu cầu từ 18 tuổi trở lên với bệnh lý viêm khớp dạng thấp thể hoạt động, mức độ trung bình đến nặng được chẩn đoán theo tiêu chí của hội Thấp khớp học Hoa Kỳ (ACR) có ít nhất 8 khớp đau và 6 khớp sưng tại thời điểm tham gia nghiên cứu.
Chuyển đổi bệnh nhân dùng 8 mg/kg truyền tĩnh mạch mỗi 4 tuần sang 162 mg tiêm dưới da mỗi tuần sẽ làm thay đổi sự phơi nhiễm ở bệnh nhân. Mức độ thay đổi phụ thuộc vào trọng lượng cơ thể bệnh nhân( tăng đối với bệnh nhân có trọng lượng thấp và giảm đối với bệnh nhân có trọng lượng cơ thể cao) nhưng hiệu quả lâm sàng phù hợp với các kết quả ghi nhận được ở bệnh nhân dùng đường tĩnh mạch.
Đáp ứng lâm sàng
Nghiên cứu SC-I đánh giá các bệnh nhân viêm khớp dạng thấp thể hoạt động mức độ trung bình đến nặng và đáp ứng lâm sàng không hoàn toàn với các phác đồ điều trị bệnh khớp hiện tại, bao gồm một hoặc nhiều các DMARD. Khoảng 20% số bệnh nhân có đáp ứng lâm sàng không hoàn toàn với ít nhất một chất ức chế TNF. Trong nghiên cứu SC-I, 1262 bệnh nhân được chia đều ngẫu nhiên thành 2 nhóm bằng nhau được điều trị tocilizumab tiêm dưới da 162 mg/tuần và tocilizumab truyền tĩnh mạch 8 mg/kg mỗi 4 tuần phối hợp với các DMARD không có nguồn gốc sinh học. Tiêu chí chính trong nghiên cứu là sự khác biệt ở tỉ lệ bệnh nhân đạt đáp ứng theo tiêu chí ACR20 ở tuần thứ 24. Kết quả nghiên cứu SC-I được trình bày ở Bảng 9.
- xem Bảng 9.
Đáp ứng lâm sàng chính
Sau 2 năm điều trị bằng tocilizumab/MTX, 14% bệnh nhân đạt được đáp ứng lâm sàng chính (duy trì được đáp ứng theo tiêu chí ACR70 trong vòng 24 tuần hoặc hơn).
Đáp ứng trên hình ảnh X-quang
Đáp ứng trên hình ảnh X-quang của tocilizumab tiêm dưới da được đánh giá trong nghiên cứu đa trung tâm, có đối chứng, mù đôi trên bệnh nhân viêm khớp dạng thấp thể hoạt động. Thử nghiệm này (SC-II) thực hiện trên các bệnh nhân viêm khớp dạng thấp thể hoạt động mức độ trung bình đến nặng và có đáp ứng lâm sàng không hoàn toàn với phác đồ điều trị viêm khớp hiện tại, bao gồm một hoặc nhiều các DMARD mà có khoảng 20% số bệnh nhân có tiền sử đáp ứng không hoàn toàn với ít nhất một chất ức chế TNF. Nghiên cứu SC-II chọn bệnh nhân ≥18 tuổi được chẩn đoán là viêm khớp dạng thấp thể hoạt động dựa vào tiêu chí của Hội Khớp Học Hoa Kỳ (ACR) và có ít nhất 8 khớp đau và 6 khớp sưng ở thời điểm tham gia vào nghiên cứu. Trong nghiên cứu SC-II, 656 bệnh nhân được chia ngẫu nhiên thành 2 nhóm với tỷ lệ bệnh nhân là 2:1, nhóm dùng tocilizumab tiêm dưới da 162 mg/tuần và nhóm giả dược, kết hợp với các DMARD không có nguồn gốc sinh học.
Trong nghiên cứu SC-II, sự ức chế cấu trúc khớp bị tổn thương được đánh giá bằng hình ảnh X-quang và được thể hiện như một thay đổi so với thời điểm ban đầu trong van der Heijde hiệu chỉnh tổng điểm trung bình Sharp (mTSS). Ở thời điểm tuần thứ 24, biểu hiện sự ức chế tổn thương cấu trúc khớp với giảm đáng kể tiến triển trên X-quang ở những bệnh nhân dùng tocilizumab tiêm dưới da so sánh với giả dược (mTSS là 6,2 so với 1,23, p=0,0149 (van Elteren). Kết quả này phù hợp với kết quả quan sát được trên các bệnh nhân dùng tocilizumab truyền tĩnh mạch.
Trong nghiên cứu SC-II, vào tuần thứ 24 tỷ lệ bệnh nhân dùng tocilizumab tiêm dưới da hai tuần một lần đạt được đáp ứng theo tiêu chí ACR20 là 60,9%, ACR50 là 39,8% và ACR70 là 19,7% so với tỷ lệ bệnh nhân dùng giả dược đạt được đáp ứng theo tiêu chí ACR20 là 31,5%, ACR50 là 12,3% và ACR70 là 5%. Các bệnh nhân có điểm đánh giá hoạt động bệnh DAS28 trung bình ở thời điểm ban đầu là 6,7 đối với nhánh tocilizumab tiêm dưới da và 6,6 đối với nhánh giả dược. Ở tuần 24, DAS28 giảm đáng kể 3,1 điểm so với thời điểm ban đầu ở nhánh tiêm dưới da và giảm 1,7 điểm ở nhánh giả dược, và đối với DAS28 <2,6 , đạt được 32,0% ở nhánh tiêm dưới da và 4,0% ở nhánh giả dược.
Kết quả về chất lượng sống
Trong nghiên cứu SC-I, mức giảm trung bình chỉ số HAQ-DI ở tuần thứ 24 so với lúc ban đầu là 0,6 ở cả 2 nhóm tocilizumab tiêm dưới da 162 mg/tuần và tocilizumab truyền tĩnh mạch 8 mg/kg mỗi 4 tuần. Tỷ lệ bệnh nhân có sự cải thiện lâm sàng liên quan đến chỉ số HAQ-DI ở tuần thứ 24 (thay đổi so với lúc ban đầu ≥0,3 đơn vị) được so sánh giữa nhóm tocilizumab tiêm dưới da mỗi tuần (65,2%) với nhóm tocilizumab truyền tĩnh mạch 8 mg/kg (67,4%), với trọng số khác nhau là -2,3% (95% độ tin cậy -8,1 - 3,4). Trong tóm tắt điều tra sức khỏe theo mẫu ngắn 36 (SF-36) được chia thành 2 phần chính là sức khỏe thể chất và sức khỏe tâm thần. Về sức khỏe thể chất, điểm đánh giá của hai nhóm là tương đương nhau, với thay đổi trung bình so với ban đầu ở tuần 24 là 6,22 ở nhóm tocilizumab tiêm dưới da và 6,54 ở nhóm tocilizumab truyền tĩnh mạch. Về sức khỏe tâm thần, điểm đánh giá của hai nhóm cũng tương đương nhau, với thay đổi trung bình so với ban đầu ở tuần 24 là 9,49 ở nhóm tocilizumab tiêm dưới da và 9,65 ở nhóm tocilizumab truyền tĩnh mạch.
Trong nghiên cứu SC-II, ở tuần 24 sự giảm trung bình chỉ số tàn tật qua bảng câu hỏi đánh giá sức khỏe (HAQ-DI) so với thời điểm ban đầu cao hơn đáng kể ở nhóm bệnh nhân dùng tocilizumab tiêm dưới da hai tuần một lần (0,4) khi so sánh với giả dược (0,3). Tỷ lệ bệnh nhân có cải thiện tương ứng về mặt lâm sàng đối với HAQ-DI ở tuần 24 (thay đổi so với thời điểm ban đầu từ 0,3 đơn vị trở lên) cao hơn ở nhóm dùng tocilizumab tiêm dưới da hai tuần một lần (58%) khi so sánh với giả dược (46,8%). SF-36 (thay đổi trung bình đối với điểm thành phần tâm thần và thành phần thể chất) cao hơn đáng kể ở nhóm dùng tocilizumab tiêm dưới da (6,5 và 5,3) khi so sánh với giả dược (3,8 và 2,9).
Đánh giá xét nghiệm
Điều trị với tocilizumab 8 mg/kg kết hợp với DMARD/MTX hoặc tocilizumab đơn trị đem lại cải thiện rất có ý nghĩa thống kê về nồng độ haemoglobin khi so sánh với giả dược + MTX/DMARD (p<0,0001) ở tuần 24. Sự cải thiện rõ rệt nhất được ghi nhận ở các bệnh nhân thiếu máu mạn tính kết hợp với viêm khớp dạng thấp. Nồng độ heamoglobin trung bình tăng từ tuần thứ hai và duy trì trong khoảng bình thường cho đến tuần thứ 24.
Sự giảm đáng kể nồng độ trung bình của những chất phản ứng giai đoạn cấp, CRP, ESR, và amyloid A huyết thanh (SAA) xuất hiện một cách nhanh chóng sau khi truyền tocilizumab. Và điều này phù hợp với tác động của thuốc lên các chất phản ứng giai đoạn cấp, điều trị với tocilizumab có liên quan đến giảm số lượng tiểu cầu trong giới hạn bình thường.
Đơn trị: tocilizumab so với adalimumab
Nghiên cứu WA19924 đánh giá 326 bệnh nhân viêm khớp không dung nạp với MTX hoặc tiếp tục điều trị với MTX nhưng không thích hợp (bao gồm cả những bệnh nhân đáp ứng không hoàn toàn với MTX). Nhóm bệnh nhân dùng tocilizumab truyền tĩnh mạch 8 mg/kg mỗi 4 tuần và tiêm dưới da giả dược mỗi 2 tuần. Nhóm bệnh nhân dùng adalimumab tiêm dưới da 40 mg mỗi 2 tuần và truyền tĩnh mạch giả dược mỗi 4 tuần.
Hiệu quả điều trị có ý nghĩa thống kê đã được ghi nhận ở nhóm tocilizumab cao hơn nhóm adalimumab trong việc kiểm soát hoạt tính bệnh từ lúc ban đầu đến tuần 24 đối với tiêu chí chính là sự thay đổi DAS28 và tất cả các tiêu chí phụ (Bảng 10).
- xem Bảng 10.
Đặc tính dược động học
Dịch truyền tĩnh mạch
Viêm khớp dạng thấp
Dược động học của tocilizumab được xác định bằng phân tích dược động học dân số trên bộ dữ liệu bao gồm 1793 bệnh nhân viêm khớp dạng thấp điều trị với 4 mg/kg và 8 mg/kg truyền tĩnh mạch một giờ mỗi 4 tuần trong 24 tuần.
Các thông số dược động học của tocilizumab không thay đổi theo thời gian. Khi dùng liều 4 mg/kg và 8 mg/kg mỗi 4 tuần, diện tích dưới đường cong (AUC) và nồng độ đáy (Cmin) tăng nhiều hơn mức tỷ lệ với liều. Nồng độ tối đa (Cmax) tăng theo tỉ lệ theo liều. Ở trạng thái ổn định, AUC và Cmin dự kiến lần lượt tăng cao hơn 2,7 và 6,5 lần ở liều 8 mg/kg so với liều 4 mg/kg.
Các thông số sau có giá trị với liều 8 mg/kg tocilizumab mỗi 4 tuần. Giá trị trung bình dự kiến ở trạng thái ổn định của AUC, Cmin và Cmax của tocilizumab lần lượt là 35000±15500 giờ.μg/mL, 9,74±10,5 μg/mL, và 183±85,6 μg/mL. Tỉ số tích lũy của AUC và Cmax có giá trị thấp; lần lượt là 1,22 và 1,06. Tỉ số tích lũy với Cmin (2,35) cao hơn, điều này dự kiến được vai trò của sự thanh thải không tuyến tính ở nồng độ thấp hơn. Trạng thái ổn định cho Cmax, AUC, và Cmin lần lượt đạt được sau khi truyền liều đầu tiên sau 8 tuần và 20 tuần, AUC, Cmin và Cmax của tocilizumab tăng với sự gia tăng trọng lượng cơ thể. Ở trọng lượng cơ thể ≥100kg, AUC trung bình dự đoán (±SD) ở trạng thái ổn định, Cmin và Cmax của tocilizumab là 55.500±14.100 mcg•giờ/mL, 19,0±12,0 mcg/mL, và 269±57 mcg/mL, tương ứng, đó là cao hơn so với giá trị tiếp xúc trung bình ở các bệnh nhân. Vì vậy, liều tocilizumab quá 800 mg mỗi lần truyền không được khuyến khích ở những bệnh nhân >100kg (xem phần Liều lượng và Cách dùng).
Các thông số sau có giá trị với liều 4 mg/kg tocilizumab cho mỗi 4 tuần. AUC trung bình dự đoán (±SD) ở trạng thái ổn định, Cmin và Cmax của tocilizumab là 13.000±5.800 µg.giờ/mL, 1,49±2,13 µg/mL, và 88,3±41,4 µg/mL, tương ứng. Tỷ lệ tích lũy đối với AUC và Cmax là nhỏ; 1,11 và 1,02, tương ứng. Tỷ lệ tích lũy cao hơn cho Cmin (1,96). Trạng thái ổn định đạt được sau khi tiêm liều đầu tiên đối với Cmax và AUC, tương ứng, và sau 16 tuần cho Cmin.
Viêm khớp thiếu niên tự phát thể đa khớp
Dược động học của tocilizumab được xác định bằng phân tích dược động học dân số trên bộ dữ liệu bao gồm 188 bệnh nhân viêm đa khớp vô căn khởi phát ở trẻ em.
Các thông số sau đây có hiệu lực với liều tocilizumab 8 mg/kg (bệnh nhân có trọng lượng cơ thể ≥30kg) dùng mỗi 4 tuần. Giá trị trung bình dự kiến (±SD) của AUC4 tuần, Cmax và Cmin của tocilizumab lần lượt là 29500±8660 mcg•giờ/mL, 182±37 mcg/mL và 7,49±8,2 mcg/mL.
Các thông số sau đây có hiệu lực với liều tocilizumab 10 mg/kg (bệnh nhân có trọng lượng cơ thể <30kg) dùng mỗi 4 tuần. Giá trị trung bình dự kiến (±SD) của AUC4 tuần, Cmax và Cmin của tocilizumab lần lượt là 23200±6100 mcg•giờ/mL, 175±32 mcg/mL và 2,35±3,59 mcg/mL.
Tỉ số tích lũy của AUC4 tuần tương ứng là 1,05 và 1,16, của Cmin là 1,43 và 2,22 cho liều 10 mg/kg (trọng lượng cơ thể <30kg) và 8 mg/kg (trọng lượng cơ thể ≥30kg). Không theo dõi được tỉ số tích lũy của Cmax.
Viêm khớp thiếu niên tự phát thể hệ thống
Dược động học của tocilizumab được xác định bằng phân tích dược động học dân số trên bộ dữ liệu bao gồm 75 bệnh nhân viêm khớp vô căn khởi phát ở trẻ em một cách có hệ thống điều trị bằng 8 mg/kg (bệnh nhân có trọng lượng cơ thể ≥30kg) hoặc 12 mg/kg (bệnh nhân có trọng lượng cơ thể <30kg), truyền tĩnh mạch mỗi 2 tuần. Giá trị trung bình dự kiến (±SD) của AUC2 tuần, Cmax và Cmin của tocilizumab lần lượt là 32200±9960 giờ·µg/mL, 245±57,2 µg/mL, và 57,5±23,3 µg/mL. Tỉ số tích lũy của Cmin (tuần 12/tuần 2) là 3,2±1,3. Cmin tocilizumab ổn định sau tuần thứ 12. Các thông số hấp thu tocilizumab trung bình dự kiến tương tự nhau giữa hai nhóm cân nặng.
Dung dịch tiêm dưới da
Dược động học tocilizumab được xác định dựa vào phân tích dược động học trên quần thể nghiên cứu gồm 3552 bệnh nhân viêm khớp dạng thấp điều trị bằng 162 mg tocilizumab tiêm dưới da hàng tuần, 162 mg tocilizumab tiêm dưới da hai tuần một lần và/hoặc 4 hoặc 8 mg/kg truyền tĩnh mạch bốn tuần một lần trong vòng 24 tuần.
Các thông số dược động học của tocilizumab không thay đổi theo thời gian.
Đối với liều 162 mg tiêm mỗi tuần, giá trị trung bình dự kiến (±SD) ở trạng thái ổn định của diện tích dưới đường cong (AUC) một tuần, nồng độ đáy (Cmin) và nồng độ đỉnh (Cmax) của tocilizumab lần lượt là 7970±3432 mcg·giờ/mL, 43,0±19,8 mcg/mL và 49,8±21,0 mcg/mL. Tỷ số tích lũy của AUC, Cmin, và Cmax lần lượt là 6,32, 6,30 và 5,27. Trạng thái ổn định đạt được sau 12 tuần đối với AUC, Cmin, và Cmax.
Đối với liều 162 mg tiêm hai tuần một lần, giá trị trung bình dự kiến (±SD) ở trạng thái ổn định của diện tích dưới đường cong (AUC) hai tuần, nồng độ đáy (Cmin) và nồng độ đỉnh (Cmax) của tocilizumab lần lượt là 3430±2660 mcg·giờ/mL, 5,7±6,8 mcg/mL, và 13,2±8,8 mcg/mL. Tỷ số tích lũy của AUC, Cmin, và Cmax lần lượt là 2,67, 6,02 và 2,12. Trạng thái ổn định đạt được sau 12 tuần đối với AUC và Cmin và sau 10 tuần đối với Cmax.
Hấp thu
Đối với liều tiêm dưới da ở bệnh nhân viêm khớp dạng thấp, thời gian để nồng độ tocilizumab huyết tương đạt đỉnh (tmax) là 2,8 ngày. Sinh khả dụng của tocilizumab tiêm dưới da là 79%.
Phân bố
Sau khi truyền tĩnh mạch, tocilizumab qua thải trừ 2 pha từ vòng tuần hoàn. Ở bệnh nhân viêm khớp dạng thấp thể tích phân bố trung tâm là 3,5 L, thể tích phân bố ngoại biên là 2,9 L, dẫn đến thể tích phân bố ở trạng thái ổn định là 6,4 L.
Ở bệnh nhân nhi mắc pJIA, thể tích phân bố trung tâm là 1,98 L, thể tích phân bố ngoại biên là 2,1 L, dẫn đến thể tích phân bố ở trạng thái ổn định là 4,08 L.
Ở bệnh nhân nhi mắc sJIA, thể tích phân bố trung tâm là 0,94 L, thể tích phân bố ngoại biên là 1,60 L, dẫn đến thể tích phân bố ở trạng thái ổn định là 2,54 L.
Thải trừ
Dịch truyền tĩnh mạch
Độ thanh thải hoàn toàn của tocilizumab phụ thuộc vào nồng độ và là tổng của độ thanh thải tuyến tính và không tuyến tính. Độ thanh thải tuyến tính được ước tính là thông số trong phân tích dược động học dân số nghiên cứu và là 12,5 mL/giờ ở bệnh nhân viêm khớp dạng thấp, 5,8 mL/giờ ở viêm khớp thiếu niên tự phát thể đa khớp và 7,1 mL/giờ ở bệnh nhân viêm khớp thiếu niên tự phát thể hệ thống. Độ thanh thải không tuyến tính phụ thuộc nồng độ đóng vai trò chủ yếu khi nồng độ tocilizumab thấp. Một khi đường thanh thải tuyến tính bị bão hòa, ở nồng độ tocilizumab cao hơn, thanh thải được quyết định chủ yếu bởi thanh thải tuyến tính.
Thời gian bán thải của tocilizumab phụ thuộc nồng độ ở bệnh viêm khớp dạng thấp. Ở trạng thái ổn định, bệnh nhân viêm khớp dạng thấp, t1/2 biểu kiến phụ thuộc nồng độ là 11 ngày với liều 4 mg/kg và 13 ngày với liều 8 mg/kg 4 tuần một lần.
t1/2 của tocilizumab ở trẻ em mắc pJIA là 16 ngày với cả hai nhóm cân nặng (8 mg/kg với trọng lượng ≥30kg hoặc 10 mg/kg với trọng lượng <30kg) trong suốt một khoảng liều ở trạng thái ổn định.
t1/2 của tocilizumab ở trẻ em mắc sJIA là 23 ngày với cả hai nhóm cân nặng (8 mg/kg với trọng lượng ≥30kg hoặc 12 mg/kg với trọng lượng <30kg) ở tuần thứ 12.
Dung dịch tiêm dưới da
Đối với đường dùng tiêm dưới da, thời gian bán thải (t1/2) biểu kiến phụ thuộc vào nồng độ lên tới 12 ngày đối với liều 162 mg mỗi tuần và 5 ngày đối với liều 162 mg hai tuần một lần ở giai đoạn ổn định ở bệnh nhân viêm khớp dạng thấp.
Dược động học ở đối tượng bệnh nhân đặc biệt
Suy gan
Chưa có nghiên cứu chính thức nào được tiến hành ảnh hưởng của suy gan lên dược động học của tocilizumab.
Suy thận
Chưa có nghiên cứu chính thức nào được tiến hành ảnh hưởng của suy thận lên dược động học của tocilizumab. Hầu hết các bệnh nhân trong phân tích dược động học dân số có chức năng thận bình thường hoặc suy thận nhẹ. Suy thận nhẹ (thanh thải creatinine tính theo Cockcroft-Gault < 80mL/phút và ≥50mL/phút) không ảnh hưởng dược động học của tocilizumab.
Không cần chỉnh liều đối với bệnh nhân suy thận nhẹ (dịch truyền tĩnh mạch) và bệnh nhân suy thận nhẹ/trung bình (dung dịch tiêm dưới da).
Các đối tượng đặc biệt khác
Phân tích dược động học dân số ở những bệnh nhân viêm khớp dạng thấp người lớn cho thấy tuổi tác, giới tính và chủng tộc không ảnh hưởng đến dược động học của tocilizumab. Không cần thiết điều chỉnh liều cho các yếu tố nhân khẩu học.
An toàn tiền lâm sàng
Khả năng sinh ung thư
Nghiên cứu về khả năng sinh ung của tocilizumab chưa được tiến hành. Dữ liệu tiền lâm sàng hiện tại cho thấy sự góp phần của cytokine IL-6 đa tác dụng vào sự tiến triển ác tính và đề kháng với chết tế bào theo lập trình của nhiều loại ung thư. Những dữ liệu này không gợi ý có nguy cơ liên quan với khởi phát tiến triển ung thư sau khi điều trị với tocilizumab. Phù hợp với điểm vừa nêu các tổn thương tăng sinh chưa được ghi nhận trong một nghiên cứu độc tính kéo dài 6 tháng ở khỉ đầu chó cũng như không thấy mô tả trong chuột bất hoạt IL-6 trong điều kiện làm giảm IL-6 mạn tính.
Khả năng đột biến gen
Nghiên cứu về độc tính di truyền chuẩn với tocilizumab trên các tế bào của sinh vật có nhân và không nhân điển hình đều cho kết quả âm tính.
Giảm khả năng sinh sản
Các dữ liệu tiền lâm sàng hiện có không gợi ý cho thấy có ảnh hưởng khả năng sinh sản khi điều trị với một chất tương tự tocilizumab. Ảnh hưởng trên cơ quan hoạt động nội tiết hoặc các cơ quan của hệ sinh sản đã không được ghi nhận trong một nghiên cứu độc tính kéo dài của khỉ đầu chó, cũng không thấy ảnh hưởng trên khả năng sinh sản của chuột thiếu IL-6.
Khả năng sinh dị dạng thai
Khi truyền tocilizumab tĩnh mạch vào loài khỉ đầu chó trong giai đoạn sớm thai kỳ, không ghi nhận có ảnh hưởng có hại trực tiếp, hoặc gián tiếp lên thai kỳ hoặc sự phát triển của phôi thai.
Đặc tính khác về an toàn
Một nghiên cứu độc tính trên phôi thai tiến hành trên khỉ đầu chó ghi nhận có tăng nhẹ tình trạng chết phôi thai/sảy thai với nồng độ phơi nhiễm cộng dồn toàn thân cao (>100 lần nồng độ phơi nhiễm ở người) ở nhóm liều cao 50 mg/kg/ngày so với giả dược và các nhóm liều thấp khác. Tỷ lệ sảy thai ở khỉ đầu chó trong điều kiện nuôi nhốt và các trường hợp riêng chết phôi thai/sảy thai đã không cho thấy bất kỳ mối liên quan nào với việc dùng hoặc thời gian dùng tocilizumab. Mặc dù IL-6 dường như không là cytokine chính cho cả sự phát triển thai hoặc kiểm soát miễn dịch của mẹ/bào thai, mối liên hệ của phát hiện này với tocilizumab không thể loại trừ.
Sự vận chuyển của một chất tương đồng ở chuột của tocilizumab vào sữa của những con chuột cho con bú đã được quan sát.
Điều trị với một chất tương đồng ở chuột không gây độc tính ở chuột trưởng thành. Đặc biệt, không gây tổn thương đến sự phát triển hệ xương, chức năng miễn dịch và sự hoàn thiện chức năng sinh sản.
Không có sự khác nhau về độc tính ngoài lâm sàng của tocilizumab trên khỉ đuôi dài khi dùng dạng tiêm dưới da và truyền tĩnh mạch.
Chỉ định/Công dụng
Dịch truyền tĩnh mạch/ dung dịch tiêm dưới da
Viêm khớp dạng thấp (RA)
Tocilizumab, phối hợp với methotrexate (MTX), chỉ định cho:
- Viêm khớp dạng thấp (RA) tiến triển, thể hoạt động, mức độ nặng ở bệnh nhân trưởng thành chưa được điều trị trước đó với MTX
- Viêm khớp dạng thấp (RA) thể hoạt động, mức độ từ trung bình đến nặng ở bệnh nhân người lớn đáp ứng không đầy đủ hoặc không dung nạp với phác đồ điều trị trước đó bằng một hoặc nhiều thuốc chống thấp khớp điều trị cơ bản bệnh (DMARD) hoặc các chất chống yếu tố hoại tử khối u (TNF)
Ở những bệnh nhân này, tocilizumab có thể được dùng đơn trị trong trường hợp không dung nạp với MTX hoặc việc tiếp tục điều trị với MTX là không phù hợp.
Tocilizumab đã được chứng minh làm giảm tỷ lệ tiến triển của tổn thương khớp được xác định bằng X-quang và cải thiện chức năng vận động khi được điều trị kết hợp với methotrexate.
Dịch truyền tĩnh mạch
Viêm khớp thiếu niên tự phát thể đa khớp (pJIA)
Tocilizumab được chỉ định cho điều trị bệnh viêm khớp thiếu niên tự phát thể đa khớp ở bệnh nhân từ hai tuổi trở lên, không đáp ứng đầy đủ với điều trị bằng methotrexate trước đó. Tocilizumab cũng có thể được chỉ định đơn trị trong trường hợp không dung nạp với methotrexate hoặc việc tiếp tục điều trị bằng methotrexate không còn thích hợp.
Viêm khớp thiếu niên tự phát thể hệ thống (sJIA)
Tocilizumab được chỉ định cho điều trị bệnh viêm khớp thiếu niên tự phát thể hệ thống ở trẻ em từ hai tuổi trở lên, không đáp ứng với các thuốc chống viêm không steroid NSAID và corticoid toàn thân. Tocilizumab có thể được dùng đơn trị (trong trường hợp không dung nạp với MTX hoặc việc tiếp tục điều trị với MTX là không phù hợp) hoặc phối hợp với MTX.
Liều lượng & Cách dùng
Hướng dẫn chung
Trong trường hợp cần thay thế bằng bất kỳ thuốc có nguồn gốc sinh học nào cần có sự đồng ý của bác sỹ kê đơn.
Dạng tocilizumab tĩnh mạch nên được pha loãng trong dung dịch NaCl 0,9% vô trùng bằng kỹ thuật vô khuẩn bởi nhân viên y tế (xem phần Hướng dẫn đặc biệt khi sử dụng).
Tocilizumab được khuyến cáo truyền tĩnh mạch trong một giờ.
Tocilizumab tiêm dưới da được đóng gói dưới dạng bơm tiêm đóng sẵn sử dụng một lần có kèm kim tiêm an toàn. Lần tiêm đầu tiên nên được thực hiện dưới sự giám sát của nhân viên y tế.
Không được dùng dạng tiêm dưới da để truyền tĩnh mạch.
Viêm khớp dạng thấp
Việc điều trị nên được bắt đầu bởi nhân viên y tế có kinh nghiệm trong chẩn đoán và điều trị viêm khớp dạng thấp. Nên phát thẻ cảnh báo cho tất cả bệnh nhân điều trị với tocilizumab.
Tocilizumab có thể được dùng đơn trị hoặc kết hợp với MTX và/hoặc các DMARD khác.
Dịch truyền tĩnh mạch
Liều khuyên dùng của tocilizumab cho bệnh nhân người lớn là 8 mg/kg dùng mỗi 4 tuần bằng đường truyền tĩnh mạch.
Với những bệnh nhân có trọng lượng cơ thể hơn 100kg, không khuyến cáo sử dụng liều truyền quá 800 mg mỗi lần (xem Dược động học).
Dung dịch tiêm dưới da
Liều khuyến cáo (với tiêm dưới da) ở người trưởng thành là 162 mg/tuần.
Nếu dùng ở nhà, cần phải đánh giá sự tương hợp của bệnh nhân với dạng tiêm dưới da và hướng dẫn bệnh nhân thông báo cho bác sỹ nếu xuất hiện phản ứng dị ứng trước khi dùng liều tiếp theo. Bệnh nhân nên được chăm sóc y tế ngay nếu có các triệu chứng của phản ứng dị ứng nặng (xem phần Cảnh báo).
Các thông tin liên quan đến việc chuyển đổi bệnh nhân từ tocilizumab truyền tĩnh mạch sang tocilizumab tiêm dưới da liều cố định còn hạn chế. Cần tuân thủ khoảng cách liều mỗi tuần một lần.
Khi bệnh nhân chuyển từ dạng truyền tĩnh mạch sang dạng tiêm dưới da, liều tiêm dưới da đầu tiên nên được dùng ở thời điểm của liều truyền tĩnh mạch kế tiếp dưới sự giám sát của nhân viên y tế. Xem phần Các xét nghiệm.
Bỏ sót liều
Nếu bệnh nhân bị bỏ sót một liều tocilizumab tiêm dưới da hàng tuần trong vòng 7 ngày so với liều dự định, bệnh nhân cần được hướng dẫn dùng liều bị bỏ sót vào ngày dự định kế tiếp. Nếu bệnh nhân bỏ sót một liều tocilizumab tiêm dưới da hai tuần một lần trong vòng 7 ngày so với liều dự định, bệnh nhân cần được hướng dẫn dùng liều bị bỏ sót ngay lập tức và liều sau đó vào ngày dự định tiếp theo.
Các hướng dẫn điều chỉnh liều cho viêm khớp dạng thấp (xem phần "Các xét nghiệm").
• Các bất thường về men gan
• Số lượng tuyệt đối bạch cầu trung tính (ANC) thấp [31]
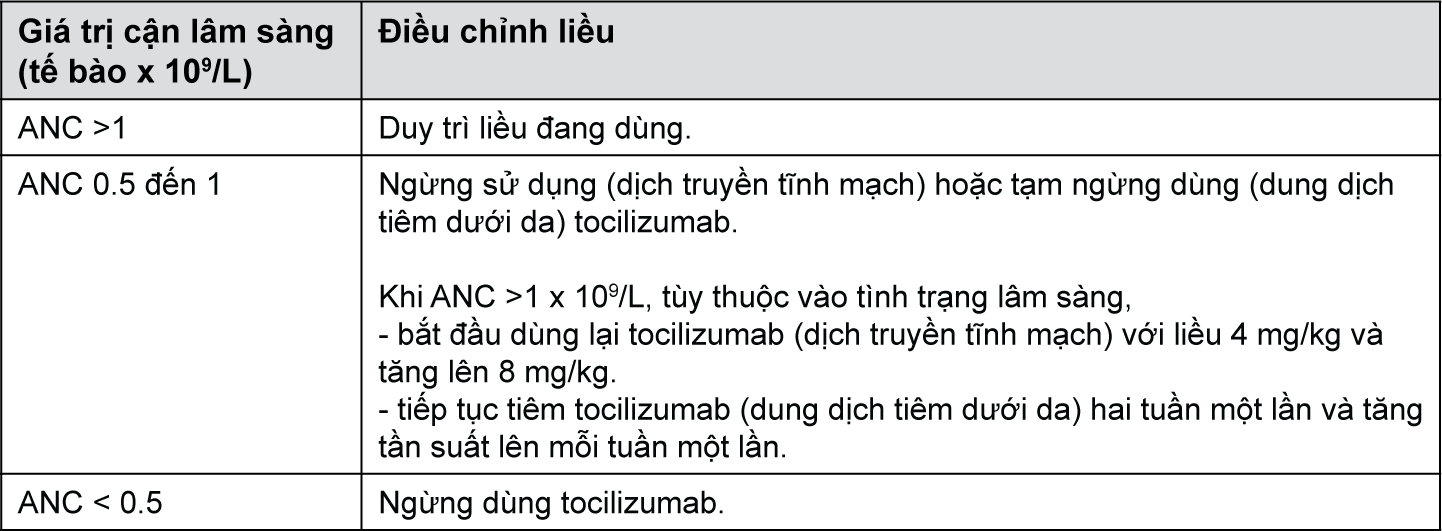
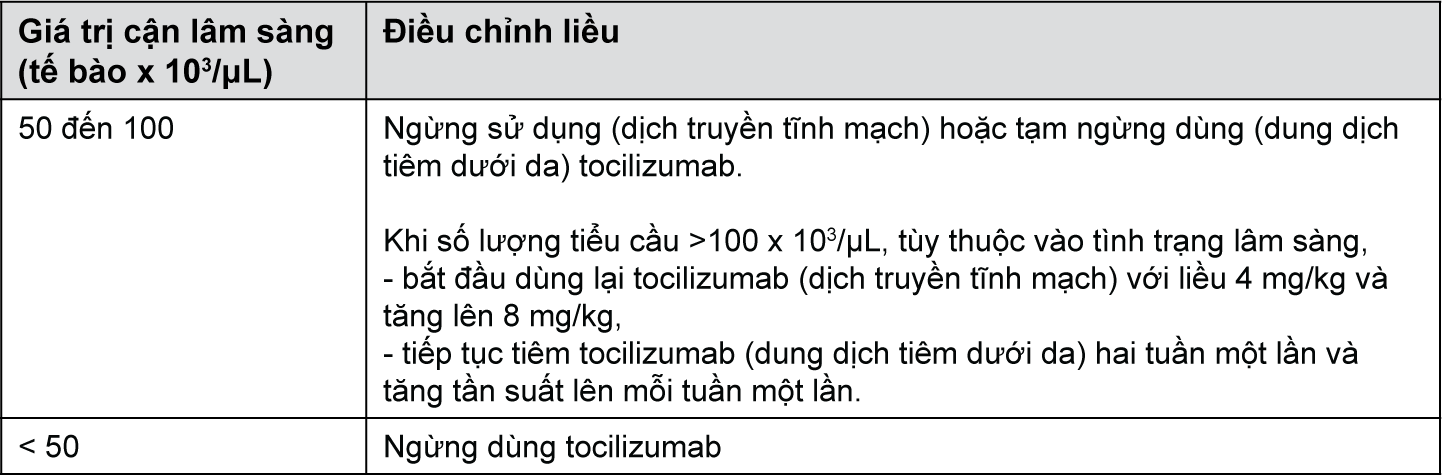
• Số lượng tiểu cầu thấp
Viêm khớp thiếu niên tự phát thể đa khớp (pJIA)
Liều khuyến cáo của tocilizumab cho bệnh nhân viêm khớp thiếu niên tự phát thể đa khớp là:
• 10 mg/kg cho bệnh nhân <30 kilogram (kg),
• 8 mg/kg cho bệnh nhân ≥30 kilogram (kg),
dùng mỗi 4 tuần bằng cách truyền tĩnh mạch. Sự thay đổi liều chỉ được dựa trên sự thay đổi trọng lượng cơ thể theo thời gian. Tocilizumab có thể dùng đơn trị hoặc kết hợp với MTX.
Viêm khớp thiếu niên tự phát thể hệ thống (sJIA)
Liều khuyến cáo của tocilizumab cho bệnh nhân viêm khớp thiếu niên tự phát thể hệ thống là:
• 12 mg/kg cho bệnh nhân <30 kilogram (kg),
• 8 mg/kg cho bệnh nhân ≥30 kilogram (kg),
dùng mỗi 2 tuần bằng cách truyền tĩnh mạch. Sự thay đổi liều chỉ được dựa trên sự thay đổi trọng lượng cơ thể theo thời gian. Tocilizumab có thể dùng đơn trị hoặc kết hợp với MTX.
Các hướng dẫn điều chỉnh liều cho pJIA và sJIA
Việc giảm liều tocilizumab chưa được nghiên cứu trong nhóm bệnh nhân viêm khớp thiếu niên tự phát thể đa khớp hoặc viêm khớp thiếu niên tự phát thể hệ thống. Ngừng dùng tocilizumab khi có các bất thường cận lâm sàng được khuyến cáo ở những bệnh nhân viêm đa khớp hoặc viêm khớp thiếu niên tự phát thể hệ thống và tương tự như những phần đã trình bày ở trên cho bệnh nhân viêm khớp dạng thấp (xem phần "Các xét nghiệm"). Nếu có thể, nên điều chỉnh liều hoặc chấm dứt dùng methotrexate và/hoặc các thuốc dùng đồng thời và ngừng dùng tocilizumab cho đến khi tình trạng lâm sàng được đánh giá. Với bệnh viêm đa khớp vô căn khởi phát ở trẻ em hoặc viêm khớp thiếu niên tự phát thể hệ thống, việc quyết định không dùng tocilizumab do các dấu hiệu bất thường cận lâm sàng cần dựa trên đánh giá của các chuyên gia y tế trên từng bệnh nhân.
Các hướng dẫn liều dùng đặc biệt
Người già/lớn tuổi
Ở những bệnh nhân lớn tuổi trên 65 tuổi không cần chỉnh liều.
Suy thận
Dịch truyền tĩnh mạch
Không cần chỉnh liều ở những bệnh nhân suy thận nhẹ (xem phần Dược động học ở dân số đặc biệt).
Tocilizumab chưa được nghiên cứu ở bệnh nhân suy thận mức độ trung bình đến nặng.
Dung dịch tiêm dưới da
Không cần chỉnh liều ở những bệnh nhân suy thận nhẹ hoặc trung bình (xem phần Dược động học ở đối tượng bệnh nhân đặc biệt). Tocilizumab chưa được nghiên cứu ở bệnh nhân suy thận mức độ nặng.
Suy gan
Tính an toàn và hiệu quả của tocilizumab chưa được nghiên cứu ở bệnh nhân suy gan (xem phần Cảnh báo).
Bệnh nhân nhi
Dịch truyền tĩnh mạch
Tính an toàn và hiệu quả của tocilizumab ở trẻ em ở các tình trạng khác với pJIA hoặc sJIA chưa được xác lập. Chưa có nghiên cứu trên trẻ em dưới 2 tuổi.
Dung dịch tiêm dưới da
Tính an toàn và hiệu quả của tocilizumab tiêm dưới da đối với bệnh nhân nhi từ sơ sinh đến dưới 18 tuổi chưa được thiết lập. Chưa có cơ sở dữ liệu.
Hướng dẫn đặc biệt khi sử dụng
Dịch truyền tĩnh mạch
Thuốc tiêm phải được kiểm tra trực quan xem có cặn hoặc có đổi màu trước khi sử dụng.
Chỉ được truyền các dung dịch trong suốt, không màu đến vàng nhạt và không có cặn.
Viêm khớp dạng thấp
Từ một túi truyền 100 mL, rút ra một lượng dung dịch nước muối sinh lý 0,9% bằng lượng dung dịch tocilizumab cần thiết tương ứng với liều của bệnh nhân. Rút lượng thuốc tocilizumab cần thiết (0,4 mL/kg) dưới điều kiện vô trùng và pha loãng đến nồng độ tocilizumab đã tính toán trong túi dịch truyền 100 mL chứa dung dịch nước muối sinh lý 0,9% vô trùng không chất gây sốt. Để trộn dung dịch, nhẹ nhàng đảo ngược túi dung dịch đã pha để tránh tạo bọt.
Bệnh nhân sJIA và pJIA ≥30kg
Từ một túi truyền 100 mL, rút ra một lượng dung dịch nước muối sinh lý 0,9% bằng lượng dung dịch tocilizumab cần thiết tương ứng với liều của bệnh nhân. Rút lượng thuốc tocilizumab cần thiết (0,4 mL/kg) dưới điều kiện vô trùng và pha loãng đến nồng độ tocilizumab đã tính toán trong túi dịch truyền 100 mL chứa dung dịch nước muối sinh lý 0,9% vô trùng không chất gây sốt. Để trộn dung dịch, nhẹ nhàng đảo ngược túi dung dịch đã pha để tránh tạo bọt.
Bệnh nhân pJIA <30kg
Từ một túi truyền 50 mL, rút ra một lượng dung dịch nước muối sinh lý 0,9% tương đương với 0.5 mL/kg trọng lượng cơ thể bệnh nhân và bỏ đi. Thể tích này được thay thế trong các túi nước muối có thể tích dung dịch tocilizumab tương đương dưới điều kiện vô trùng. Để trộn dung dịch, nhẹ nhàng đảo ngược túi dung dịch đã pha để tránh tạo bọt.
Bệnh nhân sJIA <30kg
Từ một túi truyền 50 mL, rút ra một lượng dung dịch nước muối sinh lý 0,9% tương đương với 0.6 mL/kg trọng lượng cơ thể bệnh nhân và bỏ đi. Thể tích này được thay thế trong các túi nước muối có thể tích dung dịch tocilizumab tương đương dưới điều kiện vô trùng. Để trộn dung dịch, nhẹ nhàng đảo ngược túi dung dịch đã pha để tránh tạo bọt.
Dung dịch tiêm dưới da
Sau khi được đào tạo đúng cách về kỹ thuật tiêm, bệnh nhân có thể tự tiêm Actemra nếu bác sĩ điều trị xác định việc bệnh nhân tự tiêm là phù hợp. Tổng lượng (0,9 mL) của một bơm tiêm đóng sẵn này nên được tiêm dưới da cho bệnh nhân. Các vị trí tiêm (da bụng, đùi hoặc cánh tay) nên được luân chuyển, và không tiêm vào những vị trí có nốt ruồi, sẹo, hoặc các vùng da bị đau khi sờ vào, thâm tím, đỏ, cứng hoặc bị tổn thương.
Không nên lắc bơm tiêm đóng sẵn này.
Hướng dẫn toàn diện về việc sử dụng Actemra trong một bơm tiêm đóng sẵn nằm trong phần Hướng dẫn đặc biệt cho sử dụng.
Cảnh báo
Cảnh báo và thận trọng chung
Để cải thiện việc truy xuất nguồn gốc của các thuốc sinh học, tên thương mại của các thuốc được chỉ định cần được ghi rõ ràng (hoặc ghi) trong hồ sơ bệnh nhân.
Nhiễm trùng
Các nhiễm trùng nặng và đôi khi gây tử vong đã được báo cáo ở những bệnh nhân dùng các tác nhân ức chế miễn dịch bao gồm cả tocilizumab (xem phần Tác dụng ngoại ý). Không nên khởi đầu điều trị tocilizumab ở những bệnh nhân nhiễm trùng tiến triển/thể hoạt động. Nếu bệnh nhân bị nhiễm trùng nặng nên tạm ngừng truyền tocilizumab cho đến khi tình trạng nhiễm trùng được kiểm soát. Các bác sĩ điều trị nên thận trọng khi cân nhắc sử dụng tocilizumab ở bệnh nhân có tiền sử nhiễm trùng tái phát hoặc mạn tính hoặc những điều kiện/tình trạng bệnh sẵn có (như viêm túi thừa, đái tháo đường và bệnh phổi kẽ) có thể làm cho bệnh nhân dễ bị nhiễm trùng.
Khuyến cáo theo dõi chặt để phát hiện kịp thời nhiễm trùng nặng ở những bệnh nhân bị RA, pJIA hoặc sJIA từ trung bình đến nặng điều trị với các thuốc sinh học vì các dấu hiệu và triệu chứng của viêm cấp có thể được giảm bớt, liên quan đến sự ức chế của các chất phản ứng giai đoạn cấp.
Tác dụng của tocilizumab đối với protein phản ứng C (CRP), bạch cầu trung tính và các dấu hiệu và triệu chứng nhiễm trùng nên được xem xét khi đánh giá bệnh nhân có khả năng bị nhiễm trùng. Bệnh nhân (bao gồm trẻ nhỏ ít có khả năng trao đổi về triệu chứng của chúng) và cha mẹ hay người giám hộ của trẻ vị thành niên nên được hướng dẫn để liên hệ với nhân viên y tế ngay khi có bất kỳ triệu chứng gợi ý nhiễm trùng nào xuất hiện, để đảm bảo được đánh giá nhanh và điều trị thích hợp.
Các biến chứng của viêm túi thừa
Biến chứng của viêm túi thừa như các biến cố thủng túi thừa đã được báo cáo xảy ra không phổ biến ở bệnh nhân dùng tocilizumab. Tocilizumab nên được sử dụng thận trọng ở những bệnh nhân có tiền sử loét ruột hoặc viêm túi thừa. Bệnh nhân có các triệu chứng có khả năng là chỉ dấu của viêm túi thừa có biến chứng, như đau bụng, xuất huyết và/hoặc thay đổi thói quen đại tiện không giải thích được kèm sốt, nên được đánh giá kịp thời để xác định sớm thủng tiêu hóa.
Bệnh lao
Khuyến cáo giống như các liệu pháp sinh học khác trong điều trị viêm khớp dạng thấp, pJIA hoặc sJIA, bệnh nhân nên được sàng lọc bệnh lao tiềm ẩn trước khi bắt đầu điều trị tocilizumab. Bệnh nhân có bệnh lao tiềm ẩn cần được điều trị bằng liệu pháp kháng vi khuẩn lao chuẩn trước khi bắt đầu tocilizumab.
Bác sỹ kê đơn cần lưu ý nguy cơ kết quả âm tính giả đối với các xét nghiệm phản ứng da với lao tố và xét nghiệm lao interferon-gamma, đặc biệt ở những bệnh nhân nặng hoặc bệnh nhân suy giảm miễn dịch.
Bệnh nhân nên được hướng dẫn để tìm tư vấn y tế nếu có các dấu hiệu/triệu chứng (ví dụ ho dai dẳng, sút cân/suy mòn, sốt nhẹ) gợi ý nhiễm lao xảy ra trong hoặc sau khi điều trị với tocilizumab.
Hoạt hóa vi rút
Hoạt hóa vi rút (ví dụ như vi rút viêm gan B) đã được báo cáo khi điều trị viêm khớp dạng thấp bằng các thuốc sinh học. Trong các nghiên cứu lâm sàng với tocilizumab, những bệnh nhân qua sàng lọc thấy dương tính với viêm gan đều được loại trừ.
Tiêm chủng
Không nên dùng vắc xin sống và bất hoạt đồng thời với tocilizumab vì tính an toàn lâm sàng chưa được xác lập.
Hiện tại chưa có dữ liệu việc truyền nhiễm thứ phát từ người được tiêm vắc xin sống cho bệnh nhân điều trị bằng tocilizumab. Trong một nghiên cứu mở ngẫu nhiên, các bệnh nhân viêm khớp dạng thấp người lớn điều trị bằng tocilizumab và MTX có thể cộng gộp một phản ứng hiệu quả cho cả polysaccharide phế cầu khuẩn hóa trị 23 và vắc-xin độc tố uốn ván mà có thể so sánh với phản ứng ở các bệnh nhân chỉ điều trị MTX.
Khuyến cáo tất cả bệnh nhân, đặc biệt là bệnh nhân viêm khớp thiếu niên nguyên phát hoặc viêm khớp thiếu niên nguyên phát hệ thống và trẻ em hay người già, nên được chủng ngừa theo hướng dẫn tiêm chủng hiện hành trước khi điều trị với tocilizumab. Khoảng cách giữa lần tiêm vắc xin sống với liều tocilizumab đầu tiên nên thực hiện theo hướng dẫn chủng ngừa vắc xin hiện hành liên quan đến các tác nhân ức chế miễn dịch.
Phản ứng quá mẫn
Các phản ứng quá mẫn nặng/nghiêm trọng bao gồm cả sốc phản vệ dẫn đến tử vong đã được báo cáo có liên quan đến tocilizumab (xem phần Tác dụng ngoại ý, Các thử nghiệm lâm sàng). Sau khi thuốc được lưu hành ra thị trường, các biến cố phản ứng quá mẫn và phản vệ nặng/nghiêm trọng đã xảy ra ở các bệnh nhân được điều trị với nhiều liều lượng tocilizumab khác nhau, dùng cùng hoặc không cùng với các liệu pháp điều trị khác, thuốc tiền mê với steroid và kháng histamin, thuốc dự phòng quá mẫn, và/hoặc phản ứng quá mẫn trước đó. Sau khi thuốc được lưu hành ra thị trường, các trường hợp tử vong do truyền tĩnh mạch tocilizumab cũng đã được báo cáo. Những biến cố này có thể xảy ra ngay từ lần truyền đầu tiên của tocilizumab (xem phần Chống chỉ định và "Sau khi lưu hành ra thị trường").
Nên có sẵn điều trị thích hợp để sử dụng ngay lập tức trong trường hợp có phản ứng phản vệ trong quá trình dùng tocilizumab. Nếu xảy ra phản ứng phản vệ hoặc các phản ứng quá mẫn nghiêm trọng khác, nên dừng sử dụng tocilizumab ngay lập tức và tocilizumab nên được chấm dứt vĩnh viễn (xem phần Liều lượng và Cách dùng).
Bệnh gan tiến triển và suy gan
Điều trị với tocilizumab đặc biệt khi dùng đồng thời với MTX, có thể kết hợp với tăng transaminases gan. Do đó cần thận trọng khi cân nhắc điều trị cho bệnh nhân có bệnh gan tiến triển hoặc suy gan (xem "Các hướng dẫn liều dùng đặc biệt", "Các bất thường về xét nghiệm").
Rối loạn thần kinh
Các bác sĩ nên cảnh giác với các triệu chứng có khả năng biểu hiện của rối loạn hủy myelin trung tâm mới khởi phát. Khả năng hủy myelin trung tâm với tocilizumab hiện vẫn chưa biết.
Bệnh lý ác tính
Nguy cơ mắc bệnh lý ác tính tăng lên ở các bệnh nhân viêm khớp dạng thấp. Các thuốc điều hòa miễn dịch có thể làm tăng nguy cơ mắc bệnh lý ác tính.
Nguy cơ tim mạch
Nguy cơ rối loạn tim mạch tăng ở bệnh nhân viêm khớp dạng thấp và việc kiểm soát các yếu tố nguy cơ (như tăng huyết áp, tăng lipid máu) ở những bệnh nhân này nên được tiến hành thường quy như là một phần của chế độ chăm sóc chuẩn.
Kết hợp với các chất đối kháng TNF
Chưa có kinh nghiệm về việc sử dụng tocilizumab cùng chất đối kháng yếu tố hoại tử khối u (TNF) hay các thuốc sinh học khác để điều trị cho bệnh nhân viêm khớp dạng thấp tự phát hệ thống thanh thiếu niên sJIA (systemic juvenile idiopathic arthritis) và viêm khớp dạng thấp tự phát trẻ em (pJIA (paediatric JIA (Juveline idiopathic arthritis). Tocilizumab không được khuyến cáo sử dụng cùng với các thuốc sinh học khác.
Natri
Actemra chứa 1,17mmol (hoặc 26,55mg) natri trên liều tối đa 1200mg. Cần cân nhắc điều trị đối với những bệnh nhân đang theo chế độ ăn kiểm soát natri. Liều Actemra dưới 1025mg chứa lượng natri ít hơn 1mmol (23mg), không natri.
Các rối loạn khử hóa myelin
Các bác sĩ nên cảnh giác với các triệu chứng có khả năng biểu hiện của rối loạn hủy myelin trung tâm mới khởi phát. Khả năng hủy myelin trung tâm với tocilizumab hiện vẫn chưa biết.
Viêm khớp thiếu niên tự phát thể hệ thống
Hội chứng hoạt hóa đại thực bào (MAS)
MAS là một chứng bệnh nghiêm trọng đe dọa cuộc sống có thể phát triển ở những bệnh nhân sJIA. Trong các thử nghiệm lâm sàng, tocilizumab chưa được nghiên cứu ở những bệnh nhân MAS trong giai đoạn tiến triển.
Sự lạm dụng và lệ thuộc thuốc
Chưa có nghiên cứu về tác động của tocilizumab gây lệ thuộc thuốc được tiến hành. Tuy nhiên, hiện tại không có bằng chứng cho thấy điều trị tocilizumab gây lệ thuộc thuốc.
Khả năng lái xe và vận hành máy móc
Tocilizumab có ảnh hưởng nhỏ đối với khả năng lái xe và vận hành máy móc (xem phần Tác dụng ngoại ý: chóng mặt).
Các xét nghiệm
Các bất thường huyết học
Điều trị bằng tocilizumab thường làm tăng tỷ lệ giảm bạch cầu trung tính và có liên quan với tỷ lệ cao hơn sự giảm số lượng tiểu cầu. Giảm bạch cầu trung tính và giảm tiểu cầu do điều trị không liên quan đến các nhiễm trùng nghiêm trọng và không dẫn tới chảy máu nghiêm trọng trong các thử nghiệm lâm sàng (xem phần "Các bất thường về xét nghiệm").
Giảm bạch cầu trung tính và giảm số lượng tiểu cầu xảy ra sau khi điều trị tocilizumab 8 mg/kg tiêm dưới da kết hợp với MTX (xem Tác dụng ngoại ý).
Nguy cơ giảm bạch cầu có thể tăng ở những bệnh nhân được điều trị bằng chất đối kháng TNF trước đó.
Ở những bệnh nhân chưa dùng tocilizumab trước đó, nên thận trọng khi cân nhắc khởi đầu điều trị Actemra (dịch truyền tĩnh mạch) và không nên khởi đầu điều trị (dung dịch tiêm dưới da) đối với những bệnh nhân có số lượng bạch cầu trung tính thấp chẳng hạn như số lượng bạch cầu trung tính tuyệt đối (ANC) < 2x109/L. Đối với những bệnh nhân có số lượng bạch cầu trung tính tuyệt đối < 0,5x109/L, không khuyến cáo điều trị (dịch truyền tĩnh mạch) và không nên tiếp tục điều trị (dung dịch tiêm dưới da).
Giảm bạch cầu trung tính nặng có thể liên quan đến tăng nguy cơ nhiễm trùng nặng, mặc dù cho đến nay chưa có mối liên hệ rõ rệt giữa giảm bạch cầu trung tính và tình trạng nhiễm trùng nặng ở các thử nghiệm lâm sàng với tocilizumab.
Đối với bệnh nhân RA, bạch cầu trung tính và tiểu cầu nên được theo dõi từ 4 đến 8 tuần sau khi bắt đầu điều trị và sau đó tuân thủ theo thực hành lâm sàng chuẩn. Khuyến cáo điều chỉnh liều dựa vào số lượng bạch cầu trung tính tuyệt đối và số lượng tiểu cầu (xem phần Liều lượng và Cách dùng).
Đối với bệnh nhân pJIA và sJIA, cần kiểm soát số lượng bạch cầu trung tính và số lượng tiểu cầu tại thời điểm truyền thứ hai và sau đó theo hướng dẫn thực hành lâm sàng tốt (xem phần Liều lượng và Cách dùng, Hướng dẫn điều chỉnh liều).
Cần thận trọng khi cân nhắc khởi đầu điều trị tocilizumab cho các bệnh nhân có số lượng tiểu cầu thấp (tức là số lượng tiểu cầu < 100x103/μL).
Đối với những bệnh nhân có số lượng tiểu cầu < 50x103/μL, không nên điều trị (dịch truyền tĩnh mạch) và không nên tiếp tục điều trị (dung dịch tiêm dưới da).
Tăng men gan
Trong các thử nghiệm lâm sàng, tăng men gan nhẹ và vừa thoáng qua hoặc không liên tục đã được ghi nhận khi điều trị bằng tocilizumab, không có sự tiến triển dẫn tới tổn thương gan (xem phần "Các bất thường về xét nghiệm"). Tần số tăng men gan tăng lên đã được ghi nhận khi dùng tocilizumab kết hợp với các thuốc gây độc trên gan [ví dụ methotrexate (MTX)].
Khi có chỉ định lâm sàng, nên cân nhắc việc tiến hành các xét nghiệm chức năng gan khác bao gồm bilirubin.
Cần thận trọng khi cân nhắc bắt đầu điều trị bằng tocilizumab ở bệnh nhân có ALT hoặc AST >1,5xULN.
Không khuyến cáo điều trị ở bệnh nhân có ALT hoặc AST >5xULN.
Cần kiểm tra ALT và AST ở bệnh nhân RA thời điểm 4 tới 8 tuần đối với 6 tháng đầu điều trị và mỗi 12 tuần sau đó và sau đó theo hướng dẫn thực hành lâm sàng tốt. Khuyến cáo điều chỉnh liều dựa trên men gan (xem phần Liều lượng và Cách dùng). Nếu ALT hoặc AST tăng >3-5xULN, tạm ngừng dùng tocilizumab (dung dịch tiêm dưới da) và nên dừng điều trị (dịch truyền tĩnh mạch) nếu được xác nhận bằng việc làm lại xét nghiệm.
Ở bệnh nhân pJIA và sJIA, cần kiểm tra ALT và AST tại thời điểm truyền thứ hai và sau đó theo hướng dẫn thực hành lâm sàng tốt (xem phần Liều lượng và Cách dùng, Hướng dẫn Điều chỉnh liều).
Các thông số lipid
Việc tăng các thông số lipid như cholesterol toàn phần, triglycerides và/hoặc cholesterol lipoprotein tỉ trọng thấp (LDL), cholesterol lipoprotein tỉ trọng cao (HDL) đã được ghi nhận (xem phần "Các bất thường về xét nghiệm"). Trong phần lớn các bệnh nhân, không có tăng các chỉ số xơ vữa, và các bệnh nhân tăng cholesterol toàn phần đáp ứng với điều trị bằng các thuốc hạ lipid máu.
Cần đánh giá các thông số lipid của các bệnh nhân RA, pJIA và sJIA ở thời điểm 4 tới 8 tuần sau khi bắt đầu điều trị với tocilizumab. Bệnh nhân cần được kiểm soát theo các hướng dẫn lâm sàng địa phương về kiểm soát tăng lipid máu.
Quá Liều
Hiện tại các dữ liệu về quá liều tocilizumab còn hạn chế. Một trường hợp quá liều do vô ý đã được báo cáo ở bệnh nhân đa u tủy xương dùng liều đơn 40 mg/kg truyền tĩnh mạch. Không có tác dụng ngoại ý nào được ghi nhận, không có phản ứng bất lợi nghiêm trọng nào xảy ra đối với người tình nguyện khỏe mạnh dùng liều đơn lên đến 28 mg/kg truyền tĩnh mạch, mặc dù giảm bạch cầu trung tính giới hạn liều dùng được ghi nhận.
Chống chỉ định
Chống chỉ định đối với những bệnh nhân mẫn cảm với tocilizumab hoặc bất kỳ thành phần nào của thuốc.
Nhiễm trùng nặng, tiến triển/thể hoạt động (xem phần Cảnh báo).
Sử dụng ở phụ nữ có thai và cho con bú
Thai kỳ
Không có dữ liệu đầy đủ về việc dùng tocilizumab ở phụ nữ mang thai. Một nghiên cứu trên khỉ không cho thấy bất kỳ tiềm năng gây quái thai nào nhưng số trường hợp sẩy thai tự nhiên/chết hoặc đe dọa phôi thai cao hơn ở liều cao (xem phần "Đặc tính khác về an toàn"). Sự liên quan của những dữ liệu này ở người không rõ.
Không nên dùng tocilizumab trong thai kỳ trừ khi có chỉ định với nhu cầu y khoa rõ ràng.
Phụ nữ cho con bú
Chưa rõ liệu tocilizumab có bài tiết qua sữa mẹ hay không. Mặc dù globulin miễn dịch nội sinh của kháng nguyên IgG được tiết ra vào sữa mẹ, sự hấp thu toàn thân của tocilizumab thông qua việc cho bú sữa khó có thể xảy ra do sự thoái hoá nhờ thủy phân nhanh những loại protein này ở hệ thống tiêu hóa. Nên quyết định liệu có nên tiếp tục/ngừng cho bú hoặc tiếp tục/ngừng điều trị với tocilizumab, xét đến lợi ích của việc cho con bú và lợi ích của người phụ nữ khi điều trị với tocilizumab.
Phụ nữ có khả năng mang thai
Phụ nữ có khả năng mang thai cần sử dụng các biện pháp tránh thai hữu hiệu trong thời gian điều trị và trong khoảng 3 tháng sau điều trị.
Tương tác
Các phân tích dược động học dân số không nhận thấy ảnh hưởng của MTX, các thuốc chống viêm không steroid hoặc corticosteroid tới sự thanh thải tocilizumab.
Điều trị đồng thời một liều duy nhất 10 mg/kg tocilizumab với 10-25 mg MTX một lần mỗi tuần không có tác động lâm sàng đáng kể trên sự phơi nhiễm MTX.
Tocilizumab chưa được nghiên cứu trong điều trị kết hợp với các DMARD sinh học khác.
Sự biểu hiện của enzyme CYP450 ở gan bị ức chế bởi các cytokine như IL6, sẽ kích hoạt quá trình viêm mạn tính. Do đó, sự biểu hiện của enzyme CYP450 có thể đảo ngược khi điều trị bằng các thuốc ức chế cytokine mạnh, như tocilizumab.
Các nghiên cứu in vitro trên tế bào gan người nuôi cấy chỉ ra rằng IL-6 làm giảm sự hình thành các enzyme CYP1A2, CYP2C9, CYP2C19, và CYP3A4. Tocilizumab bình thường hoá biểu hiện của các enzyme này.
Ảnh hưởng của tocilizumab tới các enzyme CYP (ngoại trừ CYP2C19 và CYP2D6) có liên quan về mặt lâm sàng với các chất nền CYP450 với chỉ số điều trị hẹp, và/hoặc khi điều chỉnh liều theo từng bệnh nhân.
Trong một nghiên cứu trên bệnh nhân viêm khớp dạng thấp, nồng độ simvastatin (CYP3A4) đã giảm 57% trong 1 tuần sau một liều duy nhất tocilizumab 1 tuần, tới mức tương tự hoặc cao hơn một chút so với nồng độ quan sát được ở người khoẻ mạnh.
Khi bắt đầu hoặc ngừng điều trị với tocilizumab, bệnh nhân dùng các thuốc đang được chỉnh liều theo cá thể và được chuyển hóa qua CYP450, CYP3A4, CYP1A2 hoặc CYP2C9 (ví dụ như atorvastatin, chẹn kênh canxi, theophyllin, warfarin, phenytoin, cyclosporin, hoặc benzodiazepines) cần được theo dõi vì liều các thuốc này có thể cần phải được điều chỉnh để duy trì hiệu quả điều trị. Do thời gian bán thải (t1⁄2) dài, hiệu quả của tocilizumab trên hoạt động của enzyme CYP450 có thể kéo dài vài tuần sau khi ngừng điều trị.
Tác dụng ngoại ý
Các thử nghiệm lâm sàng
Tóm tắt tính an toàn
Phản ứng bất lợi phổ biến nhất được báo cáo (xảy ra ở ≥5% bệnh nhân điều trị với tocilizumab đơn trị hoặc kết hợp với DMARD) là nhiễm trùng đường hô hấp trên, viêm mũi họng, đau đầu, tăng huyết áp và tăng ALT.
Phản ứng bất lợi nghiêm trọng nhất là nhiễm trùng nặng, biến chứng viêm túi thừa và phản ứng quá mẫn.
Tocilizumab dùng đường tĩnh mạch
Tính an toàn của tocilizumab được khảo sát trong 4 nghiên cứu có đối chứng với giả dược (nghiên cứu II, III, IV và V), một nghiên cứu đối chứng với MTX (nghiên cứu I) và giai đoạn mở rộng của các nghiên cứu này.
Giai đoạn nghiên cứu mù đôi có đối chứng kéo dài trong 6 tháng đối với bốn nghiên cứu (nghiên cứu I, III, IV và V) và lên tới 2 năm đối với một nghiên cứu (nghiên cứu II). Trong các nghiên cứu mù đôi có đối chứng, 774 bệnh nhân dùng tocilizumab liều 4 mg/kg kết hợp với MTX, 1870 bệnh nhân dùng tocilizumab 8 mg/kg kết hợp với MTX hoặc các DMARD khác và 288 bệnh nhân dùng tocilizumab 8 mg/kg đơn trị.
Quần thể phơi nhiễm lâu dài bao gồm tất cả những bệnh nhân nhận được ít nhất một liều tocilizumab trong giai đoạn mù đôi có đối chứng hoặc giai đoạn nhãn mở mở rộng trong các nghiên cứu. Trong số 4009 bệnh nhân trong quần thể này, 3577 người được điều trị ít nhất 6 tháng, 3296 được điều trị ít nhất một năm, 2806 người được điều trị ít nhất 2 năm và 1222 trong 3 năm.
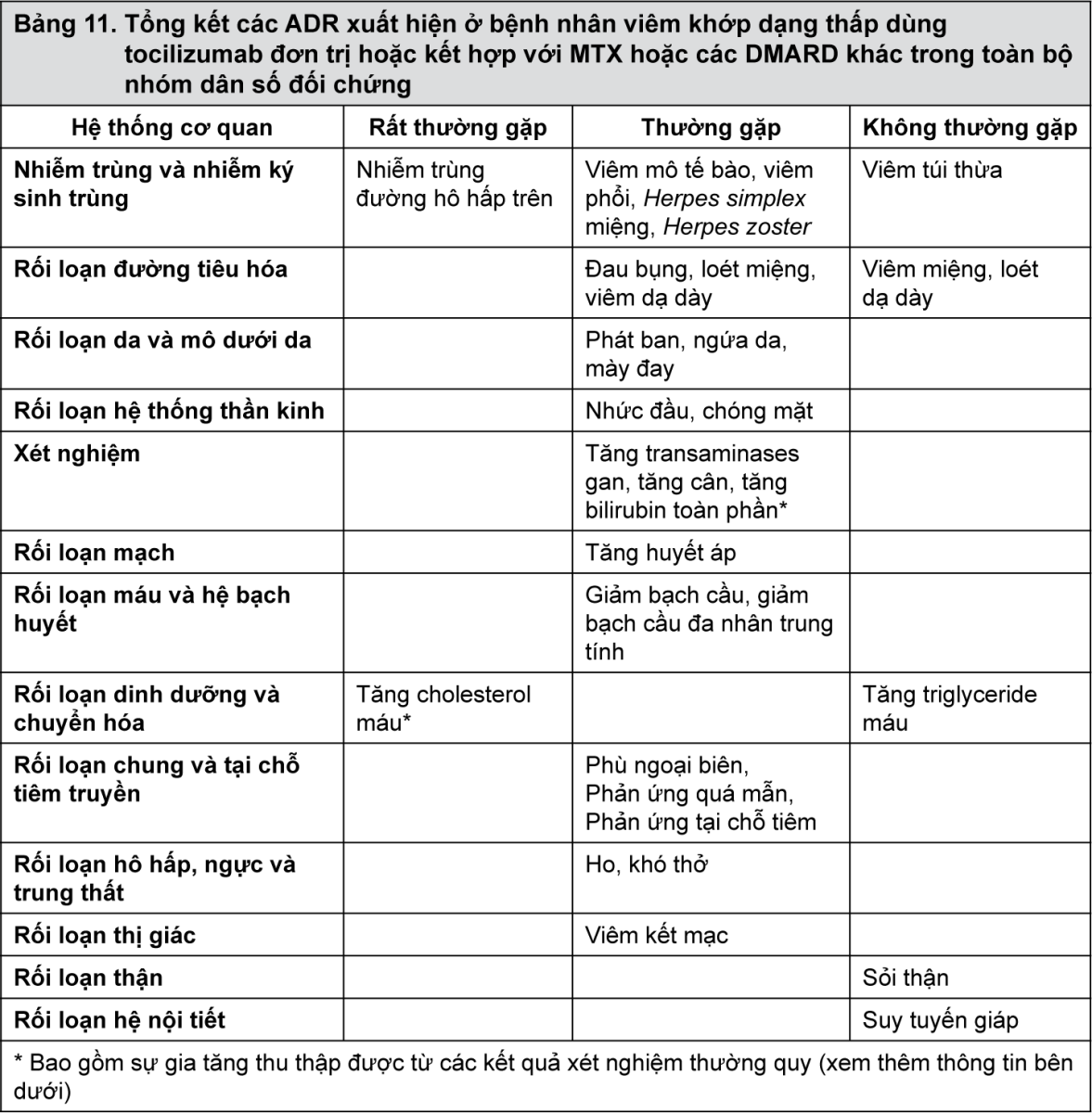
Bảng tóm tắt các phản ứng bất lợi
Các ADR được liệt kê trong Bảng 11 được trình bày theo hệ cơ quan và tần suất, được xác định theo quy ước sau: rất thường gặp (≥1/10); thường gặp (≥1/100 đến <1/10), không thường gặp (≥1/1.000 đến <1/100) hiếm gặp (>1/10.000 đến <1/1.000) hoặc rất hiếm gặp (<1/10.000). Trong mỗi nhóm tần suất, tác dụng không mong muốn được trình bày theo thứ tự giảm dần mức độ nghiêm trọng.
- xem Bảng 11.
Mô tả các phản ứng bất lợi chọn lọc
Nhiễm trùng
Ở các thử nghiệm có đối chứng trong 6 tháng, tỷ lệ nhiễm trùng chung được báo cáo ở các bệnh nhân điều trị tocilizumab 8 mg/kg kết hợp với DMARD là 127 biến cố mỗi 100 bệnh nhân-năm so với 112 biến cố mỗi 100 bệnh nhân-năm ở nhóm giả dược kết hợp với DMARD. Ở quần thể phơi nhiễm lâu dài, tỷ lệ nhiễm trùng toàn bộ đối với tocilizumab là 108 biến cố mỗi 100 bệnh nhân-năm.
Ở các nghiên cứu có đối chứng trong 6 tháng, tỷ lệ nhiễm trùng nghiêm trọng ở các bệnh nhân điều trị tocilizumab liều 8 mg/kg kết hợp với DMARD là 5,3 biến cố mỗi 100 bệnh nhân-năm, so sánh với 3,9 biến cố mỗi 100 bệnh nhân-năm ở nhóm giả dược kết hợp với DMARD. Ở nghiên cứu đơn trị, tỷ lệ nhiễm trùng nghiêm trọng là 3,6 biến cố mỗi 100 bệnh nhân-năm ở nhóm tocilizumab và 1,5 biến cố mỗi 100 bệnh nhân-năm ở nhóm MTX.
Ở quần thể phơi nhiễm lâu dài, tỷ lệ nhiễm trùng nghiêm trọng nói chung (nhiễm vi khuẩn, virus, nấm) là 4,7 biến cố mỗi 100 bệnh nhân-năm. Các trường hợp nhiễm trùng nghiêm trọng được báo cáo, một số trường hợp dẫn đến tử vong, bao gồm bệnh lao hoạt động, có thể xuất hiện với bệnh lý tại phổi hoặc ngoài phổi, nhiễm trùng phổi xâm lấn, bao gồm nhiễm Candida, Aspergilus, Coccidioides immitis và Pneumocystis jirovecii, viêm phổi, viêm mô tế bào, Herpes zoster, viêm dạ dày ruột, viêm túi thừa, nhiễm trùng huyết, viêm khớp nhiễm khuẩn. Các trường hợp nhiễm trùng cơ hội đã được báo cáo.
Bệnh phổi kẽ
Suy giảm chức năng phổi có thể làm tăng nguy cơ nhiễm trùng. Đã có báo cáo ở giai đoạn sau khi lưu hành về bệnh phổi kẽ (bao gồm viêm thành phế nang và xơ hóa phổi), một số trường hợp dẫn tới tử vong.
Thủng đường tiêu hoá
Trong các thử nghiệm lâm sàng có đối chứng trong vòng 6 tháng, tỷ lệ chung của thủng đường tiêu hóa là 0,26 biến cố mỗi 100 bệnh nhân-năm với liệu pháp tocilizumab. Ở quần thể phơi nhiễm toàn bộ, tỷ lệ chung của thủng đường tiêu hóa là 0,28 biến cố mỗi 100 bệnh nhân-năm. Báo cáo về thủng đường tiêu hóa đối với tocilizumab chủ yếu được báo cáo là biến chứng của viêm túi thừa bao gồm viêm phúc mạc toàn thể, thủng đường tiêu hóa dưới, rò và áp xe.
Các phản ứng do tiêm truyền
Trong các thử nghiệm lâm sàng có đối chứng trong 6 tháng, các biến cố ngoại ý liên quan đến tiêm truyền (các biến cố chọn lọc xảy ra trong khi truyền hoặc trong vòng 24 giờ kể từ khi truyền thuốc) được báo cáo với tỷ lệ 6,9% ở nhóm bệnh nhân dùng tocilizumab 8 mg/kg + DMARD và 5,1% ở nhóm bệnh nhân dùng giả dược + DMARD. Các biến cố được báo cáo trong khi truyền chủ yếu là tăng huyết áp, các biến cố được báo cáo trong vòng 24 giờ kể từ khi kết thúc truyền thuốc là đau đầu và phản ứng da (phát ban, mề đay). Những biến cố này không hạn chế việc điều trị.
Tỷ lệ phản vệ (xảy ra ở 8 trong tổng số 4009 bệnh nhân, 0,2%) cao gấp 7 lần ở nhóm sử dụng liều 4 mg/kg khi so sánh với nhóm sử dụng liều 8 mg/kg. Các phản ứng quá mẫn có ý nghĩa lâm sàng liên quan đến tocilizumab và phải ngừng điều trị được báo cáo ở 56 trong tổng số 4009 bệnh nhân (1,4%) điều trị với tocilizumab trong các thử nghiệm lâm sàng có đối chứng và nhãn mở. Các phản ứng này thường xuất hiện trong khi truyền của lần truyền tocilizumab thứ 2 đến thứ 5 (xem phần Cảnh báo, Hướng dẫn chung). Phản vệ dẫn đến tử vong đã được báo cáo ở giai đoạn sau khi lưu hành sản phẩm đối với tocilizumab truyền tĩnh mạch (xem phần Cảnh báo).
Tính sinh miễn dịch
Tổng cộng có 2876 bệnh nhân đã được xét nghiệm kháng thể kháng tocilizumab trong các thử nghiệm lâm sàng có đối chứng trong 6 tháng. Bốn mươi sáu bệnh nhân (1,6%) có kháng thể kháng tocilizumab, 6 bệnh nhân có liên quan đến phản ứng quá mẫn đáng kể về mặt y khoa, trong đó 5 người phải ngưng thuốc vĩnh viễn. Ba mươi bệnh nhân (1,1%) có kháng thể trung hòa.
Các bất thường huyết học
Bạch cầu trung tính
Trong các thử nghiệm có đối chứng trong 6 tháng, giảm số lượng bạch cầu trung tính xuống dưới 1x109/L xảy ra ở 3,4% số bệnh nhân dùng tocilizumab 8 mg/kg + DMARD so sánh với dưới 0,1% số bệnh nhân ở nhóm dùng giả dược + DMARD. Khoảng một nửa số bệnh nhân có ANC dưới 1x109/L xảy ra trong vòng 8 tuần sau khi bắt đầu điều trị. Giảm bạch cầu trung tính xuống dưới 0,5x109/L được báo cáo ở 0,3% số bệnh nhân dùng tocilizumab 8 mg/kg + DMARD. Các trường hợp nhiễm trùng do giảm bạch cầu trung tính cũng đã được báo cáo.
Trong giai đoạn mù đôi có đối chứng và phơi nhiễm lâu dài, kiểu và tần suất giảm bạch cầu trung tính phù hợp với kết quả ghi nhận được trong các thử nghiệm lâm sàng có đối chứng trong 6 tháng.
Tiểu cầu
Trong thử nghiệm có đối chứng trong 6 tháng, sự giảm bạch cầu xuống dưới 100x103/μL xảy ra ở 1,7% số bệnh nhân dùng tocilizumab 8 mg/kg + DMARD so sánh với dưới 1% ở nhóm giả dược + DMARD. Những trường hợp giảm tiểu cầu này không liên quan đến các biến cố chảy máu.
Trong giai đoạn mù đôi có đối chứng và phơi nhiễm lâu dài, kiểu và tần suất giảm tiểu cầu phù hợp với kết quả ghi nhận được trong các thử nghiệm lâm sàng có đối chứng trong 6 tháng.
Rất hiếm các trường hợp báo cáo về giảm toàn thể huyết cầu ở giai đoạn sau khi lưu hành trên thị trường.
Tăng men gan
Trong giai đoạn thử nghiệm có đối chứng trong 6 tháng, tăng men gan thoáng qua với AST/ALT >3xULN được ghi nhận ở 2,1% bệnh nhân dùng tocilizumab 8 mg/kg so với 4,9% bệnh nhân dùng MTX và 6,5 % bệnh nhân dùng tocilizumab 8 mg/kg kết hợp với DMARD so với 1,5% bệnh nhân dùng giả dược kết hợp với DMARD.
Việc dùng thêm các thuốc có khả năng gây độc trên gan (ví dụ MTX) vào liệu pháp tocilizumab đơn trị làm tăng tần suất tăng men gan. Tăng ALT/AST >5xULN được ghi nhận ở 0,7% bệnh nhân dùng tocilizumab đơn trị và 1,4% bệnh nhân dùng tocilizumab kết hợp với DMARD, đa số các bệnh nhân này phải ngừng điều trị tocilizumab vĩnh viễn. Các trường hợp tăng men gan không kết hợp với tăng bilirubin trực tiếp có ý nghĩa lâm sàng, cũng không kết hợp với các bằng chứng lâm sàng của viêm gan hay suy gan. Trong giai đoạn mù đôi có đối chứng, kết quả theo dõi cận lâm sàng thường quy cho thấy tỷ lệ bilirubin gián tiếp tăng cao hơn giới hạn trên bình thường là 6,2% ở nhóm bệnh nhân dùng tocilizumab 8 mg/kg kết hợp với DMARD. Tổng số 5,8% bệnh nhân có tăng bilirubin gián tiếp >1 đến 2xULN và 0,4% tăng >2xULN.
Trong giai đoạn mù đôi có đối chứng và phơi nhiễm lâu dài, kiểu và tần suất tăng ALT/AST vẫn phù hợp với kết quả ghi nhận được trong các thử nghiệm lâm sàng có đối chứng trong 6 tháng.
Các thông số lipid
Trong giai đoạn thử nghiệm có đối chứng trong 6 tháng, tăng các thông số lipid như cholesterol toàn phần, triglyceride, LDL cholesterol và/hoặc HDL cholesterol được báo cáo một cách phổ biến. Các xét nghiệm cận lâm sàng thường quy cho thấy khoảng 24% bệnh nhân dùng tocilizumab trong thử nghiệm lâm sàng bị tăng liên tục cholesterol toàn phần trên 6,2 mmol/L, 15% bệnh nhân bị tăng liên tục LDL lên ≥4,1 mmol/L. Tăng các thông số lipid có đáp ứng với điều trị bằng các thuốc hạ lipid.
Trong giai đoạn mù đôi có đối chứng và phơi nhiễm lâu dài, kiểu và tần suất tăng các thông số lipd vẫn phù hợp với kết quả ghi nhận được trong các thử nghiệm lâm sàng có đối chứng trong 6 tháng.
Các bệnh lý ác tính
Các dữ liệu lâm sàng chưa đủ để đánh giá khả năng mắc các bệnh lý ác tính do phơi nhiễm với tocilizumab. Các nghiên cứu đánh giá tính an toàn lâu dài vẫn đang được thực hiện.
Phản ứng da
Rất hiếm các báo cáo về hội chứng Stevens-Johnson xảy ra ở giai đoạn sau lưu hành trên thị trường.
Tocilizumab tiêm dưới da
Tính an toàn của tocilizumab dạng tiêm dưới da ở đã được khảo sát trong nghiên cứu SC-I. Nghiên cứu so sánh hiệu quả và tính an toàn của tocilizumab tiêm dưới da liều 162 mg/tuần với truyền tĩnh mạch liều 8 mg/kg ở 1262 bệnh nhân người lớn bị viêm khớp dạng thấp. Tất cả các bệnh nhân đều không dùng các DMARD trước đó. Tính an toàn và tính sinh miễn dịch của tocilizumab tiêm dưới da phù hợp với tính an toàn đã được biết đến của tocilizumab truyền tĩnh mạch, và không có tác dụng không mong muốn mới xuất hiện (xem Bảng 11) . Tuy nhiên, tần suất bệnh nhân bị phản ứng tại chỗ tiêm ở nhóm dùng tocilizumab tiêm dưới da cao hơn tocilizumab truyền tĩnh mạch (xem phần Các nghiên cứu đánh giá hiệu quả lâm sàng).
Phản ứng tại chỗ tiêm
Trong giai đoạn có đối chứng trong 6 tháng ở nghiên cứu SC-I, tần suất xảy ra phản ứng tại chỗ tiêm đối với tocilizumab tiêm dưới da hàng tuần và nhóm giả dược tiêm dưới da hàng tuần (nhóm truyền tĩnh mạch) tương ứng là 10,1% (64/631) và 2,4% (15/631). Các phản ứng tại chỗ tiêm này (bao gồm ban đỏ, ngứa, đau và tụ máu) có mức độ từ nhẹ đến trung bình. Nhưng phần lớn các phản ứng này có thể tự hồi phục mà không cần điều trị hay ngừng thuốc.
Tính sinh miễn dịch
Trong nghiên cứu SC-I, tất cả 625 bệnh nhân dùng tocilizumab liều 162 mg/tuần đều được kiểm tra kháng thể kháng tocilizumab trong 6 tháng theo dõi. Năm bệnh nhân (0,8%) có xuất hiện kháng thể kháng tocilizumab, và đều là kháng thể trung hòa.
Trong nghiên cứu SC-II, tổng số 434 bệnh nhân điều trị với tocilizumab 162 mg tiêm dưới da hai tuần một lần được đánh giá kháng thể kháng tocilizumab ở giai đoạn có đối chứng trong 6 tháng. Bảy bệnh nhân (1,6%) có kháng thể kháng tocilizumab, trong số đó, sáu bệnh nhân (1,4%) có kháng thể trung hòa kháng tocilizumab. Bốn bệnh nhân dương tính với IgE (0,9%).
Không quan sát thấy mối tương quan nào giữa sự xuất hiện kháng thể và đáp ứng lâm sàng hay các biến cố bất lợi.
Viêm khớp dạng thấp giai đoạn sớm
Nghiên cứu VI (WA19926) đánh giá 1162 bệnh nhân viêm khớp dạng thấp giai đoạn sớm, mức độ trung bình đến nặng và chưa điều trị với MTX và thuốc sinh học. Tính an toàn được quan sát thấy ở nhóm dùng tocilizumab tương tự với tính an toàn đã được biết đến của tocilizumab (xem Bảng 4) (xem phần Dược lý - Các nghiên cứu đánh giá hiệu quả lâm sàng).
Đơn trị: tocilizumab so với adalimumab
Trong một nghiên cứu mù đôi, song song 24 tuần (đơn trị với tocilizumab truyền tĩnh mạch 8 mg/kg mỗi 4 tuần (N=162) so sánh với adalimumab tiêm dưới da 40 mg mỗi 2 tuần (N=162)), tác dụng không mong muốn tổng thể của tocilizumab và adalimumab tương tự nhau. Tỷ lệ bệnh nhân bị tác dụng không mong muốn nghiêm trọng giữa 2 nhóm điều trị là tương đương nhau (tocilizumab 11,7% và adalimumab 9,9%) với tác dụng không mong muốn thường gặp nhất là nhiễm khuẩn (3,1% ở mỗi nhóm). Các chỉ số xét nghiệm đánh giá tính an toàn (như giảm bạch cầu trung tính và giảm tiểu cầu, tăng men gan ALT, AST và tăng lipid) cũng thay đổi tương tự nhau ở 2 nhóm điều trị, tuy nhiên, mức độ thay đổi và tần suất các bất thường đáng chú ý xảy ra ở nhóm tocilizumab cao hơn nhóm adalimumab. 4 bệnh nhân ở nhóm tocilizumab (2,5%) và 2 bệnh nhân ở nhóm adalimumab (1,2%) bị giảm bạch cầu trung tính độ 3 hoặc 4 theo CTC. 11 bệnh nhân ở nhóm tocilizumab (6,8%) và 5 bệnh nhân ở nhóm adalimumab (3,1%) bị tăng ALT mức độ 2 hoặc cao hơn theo CTC. Mức độ tăng LDL trung bình là 0,64 mmol/L (25 mg/dL) ở nhóm tocilizumab và 0,19 mmol/L (7 mg/dL) ở nhóm adalimumab. Độ an toàn quan sát thấy ở nhóm tocilizumab tương tự với độ an toàn đã được biết đến của tocilizumab và không có thêm tác dụng không mong muốn mới xuất hiện (xem Bảng 4) (xem phần Dược lý - Các nghiên cứu đánh giá hiệu quả lâm sàng).
Viêm khớp thiếu niên tự phát thể đa khớp
Độ an toàn của tocilizumab đã được nghiên cứu trên 188 bệnh nhân nhi tuổi từ 2 đến 17, mắc pJIA. Tổng thời gian dùng tocilizumab của bệnh nhân trong nhóm dùng tocilizumab là 184,4 bệnh nhân - năm. Nhìn chung, các loại phản ứng bất lợi của thuốc ở những bệnh nhân pJIA tương tự như các phản ứng đã quan sát thấy ở những bệnh nhân RA và sJIA (xem phần Tác dụng ngoại ý).
Nhiễm trùng
Tỉ lệ các trường hợp nhiễm trùng ở nhóm điều trị tocilizumab là 163,7 biến cố mỗi 100 bệnh nhân - năm. Biến cố quan sát được phổ biến nhất là viêm mũi họng và nhiễm trùng đường hô hấp trên. Tỷ lệ nhiễm trùng nặng cao hơn đáng kể ở những bệnh nhân có trọng lượng <30kg, điều trị bằng liều 10 mg/kg tocilizumab (12,2 mỗi 100 bệnh nhân - năm) so với số bệnh nhân có trọng lượng ≥30kg, điều trị liều 8 mg/kg tocilizumab (4,0 mỗi 100 bệnh nhân - năm). Tỷ lệ nhiễm trùng dẫn đến ngừng thuốc cũng cao hơn đáng kể ở những bệnh nhân có trọng lượng <30kg điều trị liều 10 mg/kg tocilizumab (21,4%) so với những bệnh nhân có trọng lượng ≥30kg, điều trị với liều 8 mg/kg tocilizumab (7,6%).
Phản ứng tiêm truyền
Đối với bệnh nhân pJIA, phản ứng có liên quan đến tiêm truyền được định nghĩa là tất cả các biến cố xảy ra trong hoặc trong vòng 24 giờ truyền. Trong nhóm dùng tocilizumab, 11 bệnh nhân (5,9%) đã từng xảy ra các biến cố trong quá trình truyền, và 38 bệnh nhân (20,2%) gặp một biến cố trong vòng 24 giờ truyền. Một số biến cố phổ biến nhất xuất hiện trong quá trình truyền là đau đầu, buồn nôn và tụt huyết áp và trong vòng 24 giờ truyền là chóng mặt và tụt huyết áp. Nhìn chung, các phản ứng bất lợi của thuốc quan sát được trong hoặc trong vòng 24 giờ truyền tương tự như đã quan sát được ở những bệnh nhân RA và sJIA (xem phần Tác dụng ngoại ý).
Không có báo cáo về các phản ứng quá mẫn có ý nghĩa lâm sàng liên quan đến dùng tocilizumab và dẫn đến phải ngừng điều trị.
Tính sinh miễn dịch
1 bệnh nhân trong nhóm 10 mg/kg <30kg phát hiện dương tính với các kháng thể kháng tocilizumab nhưng không gây phản ứng dị ứng và sau đó phải rút khỏi nghiên cứu.
Viêm khớp thiếu niên tự phát thể hệ thống
Độ an toàn của tocilizumab ở bệnh nhân sJIA đã được nghiên cứu trên 112 bệnh nhân nhi tuổi từ 2 đến 17. Trong thử nghiệm lâm sàng 12 tuần có nhóm chứng, mù đôi, 75 bệnh nhân đã được dùng tocilizumab (8 hoặc 12 mg/kg dựa trên cân nặng). Sau 12 tuần hoặc tại thời điểm kết thúc, do bệnh ngày càng xấu đi, bệnh nhân được tiếp tục điều trị trong giai đoạn mở rộng nhãn mở.
Nhìn chung, các phản ứng bất lợi của thuốc ở những bệnh nhân sJIA tương tự như các phản ứng quan sát thấy trên bệnh nhân RA (xem phần Tác dụng ngoại ý).
Nhiễm trùng
Trong các thử nghiệm có nhóm chứng kéo dài 12 tuần, tỷ lệ của tất cả các trường hợp nhiễm trùng được báo cáo ở nhóm điều trị tocilizumab là 344,7 biến cố mỗi 100 bệnh nhân - năm và 287,0 biến cố mỗi 100 bệnh nhân - năm ở nhóm giả dược. Trong nghiên cứu mở rộng nhãn mở đang tiến hành (Phần II) tỉ lệ chung của các trường hợp nhiễm trùng duy trì tương tự là 306,6 biến cố mỗi 100 bệnh nhân - năm.
Trong các thử nghiệm có nhóm chứng kéo dài 12 tuần, tỉ lệ nhiễm trùng nặng ở nhóm điều trị với tocilizumab là 11,5 biến cố mỗi 100 bệnh nhân - năm. Trong nghiên cứu mở rộng nhãn mở đang tiến hành, tỉ lệ chung của các trường hợp nhiễm trùng nặng duy trì ổn định là 11,3 biến cố mỗi 100 bệnh nhân - năm. Báo cáo về các nhiễm trùng nặng tương tự như quan sát thấy trên bệnh nhân RA với việc bổ sung thêm thủy đậu và viêm tai giữa.
Phản ứng tiêm truyền
Đối với bệnh nhân sJIA, phản ứng có liên quan đến tiêm truyền được định nghĩa là tất cả các biến cố xảy ra trong hoặc trong vòng 24 giờ truyền. Trong thử nghiệm có kiểm soát 12 tuần, bốn phần trăm (4,0%) bệnh nhân của nhóm dùng tocilizumab đã từng xảy ra các biến cố trong quá trình truyền, một biến cố (phù mạch) đã được coi là nghiêm trọng và đe dọa tính mạng, và bệnh nhân đã chấm dứt quá trình nghiên cứu.
Trong thử nghiệm có đối chứng kéo dài 12 tuần, 16% bệnh nhân trong nhóm tocilizumab và 5,4% bệnh nhân trong nhóm giả dược đã từng gặp một biến cố trong vòng 24 giờ truyền. Trong nhóm tocilizumab, các biến cố bao gồm, nhưng không hạn chế điều trị là phát ban, nổi mề đay, tiêu chảy, đau khớp, khó chịu vùng thượng vị và đau đầu. Một trong những biến cố này (nổi mề đay) được coi là nghiêm trọng.
Phản ứng quá mẫn có ý nghĩa lâm sàng liên quan tocilizumab và dẫn đến ngừng điều trị, được ghi nhận ở 1 trong số 112 bệnh nhân (<1%) được điều trị với tocilizumab trong thử nghiệm lâm sàng giai đoạn có đối chứng và mở nhãn.
Tính sinh miễn dịch
Tất cả 112 bệnh nhân đã được xét nghiệm kháng thể kháng tocilizumab tại thời điểm ban đầu. 2 bệnh nhân phát hiện dương tính với các kháng thể kháng tocilizumab trong đó có 1 bệnh nhân có phản ứng dị ứng dẫn tới phải ngừng dùng thuốc.
Các bất thường về xét nghiệm
Các bất thường về huyết học
Bạch cầu trung tính
Viêm khớp dạng thấp
Dịch truyền tĩnh mạch: Trong các thử nghiệm lâm sàng có đối chứng kéo dài 6 tháng, sự giảm số lượng bạch cầu trung tính dưới 1x109/L xuất hiện ở 3,4% bệnh nhân điều trị tocilizumab 8 mg/kg + DMARD so với < 0,1% bệnh nhân điều trị với giả dược + DMARD. Khoảng một nửa số trường hợp có ANC dưới 1x109/L xảy ra trong vòng 8 tuần kể từ khi bắt đầu điều trị. Giảm dưới 0,5x109/L được ghi nhận ở 0,3% bệnh nhân điều trị tocilizumab 8 mg/kg + DMARD (xem phần Liều lượng và Cách dùng, Các xét nghiệm).
Dung dịch tiêm dưới da: Trong thời gian 6 tháng theo dõi thử nghiệm SC-I, khi theo dõi các xét nghiệm thường qui cho thấy, giảm bạch cầu trung tính dưới 1x109/L xảy ra ở 2,9% bệnh nhân dùng tocilizumab liều 162 mg/tuần.
Không có mối quan hệ rõ ràng giữa sự giảm bạch cầu trung tính dưới 1x109/L và sự xuất hiện các dấu hiệu nhiễm trùng nặng.
Trong dân số đối chứng toàn bộ và phơi nhiễm toàn bộ, các kiểu và tỷ lệ giảm số lượng bạch cầu trung tính vẫn phù hợp với những gì đã thấy trong các thử nghiệm lâm sàng có đối chứng 6 tháng.
Viêm khớp thiếu niên tự phát thể đa khớp
Trong các xét nghiệm thường quy của nhóm tocilizumab mở rộng, giảm số lượng bạch cầu trung tính dưới 1x109/L xuất hiện ở 3,7% bệnh nhân dùng dịch truyền tĩnh mạch.
Không có mối liên hệ rõ ràng giữa giảm bạch cầu trung tính dưới 1x109/L và sự xuất hiện của nhiễm trùng nặng.
Viêm khớp thiếu niên tự phát thể hệ thống
Trong các kiểm tra thường quy của thử nghiệm có nhóm chứng kéo dài 12 tuần, giảm số lượng bạch cầu trung tính dưới 1x109/L xuất hiện ở 7% bệnh nhân điều trị tocilizumab (dịch truyền tĩnh mạch) và không có trường hợp nào trong nhóm điều trị với giả dược.
Trong nghiên cứu mở rộng nhãn mở đang tiến hành, sự giảm số lượng bạch cầu trung tính dưới 1x109/L xuất hiện ở 15% bệnh nhân điều trị tocilizumab.
Không có mối liên hệ rõ ràng giữa giảm bạch cầu trung tính dưới 1x109/L và sự xuất hiện của nhiễm trùng nặng.
Tiểu cầu
Viêm khớp dạng thấp
Trong các thử nghiệm lâm sàng có đối chứng 6 tháng, sự giảm số lượng tiểu cầu dưới 100x103/mL xảy ra ở 1,7% số bệnh nhân dùng tocilizumab (dịch truyền tĩnh mạch) 8 mg/kg phối hợp với DMARD truyền thống so với <1% bệnh nhân dùng giả dược cộng với DMARD truyền thống, mà không có biến cố chảy máu có liên quan (xem phần Liều lượng và Cách dùng, Xét nghiệm cận lâm sàng).
Trong dân số đối chứng toàn bộ và phơi nhiễm toàn bộ, các kiểu và tỷ lệ giảm số lượng tiểu cầu vẫn phù hợp với những gì đã thấy trong các thử nghiệm lâm sàng có đối chứng 6 tháng.
Trong thời gian 6 tháng theo dõi thử nghiệm SC-I, khi theo dõi các xét nghiệm thường qui cho thấy không có bệnh nhân nào dùng tocilizumab (dung dịch tiêm dưới da) bị giảm tiểu cầu xuống dưới 50x103/μL.
Viêm khớp thiếu niên tự phát thể đa khớp
Trong các kiểm tra thường quy của nhóm tocilizumab mở rộng, giảm số lượng bạch cầu trung tính dưới 50x103/μL xuất hiện ở 1% bệnh nhân dùng dịch truyền tĩnh mạch không liên quan tới chảy máu.
Viêm khớp thiếu niên tự phát thể hệ thống
Trong các kiểm tra thường quy của thử nghiệm có nhóm chứng kéo dài 12 tuần, giảm số lượng tiểu cầu xuống ≤100x103/µL xuất hiện ở 3% bệnh nhân điều trị với giả dược và 1% trong nhóm điều trị tocilizumab (dịch truyền tĩnh mạch).
Trong nghiên cứu mở rộng nhãn mở đang tiến hành, sự giảm số lượng tiểu cầu dưới 100x103/µL xuất hiện ở 3% bệnh nhân điều trị tocilizumab không liên quan tới chảy máu.
Tăng men gan
Viêm khớp dạng thấp
Dịch truyền tĩnh mạch
Trong các thử nghiệm có nhóm chứng kéo dài 6 tháng, ghi nhận có tăng thoáng qua ALT/AST >3xULN ở 2,1% bệnh nhân điều trị tocilizumab 8 mg/kg so với 4,9% bệnh nhân điều trị MTX, và 6,5% bệnh nhân điều trị tocilizumab 8 mg/kg + DMARD so với 1,5% bệnh nhân điều trị giả dược + DMARD. Việc dùng thêm các thuốc có khả năng gây độc tính lên gan (ví dụ MTX) vào liệu pháp tocilizumab đơn trị làm tăng tần suất của các bất thường này. Tăng ALT/AST >5xULN được ghi nhận ở 0,7% bệnh nhân điều trị tocilizumab đơn trị và 1,4% bệnh nhân điều trị tocilizumab + DMARD, phần lớn những bệnh nhân này đã phải ngừng điều trị với tocilizumab (xem phần Liều lượng và Cách dùng, Các xét nghiệm). Những thay đổi không kết hợp với bất kì tình trạng tăng bilirubin trực tiếp có ý nghĩa lâm sàng, chúng cũng không kết hợp bằng chứng lâm sàng của viêm gan hoặc suy gan. Trong việc theo dõi cận lâm sàng thường quy, tỷ lệ bilirubin gián tiếp lớn hơn giới hạn trên bình thường là 6,2% ở những bệnh nhân được điều trị liều 8 mg/kg tocilizumab + DMARD trong tất cả dân số đối chứng.
Trong dân số đối chứng toàn bộ và phơi nhiễm toàn bộ, các kiểu và tỷ lệ tăng ALT/AST vẫn phù hợp với những gì đã thấy trong các thử nghiệm lâm sàng có đối chứng 6 tháng.
Ở nghiên cứu VI, bệnh nhân trưởng thành bị viêm khớp dạng thấp giai đoạn sớm, thể hoạt động, mức độ từ trung bình đến nặng (khoảng thời gian bị bệnh dưới 6 tháng) mà chưa điều trị với MTX bị tăng nhẹ ALT >3xULN so với nhóm đối chứng. Tác dụng không mong muốn này xảy ra ở cả nhóm điều trị với tocilizumab và nhóm đơn trị MTX.
Dung dịch tiêm dưới da
Trong thời gian 6 tháng theo dõi thử nghiệm SC-I, tỷ lệ bệnh nhân bị tăng ALT hoặc AST gấp 3 lần giới hạn trên là 6,5% và 1,4% khi dùng tocilizumab hằng tuần.
Viêm khớp thiếu niên tự phát thể đa khớp
Trong các xét nghiệm thường quy của nhóm tocilizumab mở rộng, ghi nhận có tăng ALT hoặc AST ≥3xULN ở tương ứng 3,7% và <1% bệnh nhân dùng dịch truyền tĩnh mạch.
Viêm khớp thiếu niên tự phát thể hệ thống
Trong các kiểm tra thường quy của thử nghiệm có nhóm chứng kéo dài 12 tuần, ghi nhận có tăng ALT hoặc AST ≥3xULN ở tương ứng 5% và 3% bệnh nhân trong nhóm điều trị tocilizumab (dịch truyền tĩnh mạch) và ở 0% bệnh nhân trong nhóm dùng giả dược.
Trong nghiên cứu mở rộng nhãn mở đang tiến hành, tăng ALT hoặc AST ≥3xULN xuất hiện ở tương ứng 12% và 4% bệnh nhân trong nhóm điều trị tocilizumab.
Tăng các thông số lipid
Viêm khớp dạng thấp
Dịch truyền tĩnh mạch
Trong các xét nghiệm thường quy của thử nghiệm lâm sàng có nhóm chứng kéo dài 6 tháng, tăng các thông số lipid (cholesterol toàn phần, LDL, HDL, triglycerides) được ghi nhận ở bệnh nhân điều trị với tocilizumab. Khoảng 24% bệnh nhân điều trị bằng tocilizumab trong các thử nghiệm lâm sàng đã bị tăng liên tục cholesterol toàn phần >6,2 mmol/L (240 mg/dL), với 15% bệnh nhân bị tăng liên tục LDL ≥4,1 mmol/L (160 mg/dL).
Ở phần lớn bệnh nhân không có tăng các chỉ số gây xơ vữa động mạch, và tăng cholesterol toàn phần đáp ứng điều trị với các thuốc hạ lipid.
Trong dân số đối chứng toàn bộ và phơi nhiễm toàn bộ, các kiểu và tỷ lệ tăng các thông số lipid vẫn phù hợp với những gì đã thấy trong các thử nghiệm lâm sàng có đối chứng 6 tháng.
Dung dịch tiêm dưới da
Trong thời gian 6 tháng theo dõi thử nghiệm SC-I, theo dõi các xét nghiệm thường qui ở nhóm bệnh nhân dùng tocilizumab hằng tuần cho thấy có 19% bệnh nhân bị tăng cholesterol >6,2 mmol/L (240mg/dL), trong đó có 9% bệnh nhân bị tăng LDL ≥4,1 mmol/L (160 mg/dL).
Viêm khớp thiếu niên tự phát thể đa khớp
Dịch truyền tĩnh mạch: Trong các xét nghiệm thường quy của nhóm tocilizumab mở rộng, tăng cholesterol toàn phần >1.5-2xULN được ghi nhận ở 1 (0,5%) bệnh nhân và tăng LDL >1,5-2xULN được ghi nhận ở 1 (0,5%) bệnh nhân.
Viêm khớp thiếu niên tự phát thể hệ thống
Dịch truyền tĩnh mạch
Trong các xét nghiệm thường quy của thử nghiệm lâm sàng có nhóm chứng kéo dài 12 tuần, tăng cholesterol toàn phần >1,5xULN đến 2xULN được ghi nhận ở 1,5% bệnh nhân điều trị với tocilizumab và ở 0% bệnh nhân dùng giả dược. Tăng LDL từ >1,5xULN đến 2xULN được ghi nhận ở 1,9% bệnh nhân điều trị bằng tocilizumab và ở 0% bệnh nhân dùng giả dược.
Trong nghiên cứu mở rộng nhãn mở đang tiến hành, mô hình và tần suất tăng các thông số lipid phù hợp với sự tăng các thông số này trong các thử nghiệm lâm sàng có nhóm chứng kéo dài 12 tuần.
Sau khi lưu hành ra thị trường
Tính an toàn trong các kinh nghiệm sau tiếp thị phù hợp với dữ liệu thử nghiệm lâm sàng ngoại trừ các báo cáo sốc phản vệ gây tử vong trong quá trình điều trị tocilizumab (xem phần Chống chỉ định, Cảnh báo). Hội chứng Stevens-Johnson đã được báo cáo trong quá trình điều trị với tocilizumab.
Bảo quản
Với ống tiêm/bơm tiêm: Bảo quản trong tủ lạnh ở nhiệt độ 2-8oC. Không giữ đông. Giữ ống tiêm/bơm tiêm nguyên trong hộp để tránh ánh sáng, giữ khô.
Dung dịch truyền tocilizumab sau khi pha ổn định về mặt vật lý và hóa học trong dung dịch muối sinh lý 0,9% khối lượng/thể tích ở 30oC trong 24 giờ.
Về phương diện vi sinh học, dung dịch truyền sau khi pha nên được dùng ngay lập tức. Nếu không dùng ngay, thời gian bảo quản và các điều kiện trước khi dùng phải được người sử dụng đặc biệt quan tâm và không quá 24 giờ ở 2-8oC, trừ khi thao tác pha thuốc được tiến hành ở những điều kiện vô trùng được công nhận và kiểm soát.
Phân loại ATC
L04AC07 - tocilizumab
Trình bày/Đóng gói
Dung dịch cô đặc pha dịch truyền: ống 4mL, ống 10mL, ống 20mL.
Dung dịch tiêm: hộp 4 bơm tiêm đóng sẵn x 0.9mL.
- Abacavir
- Abernil
- Abiiogran
- Acarbose
- ACC
- Acebutolol
- Acenocoumarol
- Acetate Ringer's
- Acetazolamide
- Acetylcystein
- Acetylsalicylic acid
- Aciclovir
- Acid acetylsalicylic
- Acid aminocaproic
- Acid ascorbic
- Acid boric
- Acid chenodeoxycholic
- Acid ethacrynic
- Acid folic
- Acid fusidic
- Acid iopanoic
- Acid ioxaglic
- Acid nalidixic
- Acid pantothenic
- Acid para-aminobenzoic
- Acid salicylic
- Acid tranexamic
- Acid valproic
- Acid zoledronic
- Acitretin
- Aclasta
- Aclon
- Actapulgite
- Actelsar
- Actelsar HCT
- Actemra
- Actilyse
- Acular
- Acupan
- Acuvail
- Acyclovir STADA
- Acyclovir STADA Cream
- Adalat
- Adenosin
- Adenosin Ebewe
- Adipiodon
- Advagraf
- Aerius
- Afinitor
- Agicarvir
- Agifovir-E
- Agilosart
- Agilosart-H
- Agimepzol
- Agimosarid
- Agimstan
- Agimstan-H
- Agiremid
- Agivastar
- Aibezym
- Air-X
- Alaxan
- Albendazol
- Albiomin
- Albumin
- Albumin người Grifols 20%
- Albuminar
- AlbuRx
- Albutein
- Alcuronium chloride
- Aldesleukin
- Alendronat
- Alertin
- Alfa-Lipogamma 600 Oral
- Alfuzosin hydrochlorid
- Algotra
- Alimemazin
- Alimta
- Allipem
- Allopurinol
- Allopurinol STADA
- Aloxi
- Alprazolam
- Alpha Chymotrypsin
- Alpha tocopherol
- Alphachymotrypsin Glomed
- Alphagan-P
- Aluvia
- Alzental
- Amaryl
- Ambroco
- Ambroxol
- Amcinol-Paste
- Amigold
- Amikacin
- Aminocaproic acid
- Aminoleban
- Aminoleban Oral
- Aminosteril N-Hepa
- Amiparen
- Amitriptyline
- Amiyu
- Amlodipine
- Amlor
- Amoxicillin
- Amoxicillin & clavulanate
- Ampicillin
- Amquitaz
- Anaferon for children
- Anargil
- Anaropin
- Andriol Testocaps
- Anepzil
- Anyfen
- Apaisac
- Apidra SoloStar
- Apitim 5
- Aprovel
- Aquaphil
- Arcalion
- Arcoxia
- Aricept Evess
- Arimidex
- Arnetine
- Artrodar
- A-Scabs
- Ascorbic acid
- Asperlican/Candinazol
- Aspilets EC
- Aspirin
- Asthmatin
- Atelec
- Atocib 120
- Atocib 90
- Atosiban PharmIdea
- Atozet
- Attapulgite
- Atussin
- Atropin
- Augbactam
- Augmentin Sachet
- Augmentin SR
- Augmentin Tablets
- Augmex
- Avamys
- Avastin
- Avelox Dịch truyền
- Avelox Viên nén
- Avodart
- Axcel Cefaclor-125 Suspension
- Axcel Cetirizine Syrup
- Axcel Chlorpheniramine
- Axcel Dexchlorpheniramine
- Axcel Dicyclomine-S Syrup
- Axcel Diphenhydramine Paediatric Syrup
- Axcel Erythromycin ES
- Axcel Eviline
- Axcel Fungicort Cream
- Axcel Fusidic acid Cream
- Axcel Fusidic acid-B Cream
- Axcel Hydrocortisone Cream
- Axcel Lignocaine 2% Sterile Gel
- Axcel Loratadine
- Axcel Miconazole Cream
- Axcel Paracetamol
- Axcel Urea Cream
- Axitan
- Azenmarol
- Azicine
- Aziphar
- Azithromycin