Nhà sản xuất
GlaxoSmithKline
Thành phần
Mỗi liều (0,5mL)
Giải độc tố bạch hầu1: không ít hơn 2 đơn vị quốc tế (IU) (2,5 Lf)
Giải độc tố uốn ván1: không ít hơn 20 đơn vị quốc tế (IU) (5 Lf)
Các kháng nguyên của ho gà (Bordetella pertussis)
· Giải độc tố ho gà1: 8 microgram
· Ngưng kết tố hồng cầu dạng sợi1: 8 microgram
· Pertactin1: 2,5 microgram.
1 được hấp phụ trên aluminium hydroxid, hydrat hoá (Al(OH)3) 0,3 milligram Al3+ và aluminium phosphat (AlPO4) 0,2 milligram Al3+.
Mô tả
Boostrix là hỗn dịch màu trắng đục.
Dược động học
Nhóm dược lý – điều trị: Vắc-xin vi khuẩn dạng phối hợp
Mã ACT: J07AJ52
Đáp ứng miễn dịch
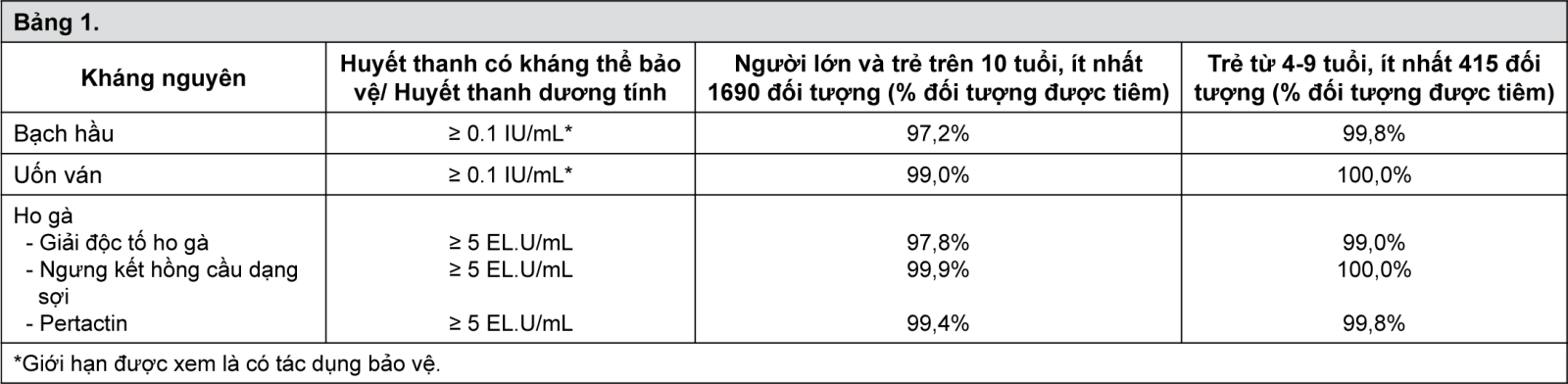
Đáp ứng miễn dịch đối với thành phần bạch hầu, uốn ván và ho gà vô bào trong các nghiên cứu lâm sàng được trình bày trong Bảng 1. Khoảng một tháng sau tiêm ngừa tăng cường với Boostrix, tỉ lệ huyết thanh có kháng thể bảo vệ/huyết thanh dương tính đã được quan sát như sau:
- xem Bảng 1.
Kết quả của các nghiên cứu so sánh với các vắc-xin bạch hầu, uốn ván thương mại (dT) cho thấy mức độ và thời gian bảo vệ không khác biệt so với các vắc-xin này đạt được.
Hiệu lực bảo vệ chống lại bệnh ho gà
Hiện tại không có mức bảo vệ tương quan được xác định đối với bệnh ho gà; tuy nhiên hiệu lực bảo vệ của vắc-xin DTPa của GlaxoSmithKline Biological (Infanrix) chống lại bệnh ho gà điển hình theo định nghĩa của WHO (≥21 ngày ho kịch phát với xét nghiệm xác định) đã được chứng minh trong các nghiên cứu 3 liều cơ bản sau đây:
• Một nghiên cứu tiếp xúc hộ gia đình tiền cứu mù đôi thực hiện ở Đức (lịch tiêm 3, 4, 5 tháng). Dựa trên dữ liệu thu thập được từ tiếp xúc thứ phát trong gia đình, nơi đã có một trường hợp bệnh ho gà điển hình, hiệu lực bảo vệ của vắc-xin là 88,7%. Bảo vệ đối với bệnh nhẹ được xét nghiệm xác nhận, được định nghĩa là ho 14 ngày hoặc hơn đối với bất kỳ loại ho là 73% và 67% khi ho 7 ngày hoặc hơn với bất kỳ loại ho nào.
• Một nghiên cứu hiệu lực của vắc-xin ho gà thực hiện tại Ý, được Viện Sức Khỏe Quốc Gia (NIH) tài trợ (lịch tiêm 2, 4, 6 tháng). Hiệu lực của vắc-xin là 84%. Khi định nghĩa của bệnh ho gà được mở rộng bao gồm các trường hợp nhẹ hơn trên lâm sàng đối với loại ho và khoảng thời gian ho, hiệu lực của Infanrix đã được tính toán là 71% đối với >7 ngày của bất kì loại ho và 73% đối với >14 ngày của bất kỳ loại ho đã được phân loại.
Những người được tiêm Boostrix đã đạt được nồng độ kháng thể kháng ho gà nhiều hơn so với những người trong nghiên cứu thực hiện tại hộ gia đình ở Đức có hiệu lực bảo vệ là 88,7%.
Duy trì đáp ứng miễn dịch
Sau khi tiêm chủng Boostrix 5 đến 6 năm, ít nhất 94% trẻ em từ 4 tuổi trở đi đã có kháng thể bảo vệ hoặc huyết thanh dương tính chống lại tất cả các thành phần vắc-xin, trừ thành phần giải độc tố ho gà (52% đối tượng là huyết thanh dương tính đối với giải độc tố ho gà).
Mười năm sau tiêm chủng Boostrix, ít nhất 86% số người trưởng thành có kháng thể bảo vệ hoặc huyết thanh dương tính chống lại tất cả thành phần vắc-xin.
Với thanh thiếu niên, ít nhất 82% người được kháng thể bảo vệ hoặc có huyết thanh dương tính chống lại các thành phần vắc-xin, trừ thành phần giải độc tố ho gà (61% đối tượng là dương tính đối với giải độc tố ho gà).
Đáp ứng miễn dịch sau 1 liều nhắc Boostrix
Tính sinh miễn dịch của Boostrix được chỉ định 10 năm sau mũi tiêm nhắc trước đó, với vắc-xin có thành phần kháng nguyên của bạch hầu, uốn ván và ho gà vô bào được giảm cũng được đánh giá. Một tháng sau khi tiêm ngừa, trên 99% đối tượng có kháng thể bảo vệ chống lại bệnh bạch hầu, uốn ván và huyết thanh dương tính chống lại bệnh ho gà.
Đáp ứng miễn dịch ở các đối tượng không có hoặc không rõ tiền sử chủng ngừa
Ở thanh thiếu niên tuổi từ 11 đến 18 tuổi, chưa chủng ngừa ho gà trước đó và không tiêm chủng vắc-xin bạch hầu, uốn ván trong 5 năm trước, 1 liều Boostrix đã tạo đáp ứng kháng thể chống lại ho gà và tất cả các đối tượng đều được bảo vệ chống lại bạch hầu và uốn ván.
Trong các đối tượng ≥40 tuổi mà vẫn chưa tiêm bất kỳ vắc-xin nào có thành phần bạch hầu hoặc uốn ván trong 20 năm qua (kể cả những người chưa bao giờ được tiêm phòng hoặc tình trạng tiêm chủng không rõ), một liều Boostrix tạo ra một đáp ứng kháng thể chống lại bệnh ho gà và bảo vệ chống lại bệnh uốn ván và bạch hầu trong phần lớn các trường hợp.
An toàn tiền lâm sàng
Độc tính với cơ quan sinh sản
Khả năng sinh sản
Dữ liệu phi lâm sàng thu được với Boostrix cho thấy không có mối nguy hiểm cụ thể cho người dựa trên các nghiên cứu thông thường đối với khả năng sinh sản nữ ở chuột và thỏ.
Mang thai
Dữ liệu phi lâm sàng thu được với Boostrix cho thấy không có mối nguy hiểm cụ thể đối với người dựa trên các nghiên cứu thông thường của sự phát triển phôi thai/bào thai ở chuột và thỏ, và trong quá trình sinh đẻ và độc tính sau khi sinh ở chuột cũng vậy (tính đến cuối thời kỳ cho con bú).
Độc tính trên động vật và/hoặc dược học
Dữ liệu tiền lâm sàng không thấy có mối nguy hiểm đặc biệt cho con người dựa trên các nghiên cứu thông thường về an toàn và độc tính.
Chỉ định/Công dụng
Boostrix được chỉ định để chủng ngừa nhắc lại cho người từ 4 tuổi trở lên chống lại các bệnh bạch hầu, uốn ván và ho gà (xem phần Liều lượng và Cách dùng).
Liều lượng & Cách dùng
Liều lượng
Liều khuyến cáo của vắc-xin là liều đơn 0,5 mL.
Boostrix có thể được dùng tuân theo thực hành y khoa hiện tại của địa phương về việc tiêm ngừa nhắc lại với vắc-xin kết hợp giảm thành phần bạch hầu – uốn ván, khi cần thiết tiêm một liều vắc-xin nhắc chống lại bệnh ho gà.
Boostrix có thể được tiêm cho thanh thiếu niên và người lớn không biết tình trạng tiêm ngừa hoặc chưa hoàn tất đủ lịch chủng ngừa bạch hầu, uốn ván và ho gà (xem phần Dược động học). Dựa trên dữ liệu trên đối tượng người lớn, khuyến cáo bổ sung 2 liều vắc-xin chứa thành phần bạch hầu và uốn ván vào 1 và 6 tháng sau liều đầu tiên để tối ưu hóa đáp ứng của vắc-xin chống lại bệnh bạch hầu và uốn ván.
Chủng ngừa nhắc lại phòng ngừa bạch hầu, uốn ván và ho gà nên được thực hiện với khoảng cách theo các khuyến cáo chính thức (thường là 10 năm).
Boostrix được sử dụng trong việc quản lý các vết thương có nguy cơ uốn ván ở người trước đó đã được chủng ngừa cơ bản với vắc-xin uốn ván. Huyết thanh kháng uốn ván nên được chỉ định đồng thời theo các khuyến cáo chính thức.
Cách dùng
Boostrix được dùng qua đường tiêm bắp sâu, tốt nhất là ở vùng cơ delta (xem phần Cảnh báo).
Hướng dẫn sử dụng/xử lý
Trước khi tiêm chủng, nên lắc kỹ để có được hỗn hợp màu trắng đục đồng nhất và kiểm tra bằng mắt để xem có những phân tử lạ và/hoặc biến đổi về mặt vật lý. Trong trường hợp thấy có vấn đề, phải loại bỏ vắc-xin.
Thuốc chủng ngừa nên được dùng ngay sau khi mở hộp (không quá 8 giờ sau khi mở nắp).
Cảnh báo
Giống như các vắc-xin khác, nên hoãn tiêm Boostrix cho các đối tượng đang sốt cao cấp tính.
Không chống chỉ định khi có biểu hiện nhiễm khuẩn nhẹ.
Nên hỏi tiền sử y khoa trước khi tiêm chủng (nhất là tiêm chủng trước đó và các biến cố ngoại ý có khả năng xảy ra) và khám lâm sàng.
Nếu bất kỳ biểu hiện nào dưới đây đã xảy ra trong khoảng thời gian có liên quan đến việc dùng vắc-xin có thành phần ho gà, cần cân nhắc cẩn thận khi quyết định sử dụng vắc-xin có chứa thành phần ho gà. Những biểu hiện bao gồm:
• Nhiệt độ ≥40,0oC trong vòng 48 giờ sau tiêm chủng, mà không phát hiện nguyên nhân nào khác;
• Trụy mạch hoặc tình trạng giống shock (đợt giảm trương lực - giảm đáp ứng) trong vòng 48 giờ sau tiêm chủng;
• Quấy khóc kéo dài dỗ không nín kéo dài ≥3 giờ, xuất hiện trong vòng 48 giờ sau tiêm chủng;
• Co giật kèm hoặc không kèm theo sốt, xuất hiện trong vòng 3 ngày sau tiêm chủng.
Ở những trẻ có các rối loạn thần kinh tiến triển, bao gồm các chứng co thắt ở trẻ nhũ nhi, động kinh không kiểm soát hoặc bệnh não tiến triển, tốt hơn nên hoãn tiêm vắc-xin ho gà (vô bào hoặc toàn tế bào) cho đến khi bệnh khỏi hoặc ổn định. Tuy nhiên, quyết định có tiêm vắc-xin ho gà phải tùy thuộc từng trường hợp cụ thể sau khi đã cân nhắc kỹ lưỡng về nguy cơ và lợi ích.
Cũng như tất cả các vắc-xin dạng tiêm, cần luôn có sẵn các biện pháp điều trị y tế và theo dõi thích hợp để phòng ngừa trong trường hợp các phản ứng phản vệ hiếm gặp có thể xảy ra sau tiêm chủng.
Nên thận trọng khi tiêm Boostrix cho những đối tượng bị giảm tiểu cầu hoặc rối loạn chảy máu vì có thể xảy ra hiện tượng chảy máu sau khi tiêm bắp cho những đối tượng này. Nên đè chặt vị trí tiêm (tránh chà xát) ít nhất trong 2 phút.
Không chống chỉ định dùng Boostrix khi bản thân có tiền sử co giật, hoặc tiền sử gia đình về co giật, và tiền sử gia đình có tác dụng ngoại ý sau khi chủng ngừa DTP.
Người nhiễm virus gây suy giảm miễn dịch ở người (HIV) không được xem là chống chỉ định cho chủng ngừa bạch hầu, uốn ván và ho gà. Đáp ứng miễn dịch mong muốn có thể không đạt được sau khi tiêm chủng cho các bệnh nhân suy giảm miễn dịch.
Rất hiếm trường hợp trụy mạch hoặc tình trạng giống như shock (cơn giảm trương lực - giảm đáp ứng) và co giật trong vòng 2-3 ngày sau tiêm chủng đã được báo cáo đối với vắc-xin DTPa và vắc-xin phối hợp có DTPa.
Không tiêm Boostrix vào tĩnh mạch trong bất kể trường hợp nào.
Ngất xỉu có thể xảy ra sau hoặc thậm chí trước khi tiêm đối với bất kỳ vắc-xin nào như là một phản ứng tâm lý đối với mũi tiêm. Điều quan trọng là quy trình chủng ngừa nên ở nơi tránh bị thương do ngất xỉu.
Như với bất kỳ vắc-xin nào khác, đáp ứng miễn dịch bảo vệ có thể không được tạo ra ở tất cả trẻ được tiêm.
Ảnh hưởng đến khả năng lái xe và vận hành máy móc
Vắc-xin không có khả năng tạo ra ảnh hưởng đến khả năng lái xe và vận hành máy móc.
Quá Liều
Các trường hợp quá liều đã được báo cáo trong suốt quá trình giám sát hậu mại. Các tác dụng ngoại ý đã báo cáo sau khi dùng quá liều cũng tương tự như những tác dụng ngoại ý được báo cáo sau khi dùng liều khuyến cáo.
Chống chỉ định
Boostrix không chỉ định cho người có tiền sử quá mẫn với bất kỳ thành phần nào của vắc-xin hoặc người có dấu hiệu quá mẫn sau khi tiêm các vắc-xin bạch hầu, ho gà hoặc uốn ván trước đó.
Chống chỉ định dùng Boostrix nếu người có biểu hiện bệnh lý não không rõ nguyên nhân, xảy ra trong vòng 7 ngày sau tiêm chủng vắc-xin có chứa thành phần ho gà trước đó. Trong trường hợp này nên ngừng tiêm vắc-xin ho gà, và chương trình chủng ngừa vẫn tiếp tục với các vắc-xin bạch hầu và uốn ván.
Chống chỉ định dùng Boostrix đối với người có tiền sử giảm tiểu cầu thoáng qua hoặc các biến chứng về thần kinh sau khi chủng ngừa bạch hầu và/hoặc uốn ván trước đó (co giật hoặc cơn giảm trương lực - giảm đáp ứng, xem phần Cảnh báo).
Sử dụng ở phụ nữ có thai và cho con bú
Khả năng sinh sản
Không có dữ liệu có sẵn trên người. Nghiên cứu trên động vật không cho thấy ảnh hưởng gây hại trực tiếp hoặc gián tiếp đến khả năng sinh sản nữ (xem phần An toàn tiền lâm sàng).
Mang thai
Dữ liệu an toàn từ một nghiên cứu quan sát tiền cứu, Boostrix được dùng cho phụ nữ mang thai trong 3 tháng cuối thai kỳ (793 kết quả của phụ nữ mang thai), cũng như dữ liệu từ giám sát hậu mại, khi phụ nữ mang thai được chỉ định với Boostrix hoặc với Boostrix Polio (vắc-xin dTpa-IPV) cho thấy không có tác dụng ngoại ý liên quan đến vắc-xin trên thời kỳ mang thai hoặc đối với sức khỏe của thai nhi/trẻ sơ sinh.
Boostrix có thể được xem xét sử dụng trong 3 tháng cuối của thai kỳ.
Không có dữ liệu từ các nghiên cứu tiền cứu lâm sàng trên người về việc sử dụng Boostrix trong 3 tháng đầu và 3 tháng giữa của thai kỳ.
Dữ liệu hạn chế cho thấy kháng thể từ người mẹ có thể làm giảm cường độ đáp ứng miễn dịch đối với vài vắc-xin ở trẻ nhỏ sinh ra từ các bà mẹ đã được tiêm Boostrix trong khi mang thai. Sự liên quan về mặt lâm sàng của quan sát này chưa được biết rõ.
Nghiên cứu trên động vật không cho thấy ảnh hưởng gây hại trực tiếp hoặc gián tiếp liên quan đến việc mang thai, sự phát triển phôi/bào thai, sinh đẻ hoặc phát triển sau khi sinh (xem phần An toàn tiền lâm sàng).
Boostrix chỉ nên được sử dụng trong thời kỳ mang thai khi những lợi ích mang lại lớn hơn những rủi ro có thể có cho thai nhi.
Cho con bú
Sự an toàn của Boostrix khi dùng cho phụ nữ cho con bú chưa được đánh giá.
Chưa biết Boostrix được bài tiết trong sữa mẹ hay không.
Boostrix chỉ nên được sử dụng trong quá trình cho con bú khi những lợi ích mang lại lớn hơn những rủi ro tiềm ẩn.
Tương tác
Sử dụng đồng thời với vắc-xin bất hoạt khác và với globulin miễn dịch không dẫn đến sự cản trở đáp ứng miễn dịch.
Khi được xem là cần thiết, Boostrix có thể được chỉ định cùng với vắc-xin khác hoặc globulin miễn dịch.
Nếu tiêm vắc-xin Boostrix cùng thời điểm với vắc-xin dạng tiêm khác hoặc globulin miễn dịch, vắc-xin luôn nên được tiêm ở những vị trí khác nhau.
Cũng như các vắc-xin khác, có thể không đạt được đáp ứng miễn dịch đầy đủ ở những bệnh nhân bị suy giảm miễn dịch hoặc đang điều trị ức chế miễn dịch. Với những bệnh nhân này, nếu vắc-xin uốn ván là cần thiết đối với vết thương có khả năng bị uốn ván, thì vắc-xin uốn ván đơn sẽ được sử dụng.
Tương kỵ
Không trộn lẫn Boostrix với vắc-xin khác trong cùng một bơm tiêm.
Tác dụng ngoại ý
Dữ liệu thử nghiệm lâm sàng
Hồ sơ an toàn trình bày dưới đây dựa trên dữ liệu từ các thử nghiệm lâm sàng, Boostrix được tiêm cho 839 trẻ em (từ 4 đến 9 tuổi) và 1931 người lớn, thanh thiếu niên và trẻ em (trên 10 tuổi).
Tác dụng không mong muốn được báo cáo và phân loại theo tần suất như sau: Rất phổ biến: ≥1/10, Phổ biến: ≥1/100 đến <1/10, Không phổ biến: ≥1/1000 đến <1/100, Hiếm: ≥1/10000 đến <1/1000, Rất hiếm: <1/10000.
Trẻ em từ 4 đến 9 tuổi
Nhiễm khuẩn và nhiễm ký sinh trùng
Không phổ biến: nhiễm khuẩn đường hô hấp trên
Rối loạn chuyển hóa và dinh dưỡng
Rất phổ biến: chán ăn
Rối loạn tâm thần
Rất phổ biến: kích thích
Rối loạn thần kinh
Rất phổ biến: ngủ gà gật
Phổ biến: đau đầu
Không phổ biến: mất tập trung
Rối loạn mắt
Không phổ biến: viêm kết mạc
Rối loạn tiêu hóa
Phổ biến: nôn, tiêu chảy, rối loạn tiêu hóa
Rối loạn da và mô dưới da
Không phổ biến: phát ban
Rối loạn toàn thân và tại chỗ tiêm
Rất phổ biến: phản ứng tại chỗ tiêm như đau, đỏ, sưng tại chỗ tiêm, mệt mỏi
Phổ biến: sốt ≥37,5oC (bao gồm sốt >39oC)
Không phổ biến: phản ứng tại chỗ tiêm khác (chẳng hạn như chai cứng), đau.
Người lớn, thanh thiếu niên và trẻ em từ 10 tuổi trở lên
Nhiễm khuẩn và nhiễm ký sinh trùng
Không phổ biến: nhiễm khuẩn đường hô hấp trên, viêm họng
Rối loạn máu và hệ bạch huyết
Không phổ biến: bệnh hạch bạch huyết
Rối loạn thần kinh
Rất phổ biến: đau đầu
Phổ biến: chóng mặt
Không phổ biến: ngất
Rối loạn hô hấp, ngực và trung thất
Không phổ biến: ho
Rối loạn tiêu hóa
Phổ biến: buồn nôn, rối loạn tiêu hóa
Không phổ biến: tiêu chảy, nôn mửa
Rối loạn da và mô dưới da
Không phổ biến: tăng tiết mồ hôi, ngứa, phát ban
Cơ xương khớp và rối loạn mô liên kết
Không phổ biến: đau khớp, đau cơ, cứng khớp, cứng cơ xương
Rối loạn toàn thân và tại chỗ tiêm
Rất phổ biến: phản ứng tại chỗ tiêm (bao gồm đau, đỏ, sưng), mệt mỏi, khó chịu
Phổ biến: sốt ≥37,5°C, phản ứng tại chỗ tiêm (như sưng hoặc áp-xe vô khuẩn tại chỗ tiêm)
Không phổ biến: sốt >39oC, bệnh tuơng tự như cúm, đau
Phản ứng quá mẫn sau liều nhắc lại Boostrix
Dữ liệu trên 146 đối tượng cho thấy tăng ít phản ứng quá mẫn tại chỗ (đau, đỏ, sung) khi tiêm nhắc lại theo lịch 0, 1, 6 tháng ở người lớn (>40 tuổi).
Các đối tượng đã được tiêm đủ 4 liều căn bản bạch hầu uốn ván ho gà toàn tế bào sau đó thêm 1 liều Boostrix ở tuổi thứ 10 cho thấy một mức tăng phản ứng tại chỗ sau liều Boostrix bổ sung tiêm 10 năm sau đó.
Dữ liệu hậu mại
Rối loạn máu và hệ bạch huyết
Hiếm gặp: phù mạch
Rối loạn hệ miễn dịch
Rất hiếm gặp: phản ứng dị ứng bao gồm phản ứng phản vệ và phản ứng dạng phản vệ
Rối loạn hệ thần kinh
Hiếm gặp: co giật (sốt hoặc không sốt)
Rối loạn da và mô dưới da
Hiếm gặp: nổi mề đay
Rối loạn toàn thân và tại chỗ tiêm
Hiếm gặp: sưng lan tại chi được tiêm vắc-xin, suy nhược.
Bảo quản
Vắc-xin Boostrix nên được bảo quản ở +2oC đến +8oC.
Trong quá trình bảo quản, có thể quan sát thấy tủa trắng và phần nước nổi trong. Đó là hiện tượng bình thường.
Phải tuân thủ khuyến cáo về điều kiện bảo quản vắc-xin trong quá trình vận chuyển.
Không để đông đá hỗn dịch Boostrix. Loại bỏ nếu vắc-xin bị đông đá.
Phân loại ATC
J07AJ52
Trình bày/Đóng gói
Hỗn dịch tiêm: được đóng sẵn trong bơm tiêm hoặc trong lọ thủy tinh đơn liều (lọ và bơm tiêm đóng sẵn được làm từ thủy tinh trung tính loại I, tuân theo các tiêu chuẩn của Dược điển châu Âu).
- Abacavir
- Abernil
- Abiiogran
- Acarbose
- ACC
- Acebutolol
- Acenocoumarol
- Acetate Ringer's
- Acetazolamide
- Acetylcystein
- Acetylsalicylic acid
- Aciclovir
- Acid acetylsalicylic
- Acid aminocaproic
- Acid ascorbic
- Acid boric
- Acid chenodeoxycholic
- Acid ethacrynic
- Acid folic
- Acid fusidic
- Acid iopanoic
- Acid ioxaglic
- Acid nalidixic
- Acid pantothenic
- Acid para-aminobenzoic
- Acid salicylic
- Acid tranexamic
- Acid valproic
- Acid zoledronic
- Acitretin
- Aclasta
- Aclon
- Actapulgite
- Actelsar
- Actelsar HCT
- Actemra
- Actilyse
- Acular
- Acupan
- Acuvail
- Acyclovir STADA
- Acyclovir STADA Cream
- Adalat
- Adenosin
- Adenosin Ebewe
- Adipiodon
- Advagraf
- Aerius
- Afinitor
- Agicarvir
- Agifovir-E
- Agilosart
- Agilosart-H
- Agimepzol
- Agimosarid
- Agimstan
- Agimstan-H
- Agiremid
- Agivastar
- Aibezym
- Air-X
- Alaxan
- Albendazol
- Albiomin
- Albumin
- Albumin người Grifols 20%
- Albuminar
- AlbuRx
- Albutein
- Alcuronium chloride
- Aldesleukin
- Alendronat
- Alertin
- Alfa-Lipogamma 600 Oral
- Alfuzosin hydrochlorid
- Algotra
- Alimemazin
- Alimta
- Allipem
- Allopurinol
- Allopurinol STADA
- Aloxi
- Alprazolam
- Alpha Chymotrypsin
- Alpha tocopherol
- Alphachymotrypsin Glomed
- Alphagan-P
- Aluvia
- Alzental
- Amaryl
- Ambroco
- Ambroxol
- Amcinol-Paste
- Amigold
- Amikacin
- Aminocaproic acid
- Aminoleban
- Aminoleban Oral
- Aminosteril N-Hepa
- Amiparen
- Amitriptyline
- Amiyu
- Amlodipine
- Amlor
- Amoxicillin
- Amoxicillin & clavulanate
- Ampicillin
- Amquitaz
- Anaferon for children
- Anargil
- Anaropin
- Andriol Testocaps
- Anepzil
- Anyfen
- Apaisac
- Apidra SoloStar
- Apitim 5
- Aprovel
- Aquaphil
- Arcalion
- Arcoxia
- Aricept Evess
- Arimidex
- Arnetine
- Artrodar
- A-Scabs
- Ascorbic acid
- Asperlican/Candinazol
- Aspilets EC
- Aspirin
- Asthmatin
- Atelec
- Atocib 120
- Atocib 90
- Atosiban PharmIdea
- Atozet
- Attapulgite
- Atussin
- Atropin
- Augbactam
- Augmentin Sachet
- Augmentin SR
- Augmentin Tablets
- Augmex
- Avamys
- Avastin
- Avelox Dịch truyền
- Avelox Viên nén
- Avodart
- Axcel Cefaclor-125 Suspension
- Axcel Cetirizine Syrup
- Axcel Chlorpheniramine
- Axcel Dexchlorpheniramine
- Axcel Dicyclomine-S Syrup
- Axcel Diphenhydramine Paediatric Syrup
- Axcel Erythromycin ES
- Axcel Eviline
- Axcel Fungicort Cream
- Axcel Fusidic acid Cream
- Axcel Fusidic acid-B Cream
- Axcel Hydrocortisone Cream
- Axcel Lignocaine 2% Sterile Gel
- Axcel Loratadine
- Axcel Miconazole Cream
- Axcel Paracetamol
- Axcel Urea Cream
- Axitan
- Azenmarol
- Azicine
- Aziphar
- Azithromycin