Nhà sản xuất
AstraZeneca
Thành phần
Mỗi viên: Gefitinib 250mg.
Mô tả
Viên nén bao phim, hai mặt lồi, hình tròn, màu nâu, một mặt có khắc “IRESSA 250” và một mặt trơn.
Dược lý
Đặc tính dược lực học
Nhóm dược lý trị liệu: thuốc chống ung thư, ức chế protein kinase, mã ATC: L01XE02.
Cơ chế tác động và tác dụng dược lực
Yếu tố phát triển biểu bì (epidermal growth factor – EGF) và thụ thể (EGFR [HER1; ErbB1]) đóng vai trò chủ yếu trong quá trình phát triển và tăng sinh của tế bào bình thường và tế bào ung thư. Đột biến hoạt hóa EGFR trong tế bào ung thư là yếu tố quan trọng trong việc phát triển khối u, ngăn tế bào chết theo chương trình, tăng hình thành các mạch máu mới và thúc đẩy quá trình di căn của bướu.
Gefitinib là hoạt chất có phân tử nhỏ, ức chế chọn lọc tyrosin kinase trên thụ thể của yếu tố phát triển biểu bì và điều trị hiệu quả ở bệnh nhân có khối u mang đột biến hoạt hóa của EGFR tyrosin kinase bất kể bước điều trị. Không có tác động lâm sàng liên quan ở bệnh nhân có khối u không mang đột biến EGFR.
Đột biến hoạt hóa EGFR thường gặp (mất đoạn trên exon 19, L858R) có nhiều dữ liệu đáp ứng hỗ trợ cho nhạy cảm với gefitinib; ví dụ: thời gian sống còn không tiến triển bệnh HR (95% Cl) 0,489 (0,336; 0,710) trong nhóm gefitinib so với nhóm hóa trị đôi [WJTOG3405]. Ít dữ liệu đáp ứng với gefitinib hơn ở các bệnh nhân có khối u chứa đột biến ít gặp, các dữ liệu sẵn có cho thấy G719X, L861Q và S7681 là các đột biến nhạy thuốc; và T790M đơn độc hoặc đột biến chèn đoạn ở exon 20 đơn độc là các cơ chế đề kháng thuốc.
DNA của khối u trong hệ tuần hoàn (ctDNA)
Trong nghiên cứu lâm sàng IFUM, tình trạng đột biến được đánh giá trên mẫu khối u và mẫu ctDNA chiết tách từ huyết tương, bằng cách sử dụng bộ kít xét nghiệm Therascreen EGFR RGQ PCR (của hãng Qiagen). Cả hai mẫu ctDNA và mẫu khối u đều có thể đánh giá cho 652 bệnh nhân trong tổng số 1060 bệnh nhân đã sàng lọc. Tỷ lệ đáp ứng khách quan của nhóm bệnh nhân có xét nghiệm đột biến dương tính trong cả mẫu khối u và mẫu ctDNA là 77% (95% CI: 66%-86%), và trong nhóm bệnh nhân chỉ có đột biến dương tính trên mẫu khối u là 60% (95% CI: 44%-74%).
- xem Bảng 1.

Các dữ liệu này cũng phù hợp với kết quả phân tích thăm dò định trước trong đề cương nghiên cứu. Trên phân nhóm bệnh nhân Nhật Bản trong nghiên cứu lâm sàng IPASS (Goto 2012). Trong nghiên cứu này, ctDNA chiết tách từ huyết thanh, không phải từ huyết tương, được dùng để phân tích đột biến EGFR sử dụng bộ kít EGFR Mutation Test Kit (DxS) (N=86). Trong nghiên cứu này, độ nhạy là 43,1%, độ đặc hiệu là 100%.
Độ an toàn và hiệu quả của thuốc trên lâm sàng
Điều trị bước 1
Trong một nghiên cứu lâm sàng ngẫu nhiên pha III về điều trị bước 1 trên bệnh nhân Châu Á ung thư phổi không tế bào nhỏ dạng tuyến tiến xa (giai đoạn IIIB hay IV), hút thuốc ít trước đây (ngưng hút thuốc ≥15 năm trước và hút ≤10 gói-năm) hoặc không bao giờ hút thuốc (xem Bảng 2).
1Trung Quốc, Hồng Kông, Indonesia, Nhật, Mã Lai, Philippines, Singapore, Đài Loan và Thái Lan.
- xem Bảng 2.
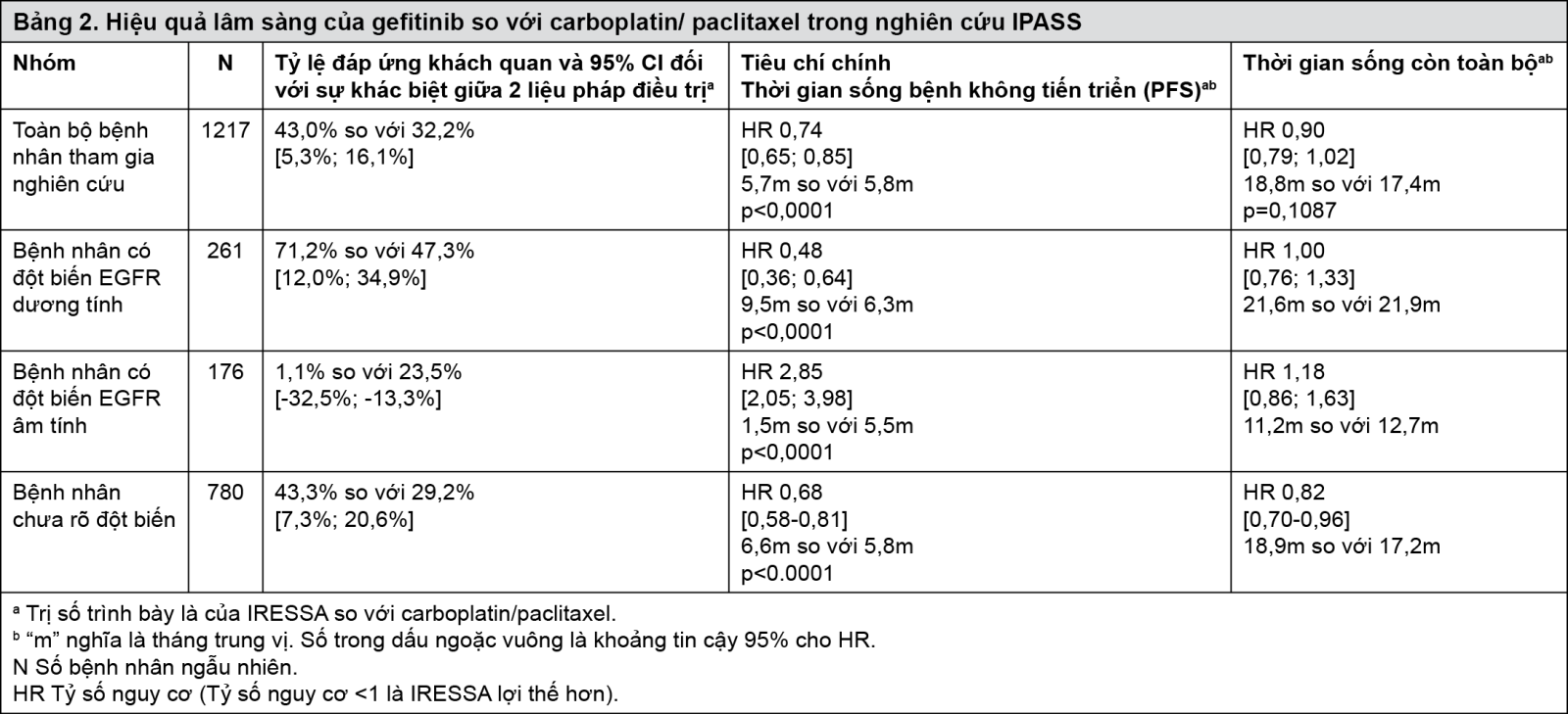
Chất lượng sống khác nhau tùy thuộc vào tình trạng đột biến EGFR. Trong nhóm bệnh nhân có đột biến EGFR, nhiều bệnh nhân điều trị với IRESSA có sự cải thiện đáng kể về chất lượng cuộc sống và triệu chứng ung thư phổi so với carboplatin/paclitaxel (xem Bảng 3).
- xem Bảng 3.

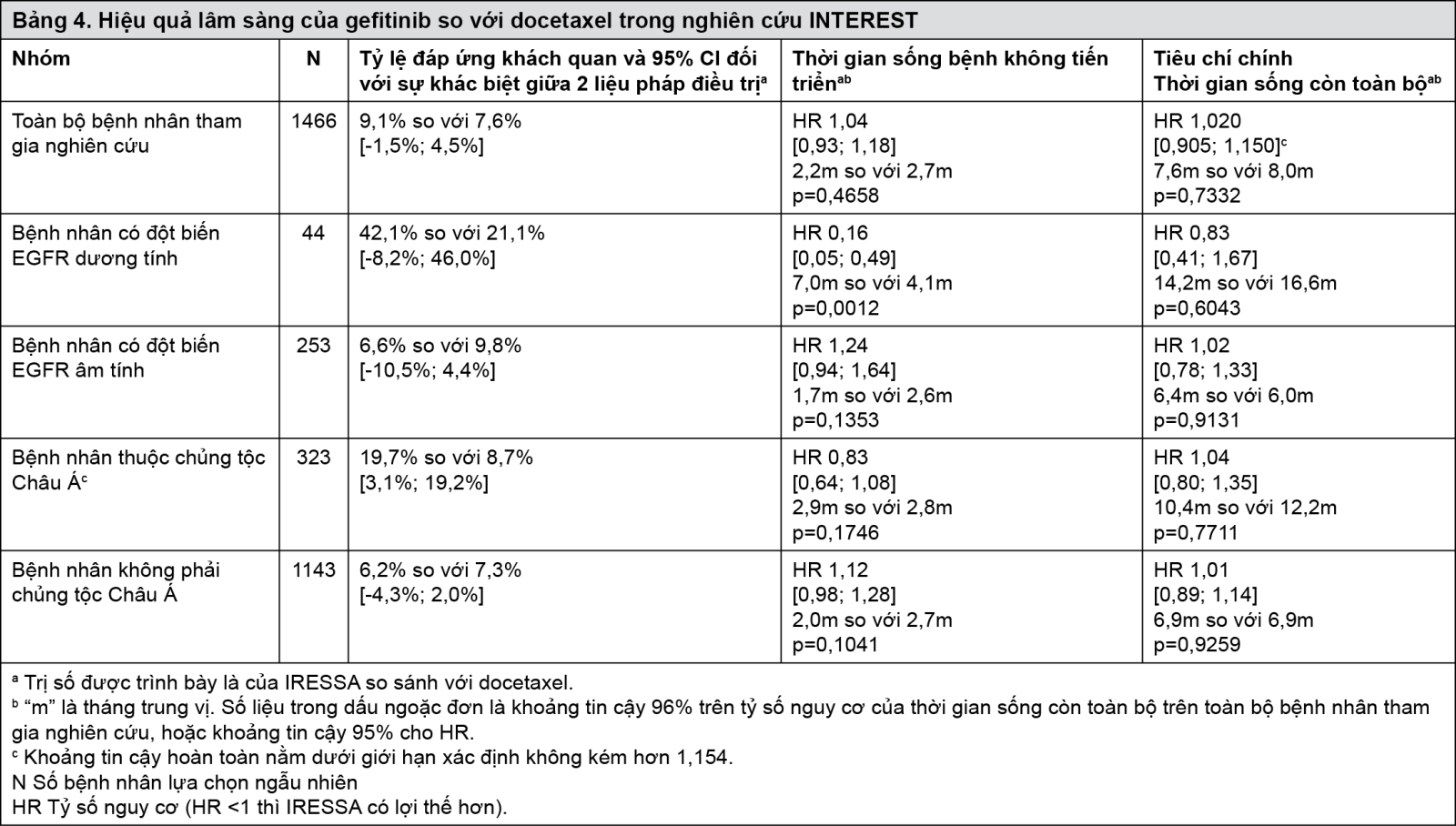
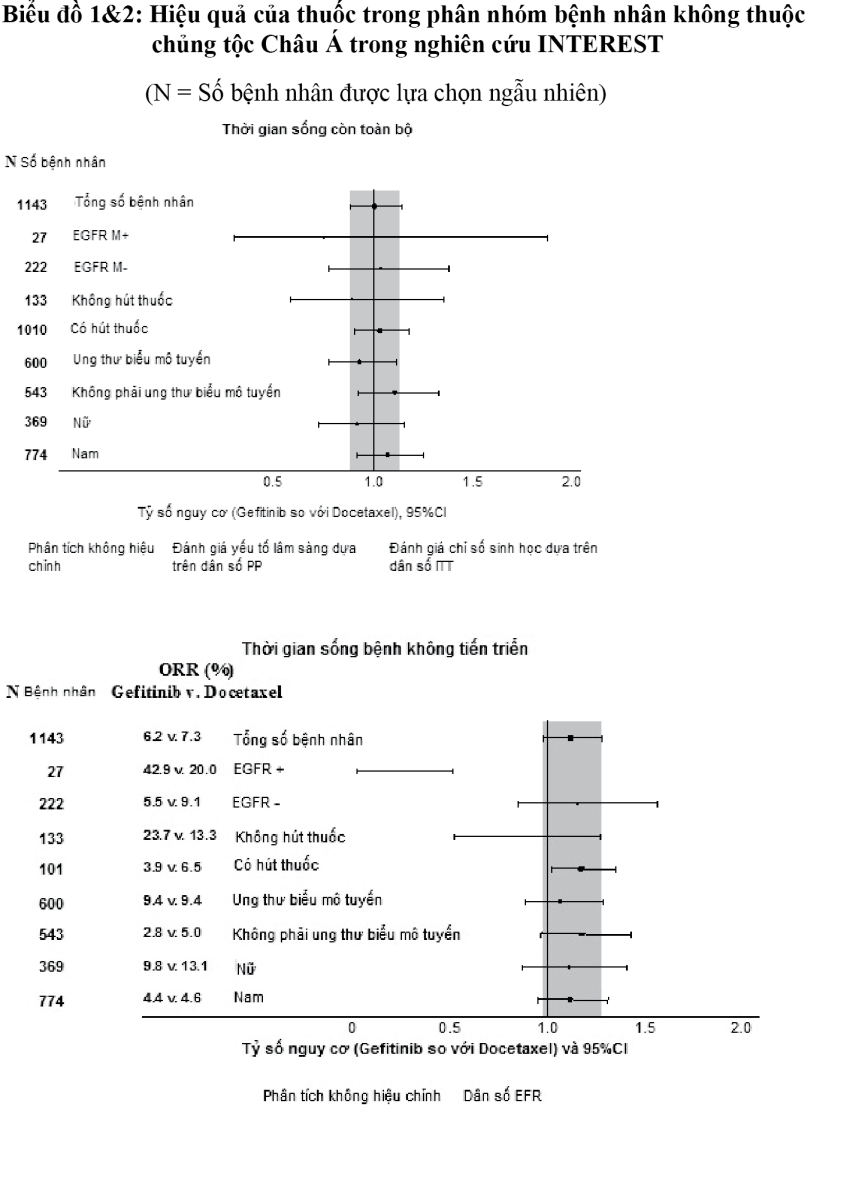
Nghiên cứu lâm sàng pha III (ISEL) thực hiện ngẫu nhiên trên bệnh nhân NSCLC tiến triển mà đã dùng 1 hoặc 2 phác đồ hóa trị trước đó và đã kháng trị hoặc không dung nạp với phác đồ điều trị gần nhất. IRESSA phối hợp với liệu pháp chăm sóc nâng đỡ (BSC: Best Supportive Care) được so sánh với giả dược phối hợp với liệu pháp chăm sóc nâng đỡ. IRESSA không làm kéo dài đáng kể thời gian sống còn trên toàn bộ bệnh nhân tham gia nghiên cứu. Thời gian sống còn khác nhau tùy theo tình trạng hút thuốc và yếu tố chủng tộc (xem Bảng 5).
- xem Bảng 5.
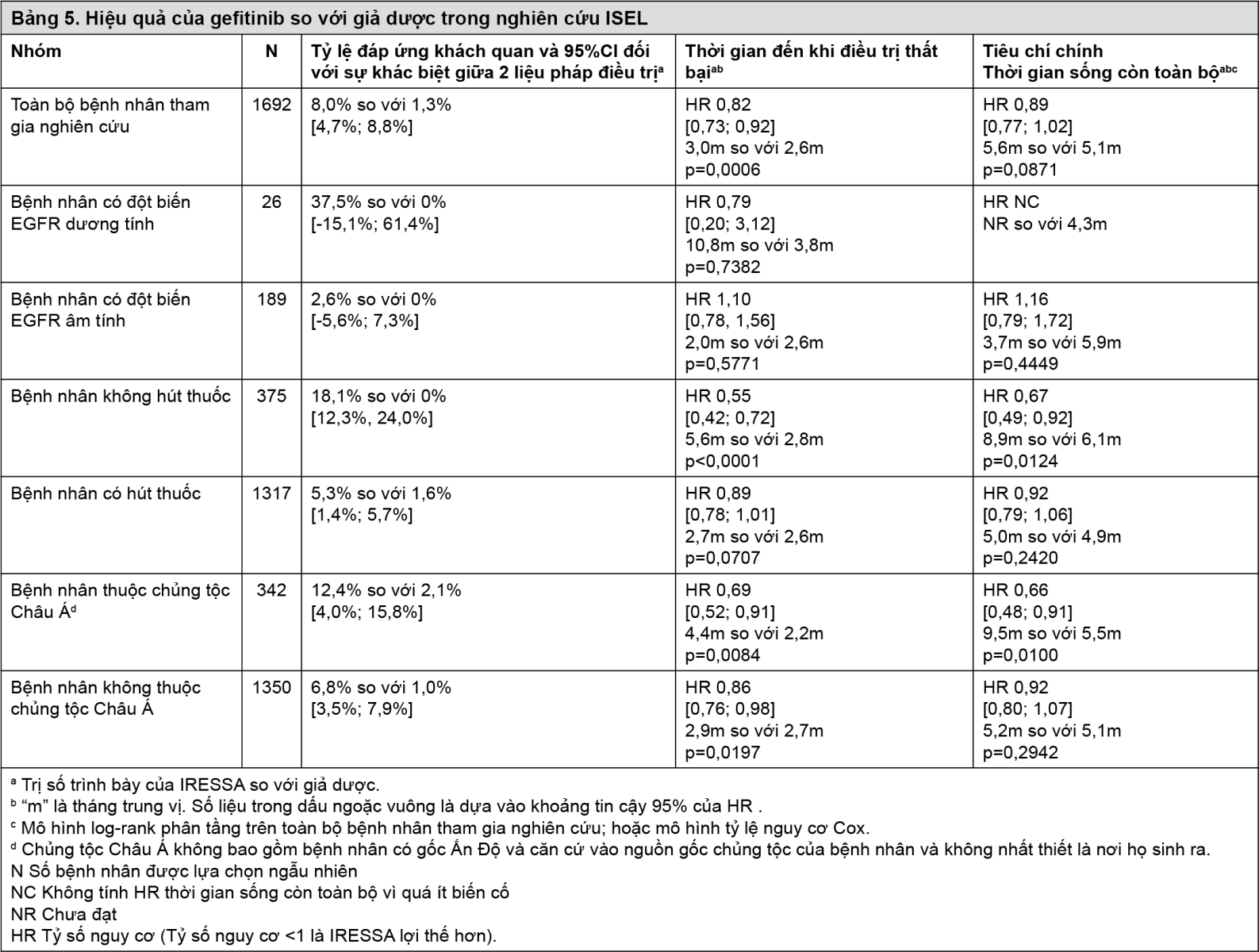
Nghiên cứu IFUM là nghiên cứu đa trung tâm, đơn nhánh, tiến hành trên các bệnh nhân da trắng (n=106) bị ung thư phổi không tế bào nhỏ có đột biến EGFR nhạy cảm hoạt hóa để khẳng định rằng hoạt tính của gefitinib ở bệnh nhân da trắng và bệnh nhân Châu Á là tương tự nhau. Theo đánh giá của nghiên cứu viên, trị số ORR là 70% và trung vị PFS là 9,7 tháng. Các dữ liệu này cũng tương tự như các dữ liệu báo cáo trong nghiên cứu IPASS.
Tình trạng đột biến EGFR và đặc tính lâm sàng
Đặc điểm lâm sàng của bệnh nhân nữ, không hút thuốc, ung thư dạng tuyến cho thấy là yếu tố tiên đoán độc lập về tình trạng đột biến EGFR dương tính trong một phân tích đa biến của 786 bệnh nhân da trắng từ các nghiên cứu gefitinib* (xem Bảng 6). Bệnh nhân châu Á cũng có một tỷ lệ khối u đột biến dương tính cao hơn.
- xem Bảng 6.

Đặc tính dược động học
Hấp thu: Sau khi uống gefitinib, sự hấp thu tương đối chậm và nồng độ đỉnh gefitinib trong huyết tương đạt từ 3-7 giờ sau khi uống thuốc. Sinh khả dụng tuyệt đối trung bình là 59% ở bệnh nhân ung thư. Thức ăn không làm thay đổi đáng kể nồng độ gefitinib trong cơ thể. Trong một thử nghiệm trên người tình nguyện khoẻ mạnh có độ pH dịch vị duy trì >5, nồng độ gefitinib trong cơ thể giảm 47%, có thể là do giảm độ hòa tan của gefitinib ở dạ dày (xem phần ''Cảnh báo'' và ”Tương tác”).
Phân bố: Thể tích phân bố trung bình của gefitinib ở trạng thái hằng định là 1400 lít, chứng tỏ là thuốc phân bố rộng rãi vào các mô. Khoảng 90% thuốc gắn kết với protein huyết tương. Gefitinib gắn kết với albumin và α1-acid glycoprotein trong huyết thanh.
Dữ liệu in vitro cho thấy rằng gefitinib là chất nền cho sự vận chuyển qua màng tế bào của protein Pgp.
Chuyển hóa
Dữ liệu in vitro cho thấy rằng CYP3A4 và CYD2D6 là isozym P450 chính có liên quan đến quá trình chuyển hóa oxy hóa của gefitinib.
Các nghiên cứu in vitro đã chứng tỏ gefitinib ít có khả năng ức chế CYP2D6. Gefitinib cho thấy không có tác động cảm ứng enzym trong các nghiên cứu ở động vật và không ức chế đáng kể (in vitro) trên bất kỳ cytochrom P450 enzym.
Gefitinib được chuyển hóa rộng rãi ở người. 5 chất chuyển hóa đã được nhận biết đầy đủ trong phân và 8 chất chuyển hóa trong huyết tương ở người. Chất chuyển hóa chính được định danh là O-desmethyl gefitinib, hoạt tính kém 14 lần so với gefitinib về khả năng ức chế sự phát triển tế bào được kích hoạt bởi EGFR và không có tác động ức chế sự phát triển tế bào khối u ở chuột. Vì vậy, chất chuyển hóa này được xem như không đóng góp vào tác động lâm sàng của gefitinib.
In vitro, O-desmethyl gefitinib đã được chứng minh là sản sinh qua men CYP2D6. Vai trò của men CYP2D6 trong quá trình thanh thải chuyển hóa gefitinib đã được đánh giá trong một nghiên cứu lâm sàng trên người tình nguyện khỏe mạnh đã khảo sát kiểu gen về tình trạng CYP2D6 (genotyped for CYP2D6 status). Ở người chuyển hóa kém, không phát hiện O-desmethyl gefitinib được sản sinh ở mức độ có thể đo lường được. Nồng độ và thời gian tiếp xúc với gefitinib trong máu ở cả nhóm chuyển hóa mạnh và nhóm chuyển hóa kém đều biến thiên rộng và trùng lắp nhau nhưng nồng độ và thời gian tiếp xúc trung bình với gefitinib trong máu ở nhóm chuyển hóa kém thì cao gấp đôi. Hiện tượng người không có CYP2D6 có nồng độ thuốc và thời gian tiếp xúc với thuốc trong máu cao hơn có thể có ý nghĩa lâm sàng vì đã gặp các phản ứng ngoại ý liên quan đến liều và nồng độ thuốc trong cơ thể.
Thải trừ
Gefitinib được bài tiết chủ yếu dưới dạng chất chuyển hóa qua phân, độ thải trừ thuốc và các chất chuyển hóa qua thận ít hơn 4% liều dùng.
Tổng thanh thải gefitinib trong huyết tương là khoảng 500 ml/phút và trung bình thời gian bán thải cuối là 41 giờ ở bệnh nhân ung thư. Uống gefitinib một lần mỗi ngày sẽ dẫn đến tích lũy thuốc từ 2 đến 8 lần, với nồng độ và thời gian tiếp xúc ở trạng thái ổn định đạt được sau 7-10 liều dùng. Ở trạng thái ổn định, nồng độ thuốc trong huyết tương tuần hoàn được duy trì gấp 2-3 lần với khoảng cách liều 24 giờ.
Các nhóm dân số đặc biệt: Khi phân tích dữ liệu dựa trên nhóm dân số ở bệnh nhân ung thư, không xác định có mối liên hệ giữa nồng độ đáy ở trạng thái ổn định đã tiên đoán trước (predicted steady state trough concentration) và độ tuổi bệnh nhân, thể trọng, giới tính, chủng tộc hoặc độ thanh thải creatinin (>20 ml/phút).
Suy gan
Trong một nghiên cứu nhãn mở pha I dùng liều đơn gefitinib 250 mg trên bệnh nhân suy gan nặng, trung bình hoặc nhẹ do xơ gan (theo phân loại Child-Pugh), đã có sự gia tăng về nồng độ thuốc trong máu trong tất cả nhóm so với nhóm chứng khỏe mạnh. Đã ghi nhận có mức độ phơi nhiễm với gefitinib tăng trung bình gấp 3,1 lần ở bệnh nhân suy gan trung bình và nặng. Không có bệnh nhân nào bị ung thư, tất cả đều bị xơ gan và vài người bị viêm gan. Sự tăng mức phơi nhiễm này có ý nghĩa lâm sàng vì đã gặp các phản ứng ngoại ý liên quan đến liều và mức phơi nhiễm với thuốc trong cơ thể.
Gefitinib đã được đánh giá trong một thử nghiệm lâm sàng thực hiện trên 41 bệnh nhân có bướu đặc (solid tumour) và chức năng gan bình thường, suy chức năng gan trung bình hoặc nặng (phân loại Tiêu chuẩn Đánh giá Độc tính Thường gặp dựa vào AST, alkalin phosphatase và bilirubin) do di căn gan. Kết quả cho thấy sau khi dùng liều hàng ngày IRESSA 250 mg, các trị số như thời gian đạt nồng độ ổn định trong máu, tổng độ thanh thải huyết tương và mức tiếp xúc ở trạng thái ổn định (Cmaxss, AUC24ss) tương tự ở các nhóm có chức năng gan bình thường và chức năng gan suy giảm mức độ trung bình. Dữ liệu của 4 bệnh nhân có chức năng gan rối loạn trầm trọng do di căn gan cho thấy mức phơi nhiễm ở trạng thái ổn định của các bệnh nhân này cũng tương tự như ở bệnh nhân có chức năng gan bình thường.
Chỉ định/Công dụng
IRESSA được chỉ định điều trị cho bệnh nhân người lớn ung thư phổi loại không phải tế bào nhỏ giai đoạn tiến triển tại chỗ hoặc di căn mà có đột biến hoạt hóa EGFR TK.
Liều lượng & Cách dùng
Việc điều trị với IRESSA nên được tiến hành và theo dõi bởi các bác sỹ có kinh nghiệm trong điều trị ung thư.
Liều khuyến cáo IRESSA là 1 viên 250 mg, ngày 1 lần. Nếu quên dùng 1 liều thuốc, nên uống ngay khi nhớ ra. Nếu việc quên uống thuốc dưới 12 giờ tính đến thời điểm dùng liều kế tiếp, bệnh nhân không nên dùng liều thuốc đã lỡ quên uống. Bệnh nhân không nên dùng liều gấp đôi (uống cùng lúc 2 liều thuốc) để bù cho liều đã quên uống.
Trẻ em: Độ an toàn và hiệu quả của IRESSA ở trẻ em và thiếu niên dưới 18 tuổi chưa được thiết lập. Chưa có sử dụng gefitinib trên trẻ em với chỉ định ung thư phổi loại không phải tế bào nhỏ.
Suy gan: Bệnh nhân suy gan trung bình đến nặng (Child Pugh B hoặc C) do xơ gan có tăng nồng độ gefitinib trong huyết tương. Nên theo dõi chặt chẽ các phản ứng ngoại ý ở các bệnh nhân này. Nồng độ trong huyết tương không tăng ở bệnh nhân có tăng aspartat transaminase (AST), alkalin phosphatase hoặc bilirubin do di căn gan (xem phần “Đặc tính dược động học”).
Suy thận: Không cần điều chỉnh liều ở bệnh nhân suy giảm chức năng thận có độ thanh thải creatinin >20 ml/phút. Có rất ít số liệu ở bệnh nhân có độ thanh thải creatinin ≤20 ml/phút và cần thận trọng khi sử dụng thuốc ở nhóm bệnh nhân này (xem phần “Đặc tính dược động học”).
Bệnh nhân cao tuổi: Không cần điều chỉnh liều dựa vào lứa tuổi của bệnh nhân (xem phần “Đặc tính dược lực học”).
Bệnh nhân có suy giảm enzym CYP2D6: Không có khuyến cáo chỉnh liều cụ thể ở bệnh nhân có kiểu gen chuyển hóa qua CYP2D6 giảm, nhưng ở các bệnh nhân này nên được theo dõi chặt chẽ các phản ứng ngoại ý (xem phần “Đặc tính dược lực học”).
Điều chỉnh liều khi có độc tính của thuốc: Bệnh nhân bị tiêu chảy hoặc có phản ứng ngoại ý trên da mà không dung nạp có thể được kiểm soát thành công khi ngưng dùng thuốc trong một thời gian ngắn (≤14 ngày) và sau đó dùng trở lại liều 250 mg (xem phần “Tác dụng ngoại ý”). Đối với bệnh nhân không thể dung nạp thuốc sau một đợt ngắt quãng điều trị, nên ngưng sử dụng gefitinib và cân nhắc phương pháp điều trị thay thế.
Cách dùng
Có thể uống thuốc trong hoặc ngoài bữa ăn, cùng một thời gian trong ngày. Thuốc có thể được nuốt nguyên viên cùng với một ít nước hoặc trường hợp không thể uống nguyên viên thuốc thì có thể phân tán viên thuốc trong nước. Nên thả viên thuốc trong nửa ly nước uống (không chứa carbonat). Không nên dùng chung với các thức uống khác. Không được nghiền viên thuốc, thả nguyên viên thuốc trong nửa ly nước. Khuấy đều cho đến khi viên thuốc phân tán hoàn toàn (khoảng 20 phút) và uống dịch thuốc ngay lập tức sau khi thuốc phân tán hoàn toàn (nghĩa là trong vòng 60 phút). Tráng ly với nửa ly nước và uống. Dịch thuốc phân tán cũng có thể được dùng qua ống thông mũi-dạ dày hoặc ống thông dạ dày.
Cảnh báo
Thận trọng: Khi xem xét sử dụng IRESSA để điều trị cho bệnh nhân ung thư phổi loại không phải tế bào nhỏ giai đoạn tiến triển hoặc di căn, khuyến cáo xét nghiệm đánh giá đột biến EGFR tại mô khối u cho tất cả các bệnh nhân. Nếu mẫu khối u không thể đánh giá được, thì có thể sử dụng mẫu DNA của khối u trong hệ tuần hoàn (ctDNA) thu thập từ mẫu máu (huyết tương). Chỉ dùng các phương pháp xét nghiệm có độ tái lặp, độ tin cậy, độ nhạy cùng với tiện ích đã được chứng minh về xác định tình trạng đột biến EGFR của khối u hay ctDNA để tránh kết quả âm tính giả hay dương tính giả (xem phần Đặc tính dược lực học).
Bệnh phổi mô kẽ (ILD)
Bệnh phổi mô kẽ, có thể khởi phát cấp tính, đã được quan sát thấy ở 1,3% bệnh nhân đang dùng gefitinib, và một vài trường hợp có thể bị tử vong (xem phần Tác dụng ngoại ý). Nếu bệnh nhân có biểu hiện xấu đi với các triệu chứng hô hấp như khó thở, ho và sốt, nên ngừng IRESSA và cho kiểm tra ngay. Nếu xác nhận chẩn đoán là bệnh phổi mô kẽ, nên ngưng dùng IRESSA và điều trị bệnh nhân bằng các biện pháp thích hợp.
Trong một nghiên cứu dược lý dịch tễ có đối chứng tại Nhật thực hiện trên 3159 bệnh nhân ung thư phổi loại không tế bào nhỏ (NSCLC) đã được theo dõi trong 12 tuần khi dùng gefitinib hoặc hóa trị, các yếu tố nguy cơ phát triển bệnh phổi mô kẽ (ILD) như sau đã được xác định (bất kể bệnh nhân dùng IRESSA hoặc hóa trị) là: hút thuốc, tình trạng thể chất kém (PS ≥2), giảm thể tích phổi bình thường có chứng cứ chụp cắt lớp CT (≤ 50%), mới được chẩn đoán NSCLC (<6 tháng), bệnh phổi mô kẽ (ILD) có sẵn trước, lớn tuổi (≥55 tuổi) và bệnh tim đồng thời. Đã ghi nhận gia tăng nguy cơ bệnh phổi mô kẽ ở nhóm dùng gefitinib so với hóa trị chủ yếu trong vòng 4 tuần đầu sử dụng (giá trị OR hiệu chỉnh 3,8; 95% Cl 1,9-7,7); sau đó nguy cơ tương đối thấp hơn (giá trị OR hiệu chỉnh 2,5; 95% Cl 1,1-5,8). Trong số bệnh nhân bị ILD ở cả 2 nhóm IRESSA và hóa trị thì nguy cơ tử vong cao ở nhóm bệnh nhân có các yếu tố nguy cơ sau: hút thuốc, giảm thể tích phổi bình thường có chứng cứ chụp cắt lớp CT (≤ 50%), bệnh phổi mô kẽ (ILD) có sẵn trước, lớn tuổi (≥65 tuổi) và các vùng dính liền với màng phổi quá rộng (≥ 50%).
Ngộ độc gan và suy giảm chức năng gan
Bất thường xét nghiệm chức năng gan (bao gồm tăng alanin aminotransferase, aspartat aminotransferase, bilirubin) đã được ghi nhận nhưng ít khi có biểu hiện viêm gan (xem phần ”Tác dụng ngoại ý”). Vài báo cáo riêng lẻ suy chức năng gan mà một số trường hợp dẫn đến tử vong. Vì vậy, bệnh nhân được khuyến cáo nên kiểm tra chức năng gan định kỳ. Gefitinib nên được dùng thận trọng trên bệnh nhân có thay đổi chức năng gan ở mức độ nhẹ hoặc trung bình. Cân nhắc ngưng sử dụng thuốc nếu các thay đổi là nghiêm trọng.
Suy giảm chức năng gan do xơ gan đã được ghi nhận là dẫn đến tăng nồng độ gefitinib trong huyết tương (xem phần “Đặc tính dược lực học”).
Tương tác với các thuốc khác
Các chất gây cảm ứng với hệ enzym CYP3A4 có thể làm tăng chuyển hóa gefitinib và giảm nồng độ gefitinib trong huyết tương. Vì vậy, khi phối hợp với các chất gây cảm ứng CYP3A4 (như phenytoin, carbamazepin, rifampicin, barbiturat hoặc chế phẩm từ dược liệu có chứa St John’s Wort/Hypericum perforatum) có thể làm giảm hiệu lực của thuốc và vì thế nên tránh sử dụng chung các thuốc này (xem phần Tương tác).
Ở các bệnh nhân có kiểu gen chuyển hóa qua CYP2D6 giảm, điều trị bằng thuốc ức chế mạnh CYP3A4 có thể dẫn đến tăng nồng độ của gefitinib trong huyết tương. Khi bắt đầu điều trị bằng thuốc ức chế CYP3A4, bệnh nhân cần được theo dõi chặt chẽ các phản ứng ngoại ý của gefitinib (xem phần "Tương tác").
Tăng INR (International Normalised Ratio) và/hoặc các biến cố xuất huyết đã được báo cáo ở một số bệnh nhân đang dùng warfarin (xem phần “Tương tác”). Nên thường xuyên theo dõi sự thay đổi về thời gian prothrombin (PT) hoặc INR ở bệnh nhân đang dùng warfarin.
Các thuốc làm tăng đáng kể và kéo dài độ pH dịch vị như thuốc ức chế bơm proton và thuốc đối kháng thụ thể H2 có thể làm giảm sinh khả dụng và nồng độ gefitinib trong huyết tương và vì thế có thể giảm hiệu lực của thuốc. Thuốc kháng acid nếu dùng thường xuyên gần thời điểm uống thuốc gefitinib có thể có tác động tương tự (xem phần “Tương tác” và “Đặc tính Dược động học”).
Dữ liệu từ các nghiên cứu lâm sàng pha II, khi dùng đồng thời gefitinib và vinorelbin cho thấy gefitinib có thể làm tăng tác động giảm bạch cầu trung tính của vinorelbin.
Lactose: IRESSA có chứa lactose. Bệnh nhân có vấn đề di truyền hiếm gặp kém dung nạp galactose, thiếu hụt Lapp lactose hoặc kém hấp thu glucose-galactose thì không nên dùng thuốc này.
Các thận trọng khác
Nên khuyên bệnh nhân khám bác sỹ ngay lập tức khi có tiêu chảy trầm trọng hoặc dai dẳng, buồn nôn, nôn hoặc biếng ăn mà có thể gián tiếp dẫn tới mất nước cơ thể. Các triệu chứng này có thể được xử trí theo bệnh cảnh lâm sàng (xem phần Tác dụng ngoại ý).
Bệnh nhân có các dấu hiệu và triệu chứng nghi ngờ viêm giác mạc như tình trạng cấp tính hay trầm trọng hơn: viêm mắt, tuyến lệ, mẫn cảm với ánh sáng, nhìn mờ, đau mắt và/hoặc đỏ mắt nên nhanh chóng tham vấn bác sĩ chuyên khoa mắt.
Nếu chẩn đoán đã xác định là viêm loét giác mạc, nên ngưng điều trị với gefitinib và nếu các triệu chứng không hết hẳn hoặc tái phát khi sử dụng lại gefitinib, cân nhắc ngưng sử dụng lâu dài gefitinib.
Trong một nghiên cứu pha I/II sử dụng gefitinib và xạ trị ở bệnh nhân nhi mới được chẩn đoán u thần kinh đệm cuống não (brain stem glioma) hoặc u thần kinh đệm ác tính trên lều đã được cắt bỏ không hoàn toàn (incompletely resected supratentorial malignant glioma), có 4 trường hợp xuất huyết ở hệ thần kinh trung ương (trong đó có 1 trường hợp tử vong) đã được ghi nhận trong 45 bệnh nhân tham gia nghiên cứu. Một trường hợp xuất huyết ở hệ thần kinh trung ương ở trẻ u màng não thất (ependymoma) cũng được ghi nhận trong thử nghiệm dùng gefitinib đơn thuần. Việc tăng nguy cơ xuất huyết não ở bệnh nhân trưởng thành bị ung thư phổi loại không phải tế bào nhỏ dùng IRESSA chưa được thiết lập.
Đã có ghi nhận thủng dạ dày ruột ở bệnh nhân dùng gefitinib. Trong đa số các trường hợp, điều này có liên quan đến các yếu tố nguy cơ đã biết khác, bao gồm tuổi cao, sử dụng đồng thời các thuốc khác như steroid, kháng viêm NSAID, bệnh nền loét dạ dày ruột, hút thuốc hoặc di căn ở ruột tại vị trí thủng.
Ảnh hưởng trên khả năng lái xe và vận hành máy móc: Đã có báo cáo về triệu chứng suy nhược trong khi điều trị bằng gefitinib. Do đó, các bệnh nhân có triệu chứng này nên thận trọng khi lái xe hoặc vận hành máy.
Quá Liều
Không có trị liệu đặc biệt trong trường hợp dùng quá liều gefitinib. Tuy nhiên, trong nghiên cứu lâm sàng pha I, một số ít bệnh nhân đã được điều trị bằng liều lên đến 1000 mg/ngày. Đã ghi nhận sự tăng tần suất và mức độ trầm trọng của một số phản ứng ngoại ý, chủ yếu là tiêu chảy và ban da. Các phản ứng ngoại ý do dùng quá liều nên được điều trị triệu chứng; đặc biệt tình trạng tiêu chảy nặng nên được điều trị theo chỉ định lâm sàng. Trong một nghiên cứu với số lượng giới hạn bệnh nhân được điều trị hàng tuần với liều từ 1500 mg đến 3500 mg. Trong nghiên cứu này, nồng độ và thời gian tiếp xúc với IRESSA không tăng cùng với liều, các phản ứng ngoại ý chủ yếu ở mức độ nhẹ đến trung bình và phù hợp với các dữ liệu an toàn thuốc IRESSA đã biết.
Chống chỉ định
Quá mẫn với hoạt chất hay tá dược.
Phụ nữ đang cho con bú.
Sử dụng ở phụ nữ có thai và cho con bú
Phụ nữ trong độ tuổi sinh sản: Khuyến cáo phụ nữ trong độ tuổi sinh sản không nên có thai trong quá trình điều trị với thuốc này.
Phụ nữ mang thai: Chưa có dữ liệu về việc dùng gefitinib cho phụ nữ có thai. Các nghiên cứu trên động vật đã chứng tỏ thuốc có độc tính trên hệ sinh sản. Chưa biết khả năng nguy cơ đối với con người. Không nên dùng IRESSA trong thai kỳ trừ khi thật sự rất cần thiết.
Phụ nữ đang cho con bú: Hiện vẫn chưa biết liệu gefitinib có bài tiết qua sữa ở người hay không. Gefitinib và các chất chuyển hóa của gefitinib đi vào sữa của chuột thí nghiệm. Chống chỉ định dùng gefitinib trong khi đang cho con bú và vì thế phụ nữ đang cho con bú phải ngưng cho con bú trong khi điều trị bằng IRESSA (xem phần ”Chống chỉ định”).
Tương tác
Gefitinib chuyển hóa qua cytochrom P450, chủ yếu là isoenzym CYP3A4 và qua CYP2D6.
Các thuốc có thể làm tăng nồng độ gefitinib trong máu
Các nghiên cứu in-vitro cho thấy gefitinib là một chất nền của glycoprotein. Các dữ liệu hiện nay không có chỉ ra bất kỳ mối liên quan lâm sàng với phát hiện in-vitro này.
Các thuốc ức chế CYP3A4 có thể làm giảm độ thanh thải của gefitinib. Sử dụng đồng thời với các thuốc ức chế mạnh hoạt động của CYP3A4 (như ketoconazol, posaconazol, voriconazol, thuốc ức chế enzym protease, clarithromycin, telithromycin) có thể làm tăng nồng độ gefitinib trong huyết tương. Sự gia tăng này có thể có ý nghĩa về mặt lâm sàng vì đã ghi nhận các phản ứng ngoại ý liên quan đến liều và nồng độ thuốc trong cơ thể.
Sự gia tăng này có thể cao hơn ở cá thể bệnh nhân có kiểu gen chuyển hóa qua CYP2D6 giảm. Điều trị trước với itraconazol (một thuốc ức chế CYP3A4 mạnh) đã làm tăng 80% trị số AUC trung bình của gefitinib ở người tình nguyện khoẻ mạnh. Nếu dùng đồng thời với thuốc ức chế CYP3A4, nên theo dõi chặt chẽ các phản ứng ngoại ý của gefitinib.
Chưa có dữ liệu về việc điều trị đồng thời với thuốc ức chế CYP2D6 nhưng các thuốc ức chế mạnh enzym này có thể làm tăng nồng độ gefitinib trong huyết tương khoảng 2 lần ở các bệnh nhân có chuyển hóa mạnh qua CYP2D6. Nếu dùng đồng thời với thuốc ức chế mạnh CYP2D6, nên theo dõi chặt chẽ các phản ứng ngoại ý trên bệnh nhân.
Các thuốc làm giảm nồng độ gefitinib trong huyết tương
Các thuốc cảm ứng CYP3A4 có thể làm tăng chuyển hóa và làm giảm nồng độ gefitinib trong huyết tương và vì thế làm giảm hiệu lực của gefitinib. Nên tránh sử dụng đồng thời với các thuốc cảm ứng CYP3A4 (như phenytoin, carbamazepin, rifampicin, barbiturat hoặc cỏ St John's wort (Hypericum perforatum)). Điều trị trước với rifampicin (thuốc cảm ứng CYP3A4 mạnh) ở người tình nguyện khỏe mạnh làm giảm khoảng 83% trị số AUC trung bình (xem phần “Cảnh báo'').
Các thuốc làm tăng đáng kể nồng độ pH dịch vị có thể làm giảm nồng độ gefitinib trong huyết tương và vì thế làm giảm hiệu lực của gefitinib. Liều cao các thuốc kháng acid tác động ngắn có thể có tác động tương tự nếu dùng thường xuyên sát thời điểm dùng gefitinib. Dùng đồng thời gefitinib với ranitidin ở mức liều làm tăng kéo dài pH dịch vị ≥5 dẫn đến giảm khoảng 47% trị số AUC trung bình ở người tình nguyện khỏe mạnh (xem phần “Cảnh báo” và “Đặc tính dược lực”).
Các thuốc bị thay đổi nồng độ trong huyết tương do ảnh hưởng của gefitinib
Các nghiên cứu in-vitro cho thấy gefitinib ít có khả năng ức chế CYP2D6. Trong một thử nghiệm lâm sàng, gefitinib được dùng đồng thời với metoprolol (một chất nền của CYP2D6). Điều này làm tăng 35% nồng độ và thời gian tiếp xúc với metoprolol. Việc gia tăng này có ý nghĩa với các chất nền CYP2D6 có chỉ số điều trị hẹp. Cân nhắc khi sử dụng các chất nền CYP2D6 phối hợp với gefitinib, cần điều chỉnh liều của chất nền CYP2D6, đặc biệt là các thuốc có cửa sổ trị liệu hẹp.
Gefitinib ức chế protein vận chuyển BCRP in-vitro, nhưng vẫn chưa rõ các mối liên quan trên lâm sàng với phát hiện này.
Các khả năng tương tác khác: Tăng INR và/hoặc các biến cố xuất huyết đã được báo cáo ở một vài bệnh nhân dùng warfarin (xem phần “Cảnh báo”).
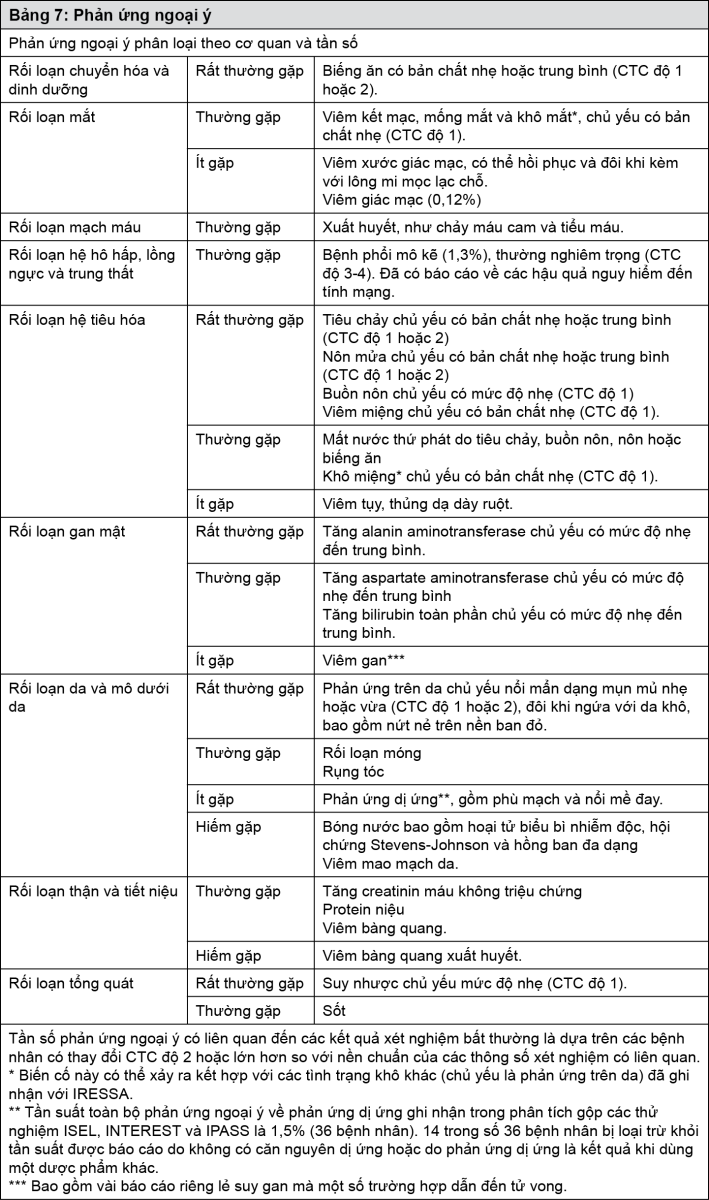
Tác dụng ngoại ý
Tóm tắt dữ liệu an toàn thuốc
Dữ liệu gộp từ các thử nghiệm lâm sàng pha III như ISEL, INTEREST và IPASS (thực hiện trên 2462 bệnh nhân điều trị với IRESSA), các phản ứng ngoại ý do thuốc (ADR) thông thường nhất được ghi nhận xảy ra trên > 20% bệnh nhân là tiêu chảy và phản ứng trên da (bao gồm nổi mẩn, mụn, da khô và ngứa). Các phản ứng ngoại ý do thuốc thường xuất hiện trong tháng đầu điều trị và nói chung có thể tự hết. Khoảng 8% bệnh nhân có phản ứng ngoại ý trầm trọng (độ 3 và 4 theo Tiêu chuẩn Đánh giá Độc tính Thường gặp - CTC: Common Toxicity Criteria). Tuy nhiên, chỉ có 3% bệnh nhân là phải ngưng điều trị do phản ứng ngoại ý.
Bệnh phổi mô kẽ (ILD) xảy ra ở 1,3% bệnh nhân, thường gặp mức độ nghiêm trọng (độ 3-4 theo theo Tiêu chuẩn Đánh giá Độc tính Thường gặp). Cũng có ghi nhận hậu quả là tử vong.
Bảng phân loại phản ứng ngoại ý
Dữ liệu an toàn thuốc trình bày trong Bảng 7 được dựa trên các chương trình phát triển lâm sàng của gefitinib. Phản ứng ngoại ý được sắp xếp theo cột tần số ở Bảng 7 nếu có thể dựa trên tỷ lệ các báo cáo phản ứng ngoại ý có thể so sánh được trong dữ liệu gộp từ các thử nghiệm lâm sàng pha III như ISEL, INTEREST và IPASS (trên 2462 bệnh nhân điều trị với IRESSA).
Tần số xảy ra các phản ứng ngoại ý được xác định như sau: rất thường gặp (≥1/10); thường gặp (>1/100 - <1/10); ít gặp (≥1/1.000 - <1/100); hiếm gặp (≥1/10.000 - <1/1.000); rất hiếm gặp (<1/10.000), chưa biết (không thể dự đoán từ các dữ liệu sẵn có).
Trong mỗi nhóm phân loại, các phản ứng ngoại ý được sắp xếp theo trình tự mức độ giảm dần.
- xem Bảng 7.
Bệnh phổi mô kẽ (ILD)
Trong nghiên cứu lâm sàng INTEREST, tỷ lệ các loại phản ứng ngoại ý là 1,4% (10) bệnh nhân trong nhóm gefitinib so với 1,1% (8) bệnh nhân trong nhóm docetaxel. Một phản ứng ngoại ý loại bệnh phổi mô kẽ gây tử vong và đã xảy ra ở một bệnh nhân thuộc nhóm gefitinib.
Trong nghiên cứu lâm sàng ISEL, tần suất biến cố loại ILD ở toàn bộ bệnh nhân là tương tự nhau và khoảng 1% ở cả 2 nhánh điều trị. Đa số biến cố loại ILD ghi nhận là ở bệnh nhân thuộc chủng tộc Châu Á và tần suất xảy ra ILD giữa nhóm bệnh nhân Châu Á điều trị bằng IRESSA và nhóm dùng giả dược là khoảng 3% và 4 % theo thứ tự tương ứng. Có 1 bệnh nhân thuộc nhóm dùng giả dược có biến cố ILD tử vong.
Trong một nghiên cứu theo dõi sau khi đưa thuốc ra thị trường tại Nhật (3350 bệnh nhân), tỷ lệ biến cố loại ILD được ghi nhận ở bệnh nhân dùng gefitinib là 5,8%. Tỷ lệ của các phản ứng ngoại ý loại ILD bị tử vong là 38,6%.
Trong thử nghiệm lâm sàng nhãn mở pha III (IPASS) trên 1217 bệnh nhân so sánh IRESSA với hóa trị liệu 2 thuốc carboplatin/paclitaxel như là điều trị bước đầu ở những bệnh nhân ung thư phổi không phải tế bào nhỏ giai đoạn tiến triển tại châu Á, tỷ lệ biến cố loại ILD là 2,6% ở nhóm điều trị với IRESSA so với 1,4% ở nhóm điều trị với carboplatin/paclitaxel.
Bảo quản
Không bảo quản quá 30oC. Bảo quản trong bao bì gốc.
Phân loại ATC
L01XE02
Trình bày/Đóng gói
Viên nén bao phim: hộp 3 vỉ x 10 viên.
- Abacavir
- Abernil
- Abiiogran
- Acarbose
- ACC
- Acebutolol
- Acenocoumarol
- Acetate Ringer's
- Acetazolamide
- Acetylcystein
- Acetylsalicylic acid
- Aciclovir
- Acid acetylsalicylic
- Acid aminocaproic
- Acid ascorbic
- Acid boric
- Acid chenodeoxycholic
- Acid ethacrynic
- Acid folic
- Acid fusidic
- Acid iopanoic
- Acid ioxaglic
- Acid nalidixic
- Acid pantothenic
- Acid para-aminobenzoic
- Acid salicylic
- Acid tranexamic
- Acid valproic
- Acid zoledronic
- Acitretin
- Aclasta
- Aclon
- Actapulgite
- Actelsar
- Actelsar HCT
- Actemra
- Actilyse
- Acular
- Acupan
- Acuvail
- Acyclovir STADA
- Acyclovir STADA Cream
- Adalat
- Adenosin
- Adenosin Ebewe
- Adipiodon
- Advagraf
- Aerius
- Afinitor
- Agicarvir
- Agifovir-E
- Agilosart
- Agilosart-H
- Agimepzol
- Agimosarid
- Agimstan
- Agimstan-H
- Agiremid
- Agivastar
- Aibezym
- Air-X
- Alaxan
- Albendazol
- Albiomin
- Albumin
- Albumin người Grifols 20%
- Albuminar
- AlbuRx
- Albutein
- Alcuronium chloride
- Aldesleukin
- Alendronat
- Alertin
- Alfa-Lipogamma 600 Oral
- Alfuzosin hydrochlorid
- Algotra
- Alimemazin
- Alimta
- Allipem
- Allopurinol
- Allopurinol STADA
- Aloxi
- Alprazolam
- Alpha Chymotrypsin
- Alpha tocopherol
- Alphachymotrypsin Glomed
- Alphagan-P
- Aluvia
- Alzental
- Amaryl
- Ambroco
- Ambroxol
- Amcinol-Paste
- Amigold
- Amikacin
- Aminocaproic acid
- Aminoleban
- Aminoleban Oral
- Aminosteril N-Hepa
- Amiparen
- Amitriptyline
- Amiyu
- Amlodipine
- Amlor
- Amoxicillin
- Amoxicillin & clavulanate
- Ampicillin
- Amquitaz
- Anaferon for children
- Anargil
- Anaropin
- Andriol Testocaps
- Anepzil
- Anyfen
- Apaisac
- Apidra SoloStar
- Apitim 5
- Aprovel
- Aquaphil
- Arcalion
- Arcoxia
- Aricept Evess
- Arimidex
- Arnetine
- Artrodar
- A-Scabs
- Ascorbic acid
- Asperlican/Candinazol
- Aspilets EC
- Aspirin
- Asthmatin
- Atelec
- Atocib 120
- Atocib 90
- Atosiban PharmIdea
- Atozet
- Attapulgite
- Atussin
- Atropin
- Augbactam
- Augmentin Sachet
- Augmentin SR
- Augmentin Tablets
- Augmex
- Avamys
- Avastin
- Avelox Dịch truyền
- Avelox Viên nén
- Avodart
- Axcel Cefaclor-125 Suspension
- Axcel Cetirizine Syrup
- Axcel Chlorpheniramine
- Axcel Dexchlorpheniramine
- Axcel Dicyclomine-S Syrup
- Axcel Diphenhydramine Paediatric Syrup
- Axcel Erythromycin ES
- Axcel Eviline
- Axcel Fungicort Cream
- Axcel Fusidic acid Cream
- Axcel Fusidic acid-B Cream
- Axcel Hydrocortisone Cream
- Axcel Lignocaine 2% Sterile Gel
- Axcel Loratadine
- Axcel Miconazole Cream
- Axcel Paracetamol
- Axcel Urea Cream
- Axitan
- Azenmarol
- Azicine
- Aziphar
- Azithromycin





