Nhà sản xuất
Novartis Pharma
Thành phần
Mỗi lọ: Secukinumab 150mg.
Tá dược: Đường sucrose, L-histidine, L-histidine hydrochloride monohydrate, polysorbate 80.
Mô tả
Secukinumab là một kháng thể đơn dòng tái tổ hợp chọn lọc cho interleukin-17A. Secukinumab là IgG1/lớp k, do tế bào buồng trứng của giống chuột lang Trung Quốc tiết ra.
Dược lực học
Nhóm thuốc điều trị: chất ức chế miễn dịch, ức chế interleukin, mã ATC: L04AC10.
Cơ chế hoạt động
Secukinumab là kháng thể đơn dòng IgG1/k hoàn toàn người, gắn chọn lọc và làm trung hòa cytokine tiền viêm interleukin-17A (IL-17A). Secukinumab hoạt động nhắm vào IL-17A và ức chế tác động của IL-17A với receptor IL-17 (receptor bộc lộ ở một số loại tế bào khác nhau trong đó có tế bào sừng). Từ đó, secukinumab ức chế sự giải phóng các cytokine tiền viêm, chemokine và các chất trung gian của các mô bị tổn thương, làm giảm sự tham gia qua trung gian IL-17A trong các bệnh tự miễn và viêm. Một lượng secukinumab phù hợp về lâm sàng đi đến da và làm giảm các marker viêm tại chỗ. Secukinumab làm giảm các dát đỏ, giảm thâm nhiễm và bong vảy ở các tổn thương vẩy nến mảng là kết quả trực tiếp của điều trị.
IL-17A là một cytokine tự nhiên có tác động lên đáp ứng viêm và miễn dịch bình thường. IL-17A đóng vai trò chủ chốt trong sinh bệnh học của vảy nến thể mảng, viêm khớp vảy nến và viêm cột sống dính khớp và được điều chỉnh tăng lên trên da có thương tổn so với vùng da lành của bệnh nhân vảy nến thể mảng và trong dịch khớp của bệnh nhân viêm khớp vảy nến. Số lượng tế bào sản sinh IL-17 cũng cao hơn một cách có ý nghĩa trong vùng tủy xương dưới sụn khớp của các khớp liên mỏm bên của cột sống trên bệnh nhân viêm cột sống dính khớp.
Tác động về dược lực học
Ở những bệnh nhân điều trị bằng secukinumab, nồng độ IL-17A toàn phần trong huyết thanh (IL-17A tự do và IL-17A gắn secukinumab) ban đầu tăng. Sau đó giảm chậm do giảm sự thanh thải IL-17A gắn secukinumab, điều này cho thấy secukinumab bắt giữ có chọn lọc các IL-17A tự do đóng vai trò chủ chốt trong sinh bệnh học của vảy nến thể mảng.
Trong một nghiên cứu về secukinumab, có hiện tượng tăng sự xâm nhập vào thượng bì các bạch cầu đa nhân trung tính và một số các marker liên quan bạch cầu đa nhân trung tính ở tổn thương da của bệnh nhân vảy nến thể mảng, nhưng sau một đến hai tuần điều trị thì giảm rõ rệt.
Secukinumab làm giảm (trong vòng 1 đến 2 tuần điều trị) nồng độ C-reactive protein, là một dấu chỉ tình trạng viêm.
Hiệu quả lâm sàng và tính an toàn
Vảy nến thể mảng
Tính an toàn và hiệu quả lâm sàng của secukinumab được đánh giá trong 4 nghiên cứu pha III, ngẫu nhiên, mù đôi, đối chứng giả dược ở các bệnh nhân vảy nến thể mảng mức độ trung bình đến nặng có chỉ định quang trị liệu hoặc điều trị toàn thân (ERASURE, FIXTURE, FEATURE, JUNCTURE). Hiệu quả và tính an toàn của secukinumab 150 mg và 300 mg được đánh giá so sánh hoặc với giả dược hoặc với Etanercept. Hơn nữa, một nghiên cứu đánh giá phác đồ điều trị kéo dài so với phác đồ “điều trị lại khi cần” (SCULPTURE) cũng đã được thực hiện.
Trong 2.403 bệnh nhân đã được đưa vào nghiên cứu đối chứng giả dược, 79% chưa được điều trị các chất sinh học, 45% thất bại với các thuốc không thuộc nhóm sinh học và 8% thất bại với điều trị bằng các chất sinh học (6% thất bại với kháng TNF và 2% thất bại với kháng p40). Khoảng 15-25% bệnh nhân trong các nghiên cứu pha III đã bị viêm khớp vảy nến ngay thời điểm bắt đầu tham gia nghiên cứu.
Nghiên cứu thứ 1 trên bệnh vảy nến (ERASURE) đánh giá 738 bệnh nhân. Các bệnh nhân được chọn ngẫu nhiên, điều trị với secukinumab liều 150 mg hoặc 300 mg ở tuần 0, 1, 2 và 3, sau đó dùng cùng một liều hằng tháng kể từ tuần thứ 4. Nghiên cứu thứ 2 trên bệnh vảy nến (FIXTURE) gồm 1.306 bệnh nhân. Các bệnh nhân được chọn ngẫu nhiên, điều trị với secukinumab liều 150 mg hoặc 300 mg ở tuần 0, 1, 2 và 3, sau đó dùng cùng một liều hằng tháng từ tuần thứ 4. Bệnh nhân được lựa chọn ngẫu nhiên điều trị bằng Etanercept với liều 50 mg hai lần mỗi tuần trong 12 tuần, sau đó là 50 mg mỗi tuần. Trong cả nghiên cứu 1 và 2, bệnh nhân được chọn ngẫu nhiên điều trị bằng giả dược nếu không đáp ứng ở tuần điều trị thứ 12 sẽ được chuyển sang điều trị bằng secukinumab (150 mg hoặc 300 mg) ở các tuần 12, 13, 14 và 15, sau đó dùng cùng một liều hằng tháng từ tuần 16. Tất cả các bệnh nhân đều được theo dõi đến 52 tuần sau lần điều trị đầu tiên của nghiên cứu.
Nghiên cứu thứ 3 (FEATURE) trên 177 bệnh nhân sử dụng bơm tiêm nạp sẵn thuốc so với giả dược sau 12 tuần điều trị, đánh giá tính an toàn, mức độ dung nạp được thuốc và tính tiện lợi của việc tự tiêm thuốc secukinumab bằng bơm tiêm nạp sẵn. Nghiên cứu thứ 4 trên 182 bệnh nhân vảy nến (JUNCTURE) dùng bút tiêm nạp sẵn so với giả dược sau 12 tuần điều trị, đánh giá tính an toàn, mức độ dung nạp được thuốc, tính tiện lợi của việc tự sử dụng secukinumab bút tiêm nạp sẵn. Trong cả nghiên cứu 3 và 4, bệnh nhân được xếp ngẫu nhiên điều trị secukinumab với liều 150 mg hoặc 300 mg ở các tuần 0, 1, 2 và 3, sau đó dùng cùng liều mỗi tháng từ tuần thứ 4. Các bệnh nhân cũng được xếp ngẫu nhiên để điều trị bằng giả dược ở tuần 0, 1, 2 và 3, sau đó dùng cùng liều mỗi tháng từ tuần thứ 4.
Nghiên cứu thứ 5 trên 966 bệnh nhân vảy nến (SCULPTURE). Tất cả bệnh nhân điều trị bằng secukinumab với liều 150 đến 300 mg ở các tuần 0, 1, 2, 3, 4, 8 và 12, sau đó được xếp ngẫu nhiên để điều trị theo phác đồ duy trì cùng liều hằng tháng hoặc theo phác đồ điều trị lại khi cần thiết. Những bệnh nhân được điều trị ngẫu nhiên theo phác đồ “dùng thuốc lại khi cần” đã không đạt được đáp ứng ổn định, do đó phác đồ duy trì liều cố định hằng tháng được khuyến cáo sử dụng.
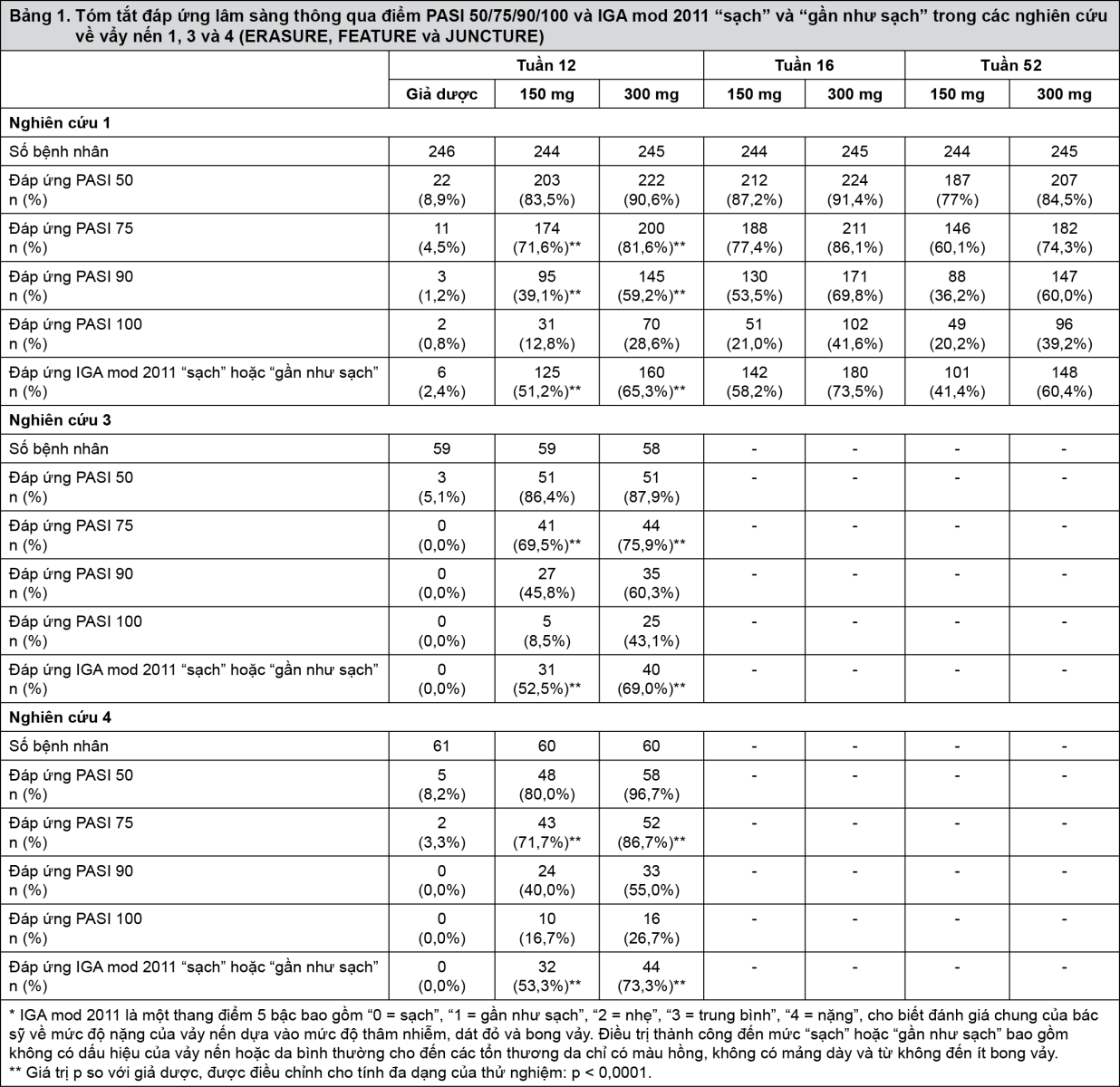
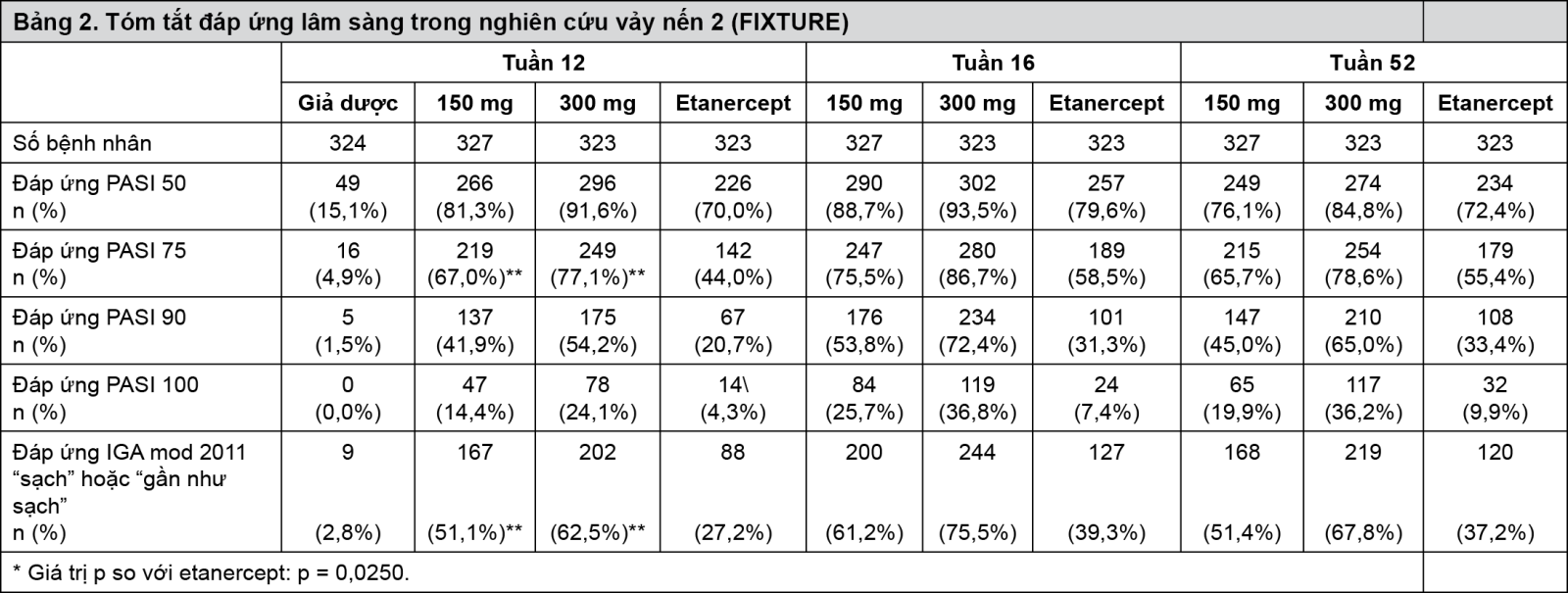
Các đồng tiêu chí nghiên cứu của các nghiên cứu có đối chứng giả dược và đối chứng với hoạt chất là tỷ lệ các bệnh nhân đạt được đáp ứng PASI 75 và đáp ứng IGA mod 2011 “sạch” hoặc “hầu như sạch” so với giả dược ở tuần thứ 12 (xem bảng 1 và 2). Liều 300 mg đem lại kết quả sạch tổn thương da tốt hơn, đặc biệt ở mức độ “sạch” hoặc “hầu như sạch” thông qua các thời điểm đánh giá hiệu quả về đáp ứng PASI 90, PASI 100 và đáp ứng IGA mod 2011 0 hoặc 1 trong tất cả các nghiên cứu với hiệu quả cao nhất thấy được ở tuần thứ 16. Vì vậy, đây là liều dùng được khuyến cáo.
- xem Bảng 1 & Bảng 2.
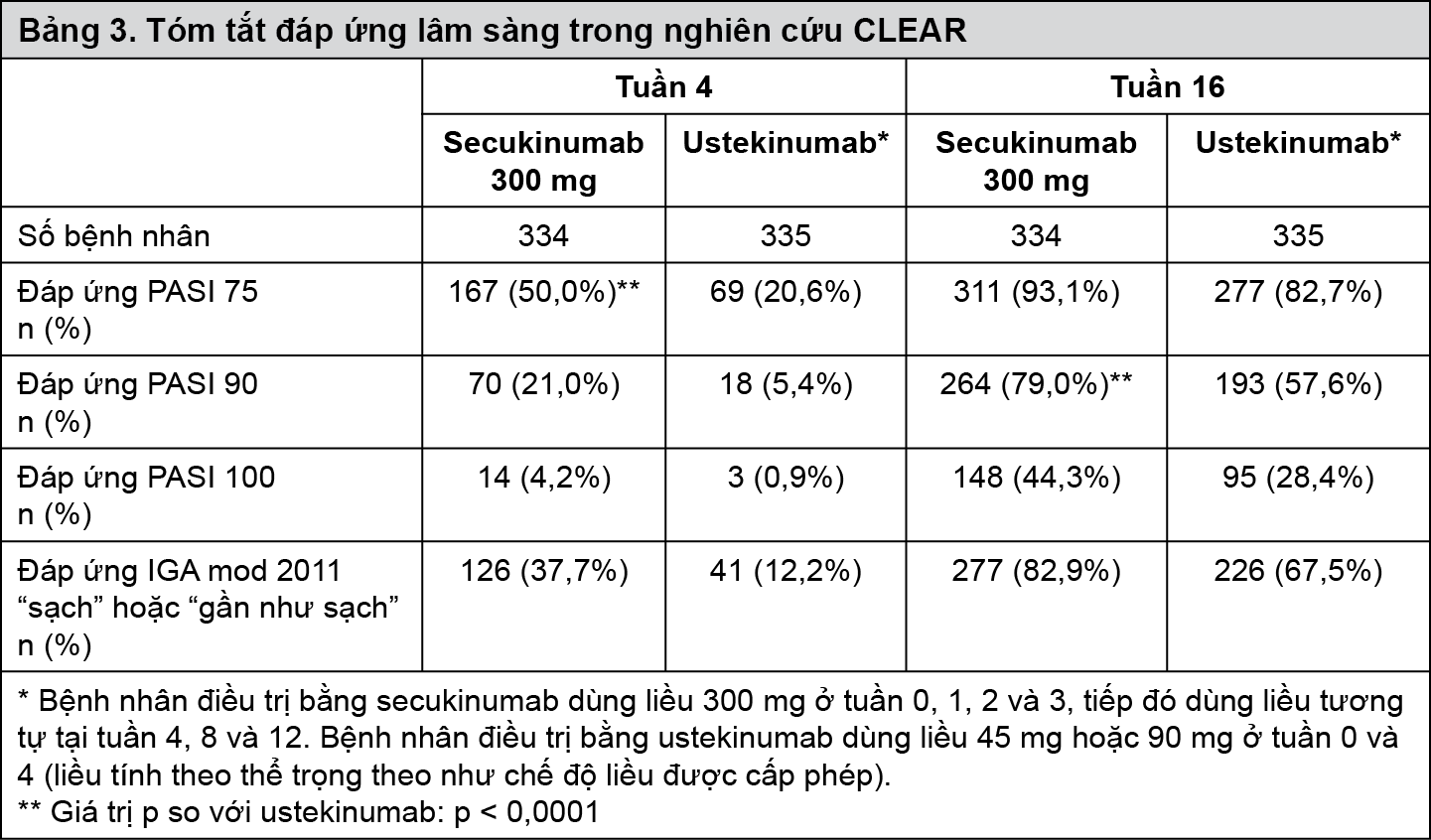
Trong một nghiên cứu lâm sàng bổ sung (CLEAR), 676 bệnh nhân đã được đánh giá. Secukinumab 300 mg đã đạt được các tiêu chí đánh giá chính và phụ bởi tác dụng vượt trội so với ustekinumab dựa trên đáp ứng PASI 90 ở tuần 16 và tiêu chí tốc độ đạt được PASI 75 ở tuần 4. Hiệu quả cao hơn của secukinumab so với ustekinumab trên các tiêu chí đánh giá PASI 75/90/100 và đáp ứng IGA mod 2011 ở điểm 0 hoặc 1 (“sạch” hoặc “gần như sạch”) đã được nhận thấy sớm và liên tục cho đến tuần 16.
- xem Bảng 3.
Secukinumab có hiệu quả ở những bệnh nhân chưa từng được điều trị toàn thân, chưa từng được điều trị các thuốc sinh học, đã từng điều trị bằng thuốc sinh học/kháng TNF và bệnh nhân thất bại với thuốc sinh học/kháng TNF. Sự cải thiện PASI 75 ở những bệnh nhân bị đồng thời viêm khớp vẩy nến là tương đương với những bệnh nhân vảy nến thể mảng nói chung.
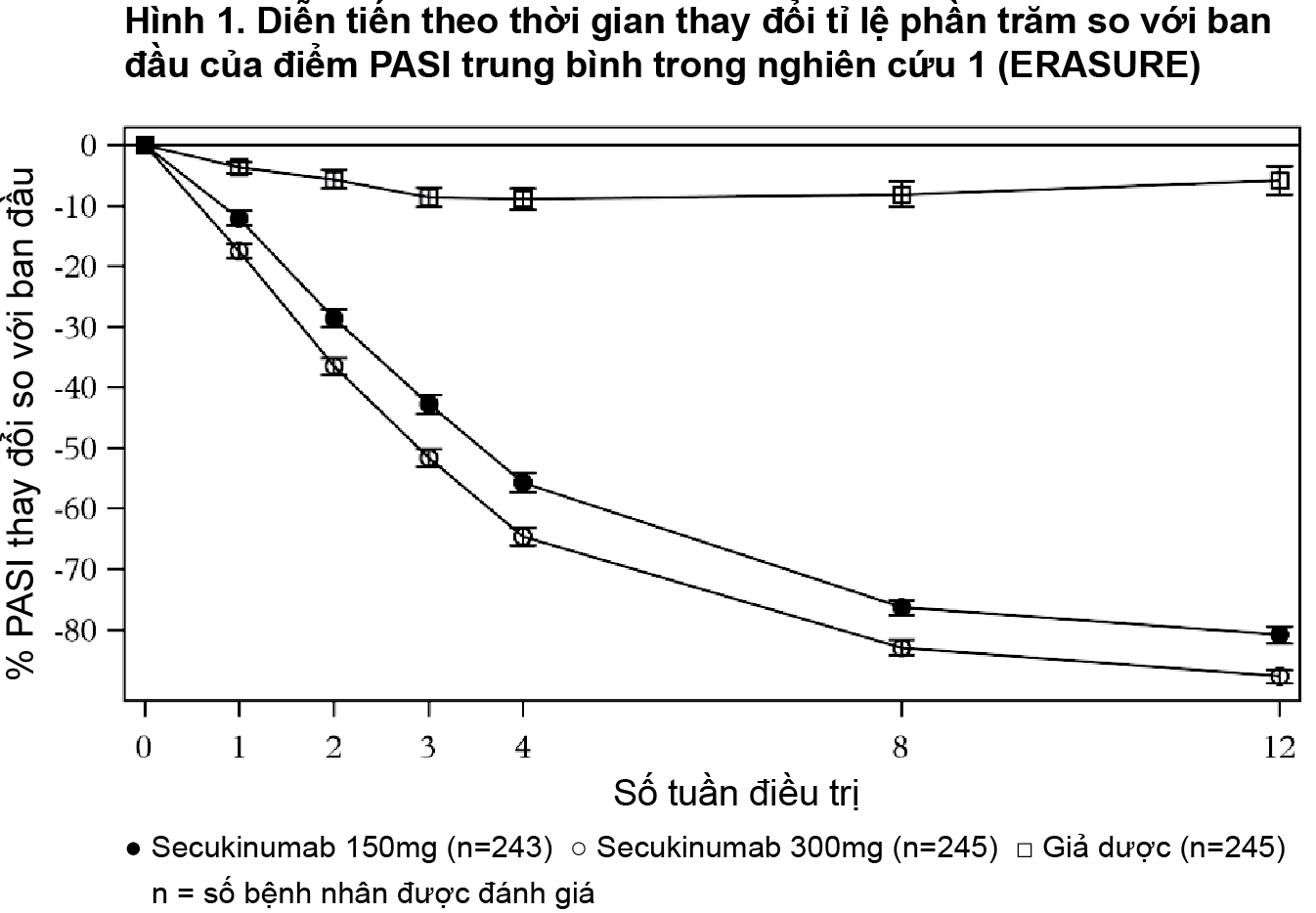
Secukinumab đạt hiệu quả nhanh, giảm 50% điểm PASI trung bình trong 3 tuần với liều 300 mg.
- xem Hình 1.
Các vị trí/dạng đặc trưng của vảy nến thể mảng: Trong hai nghiên cứu lâm sàng bổ sung, đối chứng giả dược, sự cải thiện được ghi nhận ở cả vảy nến móng (TRANSFIGURE, 198 bệnh nhân) và vảy nến thể mảng lòng bàn tay – bàn chân (GESTURE, 205 bệnh nhân). Trong nghiên cứu TRANSFIGURE, secukinumab vượt trội hơn giả dược ở tuần 16 (46,1% với liều 300 mg, 38,4% với liều 150 mg và 11,7% đối với giả dược) như đã được đánh giá bởi sự cải thiện đáng kể so với lúc ban đầu về chỉ số mức độ nặng của vảy nến móng (NAPSI %) ở các bệnh nhân vảy nến thể mảng từ trung bình đến nặng có bao gồm vảy nến móng. Trong nghiên cứu GESTURE, secukinumab vượt trội so với giả dược ở tuần 16 (33,3% với liều 300 mg, 22,1% với liều 150 mg và 1,5% với giả dược) như đã được đánh giá bởi sự cải thiện đáng kể của đáp ứng ppIGA 0 hoặc 1 (“sạch” hoặc “gần như sạch”) ở các bệnh nhân vảy nến thể mảng lòng bàn tay – bàn chân mức độ trung bình đến nặng.
Kết quả chất lượng cuộc sống/kết quả do bệnh nhân ghi nhận
Những cải thiện so với ban đầu ở tuần thứ 12 (nghiên cứu 1-4) so với nhóm dùng giả dược có sự khác biệt có ý nghĩa thống kê, qua điểm đánh giá chất lượng cuộc sống của bệnh nhân da liễu (DLQI - Dermatology Life Quality Index). Số điểm DLQI giảm (sự cải thiện) trung bình so với ban đầu trong khoảng từ -10,4 đến -11,6 với liều secukinumab 300mg, từ -7,7 đến -10,1 với liều secukinumab 150mg, so với -1,1 đến -1,9 khi dùng giả dược, ở tuần thứ 12. Sự cải thiện này được duy trì trong 52 tuần (nghiên cứu 1 và 2).
Bốn mươi phần trăm những người tham gia nghiên cứu 1 và 2 hoàn thành đầy đủ sổ nhật ký điều trị. Trong nhóm bệnh nhân hoàn thành nhật ký điều trị của mỗi nghiên cứu nói trên, sự cải thiện đáng kể có ý nghĩa thống kê ở tuần 12 so với ban đầu về các dấu hiệu và triệu chứng ngứa, đau, bong vảy do bệnh nhân tự ghi nhận đã được chứng minh.
Viêm khớp vảy nến
Tính an toàn và hiệu quả của secukinumab đã được đánh giá trong 2 thử nghiệm pha III ngẫu nhiên, mù đôi, đối chứng giả dược trên 1.003 bệnh nhân viêm khớp vảy nến giai đoạn hoạt tính (≥3 khớp sưng và ≥3 khớp đau) bất chấp trị liệu bằng thuốc kháng viêm không steroids NSAIDS, corticosteroid, các thuốc chống thấp khớp thay đổi được bệnh (disease-modifying anti-rheumatic drug - DMARD). Các bệnh nhân với các dạng khác nhau của viêm khớp vảy nến được tham gia trong các nghiên cứu này, bao gồm viêm đa khớp không có dấu hiệu của nốt thấp, viêm đốt sống với viêm khớp ngoại biên, viêm khớp ngoại biên không đối xứng, có bao gồm liên khớp xa ngón tay và viêm khớp biến dạng nặng. Bệnh nhân tham gia các nghiên cứu này được chẩn đoán viêm khớp vảy nến trong thời gian trung bình từ 3,9 đến 5,3 năm. Hầu hết bệnh nhân đều có cả tổn thương da do vảy nến hoạt tính hoặc tiền sử bệnh vảy nến. Hơn 62% bệnh nhân viêm khớp vảy nến bị viêm gân bám đầu xương và 47% bị viêm các khớp đầu chi lúc bắt đầu nghiên cứu. Trong cả 2 nghiên cứu, tiêu chí đánh giá chính là đáp ứng ACR 20 (American College of Rheumatology – Hội Thấp khớp học Hoa Kỳ) vào tuần thứ 24.
Có 29% bệnh nhân trong nghiên cứu viêm khớp vảy nến 1 (PsA1 Study) và 35% bệnh nhân trong nghiên cứu viêm khớp vảy nến 2 (PsA2 Study) đã được điều trị bằng chất kháng TNFα trước đó nhưng đã ngưng dùng thuốc này vì không hiệu quả hoặc không dung nạp (bệnh nhân đáp ứng không hoàn toàn với kháng TNFα).
Nghiên cứu viêm khớp vảy nến 1 (FUTURE 1) đã đánh giá 606 bệnh nhân, trong đó 60,7% trường hợp dùng đồng thời MTX. Bệnh nhân được phân nhóm ngẫu nhiên sử dụng secukinumab 10 mg/kg, tiêm tĩnh mạch vào tuần 0, 2, và 4, sau đó tiêm dưới da 75 mg hoặc 150 mg mỗi tháng bắt đầu từ tuần thứ 8. Những bệnh nhân được phân ngẫu nhiên vào nhóm giả dược mà không có đáp ứng vào tuần thứ 16 (trợ giúp sớm) và những bệnh nhân khác của nhóm giả dược ở tuần 24 sẽ chuyển sang dùng secukinumab (75 mg hoặc 150 mg), sau đó mỗi tháng dùng tiếp cùng liều.
Nghiên cứu viêm khớp vảy nến 2 (FUTURE 2) đã đánh giá 397 bệnh nhân, trong đó 46,6% trường hợp dùng đồng thời MTX. Bệnh nhân được phân nhóm ngẫu nhiên sử dụng secukinumab 75 mg, 150 mg hoặc 300 mg tiêm dưới da vào tuần 0, 1, 2 và 3, sau đó mỗi tháng dùng cùng liều bắt đầu từ tuần thứ 4. Những bệnh nhân được phân ngẫu nhiên vào nhóm giả dược nhưng không đáp ứng vào tuần thứ 16 (trợ giúp sớm) sẽ chuyển sang dùng secukinumab (150 mg hoặc 300 mg) bắt đầu từ tuần thứ 16, sau đó mỗi tháng dùng tiếp cùng liều. Những bệnh nhân được phân ngẫu nhiên vào nhóm giả dược nhưng có đáp ứng vào tuần thứ 16 sẽ chuyển sang dùng secukinumab (150 mg hoặc 300 mg) bắt đầu từ tuần thứ 24, sau đó mỗi tháng dùng tiếp cùng liều.
Dấu hiệu và triệu chứng
Điều trị bằng secukinumab dẫn đến những cải thiện có ý nghĩa về hoạt động của bệnh so với nhóm bệnh nhân giả dược ở tuần thứ 24 (Bảng 4).
- xem Bảng 4.
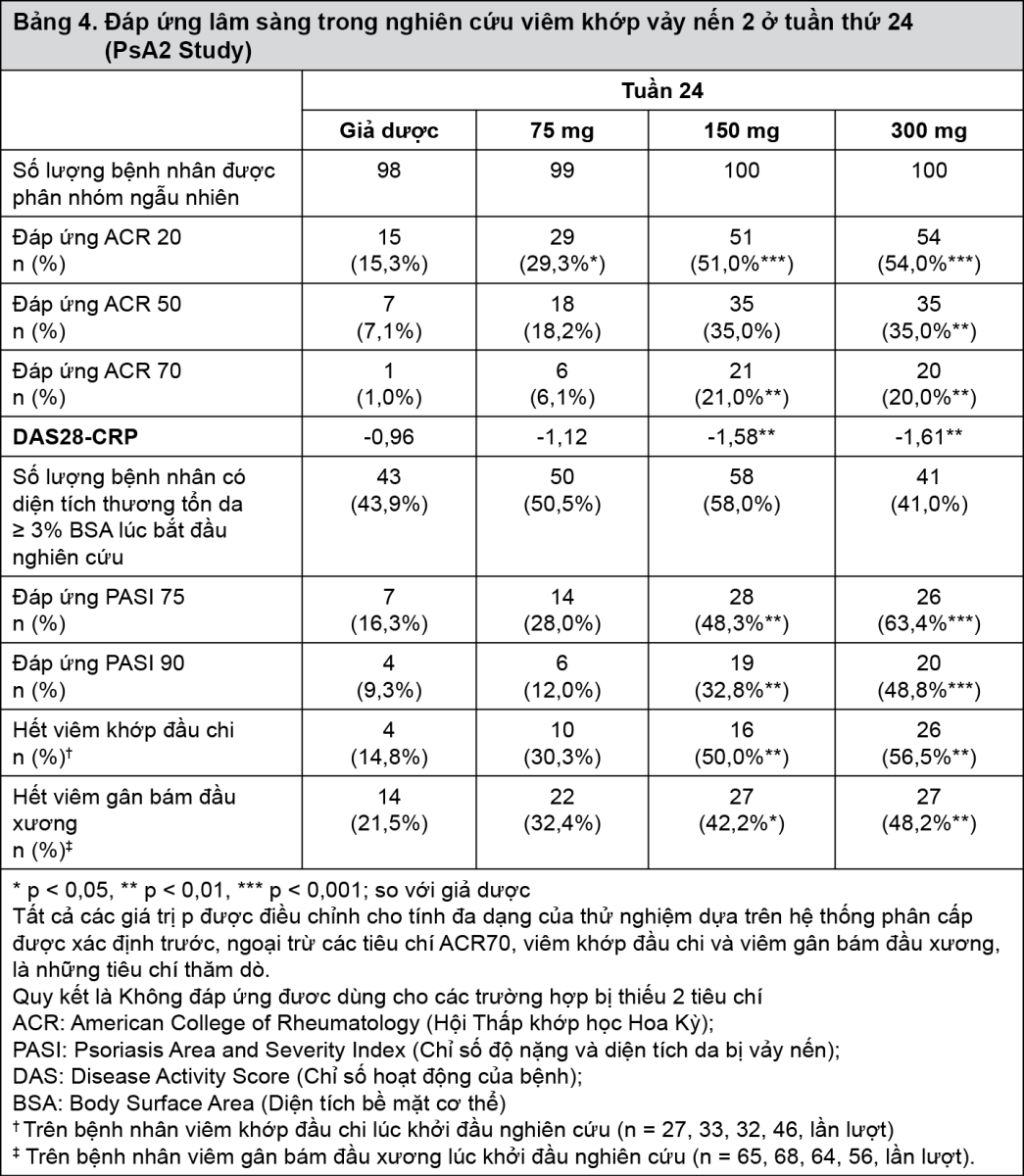
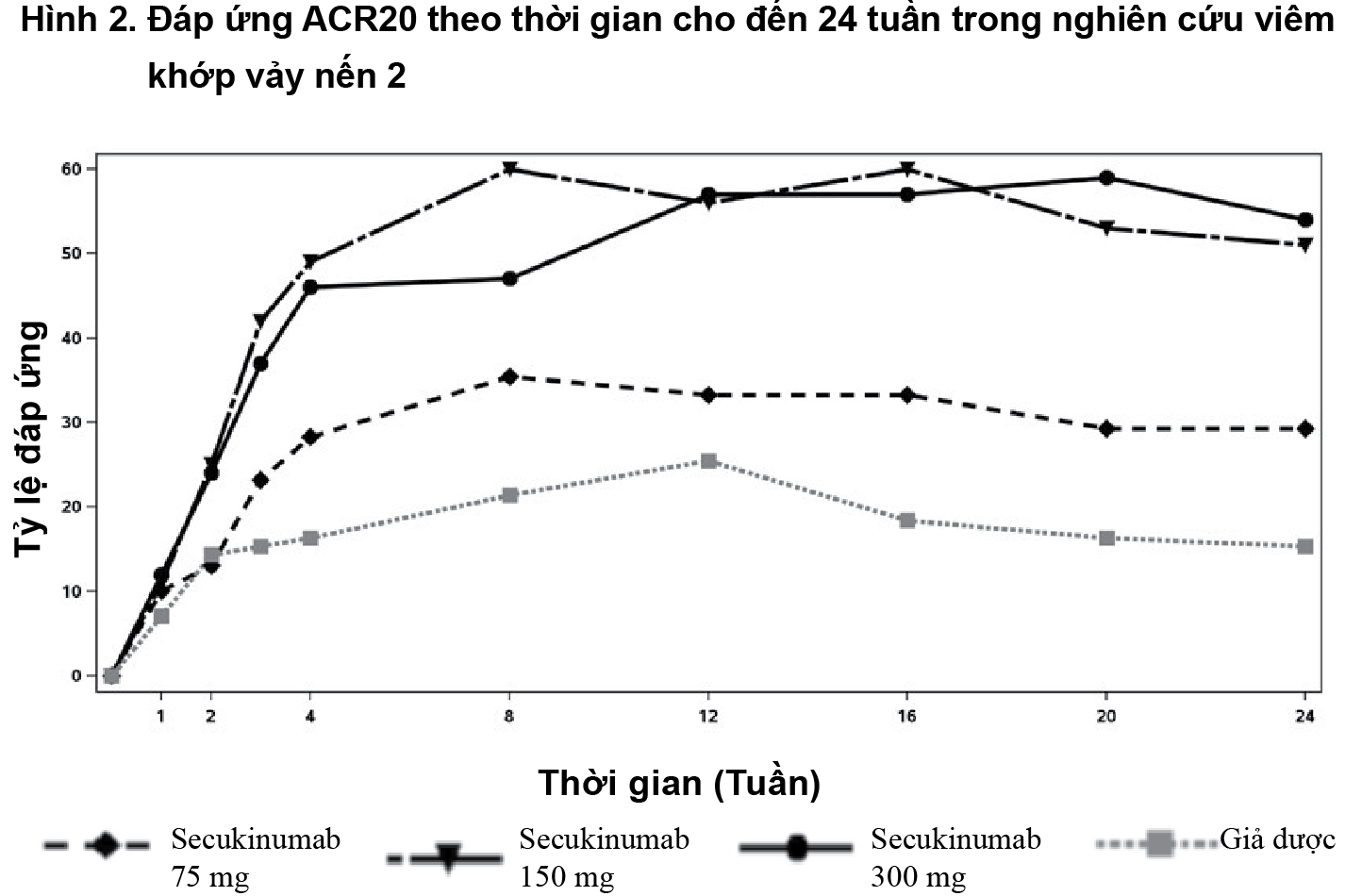
Khởi phát tác động của secukinumab xảy ra sớm vào tuần thứ 2. Sự khác biệt có ý nghĩa thống kê về đáp ứng ACR 20 so với nhóm giả dược đạt được vào tuần thứ 3. Ở tuần 16, các bệnh nhân điều trị bằng secukinumab đã biểu hiện sự cải thiện đáng kể về dấu hiệu và triệu chứng, trong đó đáp ứng cao hơn đáng kể về tiêu chí ACR 20 (33,3%, 60,0% và 57,0% ở các liều 75 mg, 150 mg và 300 mg tương ứng) so với giả dược (18,4%).
- xem Hình 2.
Đáp ứng tương tự đối với tiêu chí nghiên cứu chính và tiêu chí phụ được quan sát thấy trên bệnh nhân viêm khớp vảy nến bất kể bệnh nhân có dùng MTX đồng thời hay không. Ở tuần 24, các bệnh nhân điều trị bằng secukinumab đồng thời với MTX có đáp ứng ACR 20 cao hơn (44,7%, 47,7% và 54,4% ở các liều 75 mg, 150 mg và 300 mg tương ứng, so với giả dược 20.0%) và đáp ứng ACR 50 (27,7%, 31,8% và 38,6% ở các liều 75 mg, 150 mg và 300 mg tương ứng, so với giả dược 8.0%). Các bệnh nhân điều trị bằng secukinumab không dùng đồng thời MTX có đáp ứng ACR 20 cao hơn (15,4%, 53,6% và 53,6% ở các liều 75 mg, 150 mg và 300 mg tương ứng, so với giả dược 10,4%) và đáp ứng ACR 50 (9,6%, 37,5% và 32,1% ở các liều 75 mg, 150 mg và 300 mg tương ứng, so với giả dược 6,3%).
Cả hai loại bệnh nhân chưa từng dùng kháng TNFα và bệnh nhân có đáp ứng không hoàn toàn với kháng TNFα, khi được điều trị secukinumab đều có đáp ứng ACR 20 cao hơn một cách có ý nghĩa so với giả dược vào tuần thứ 24, với đáp ứng hơi cao hơn ở nhóm chưa từng dùng kháng TNFα (nhóm chưa từng dùng TNFα: ở liều 75 mg, 150 mg và 300 mg lần lượt là 37%, 64% và 58% so với giả dược là 15,9%; nhóm đáp ứng không hoàn toàn với kháng TNFα: ở liều 75 mg, 150 mg và 300 mg lần lượt là 15%, 30% và 46% so với giả dược là 14,3%). Ở nhóm bệnh nhân đáp ứng không hoàn toàn với kháng TNFα, chỉ có nhóm sử dụng liều 300 mg có tỉ lệ đáp ứng ACR 20 cao hơn đáng kể so với bệnh nhân dùng giả dược (p<0,05) và cho thấy lợi ích có ý nghĩa về lâm sàng vượt hơn liều 150 mg trên nhiều tiêu chí phụ. Những cải thiện trong đáp ứng PASI 75 cũng được quan sát thấy ở cả 2 nhóm bệnh nhân và liều 300 mg cho thấy lợi ích có ý nghĩa thống kê trên nhóm bệnh nhân có đáp ứng không hoàn toàn với kháng TNFα. Số lượng bệnh nhân viêm khớp vảy nến có tổn thương cột sống quá nhỏ để có thể cho phép đánh giá có ý nghĩa.
Sự cải thiện được biểu hiện trên tất cả các tiêu chí của điểm ACR, bao gồm cả tự đánh giá về đau của bệnh nhân. Tỷ lệ bệnh nhân đạt được tiêu chí đáp ứng viêm khớp vảy nến cải biên (PsARC) là cao hơn ở nhóm bệnh nhân được điều trị bằng secukinumab (38,4%, 62,0% và 63,0% ở các liều 75 mg, 150 mg và 300 mg tương ứng) so với giả dược (29,6%) ở tuần 24.
Trong nghiên cứu viêm khớp vảy nến 1 và 2, hiệu quả được duy trì cho đến tuần 52. Trong nghiên cứu viêm khớp vảy nến 2, trong số 200 bệnh nhân ngẫu nhiên ban đầu dùng secukinumab 150 mg và 300 mg, 178 (89%) bệnh nhân vẫn đang tiếp tục điều trị ở tuần 52. Trong số 100 bệnh nhân ngẫu nhiên dùng secukinumab 150 mg, 64, 39 và 20 bệnh nhân có đáp ứng ACR 20/50/70 tương ứng. Trong số 100 bệnh nhân ngẫu nhiên dùng secukinumab 300 mg, 64, 44 và 24 bệnh nhân có đáp ứng ACR 20/50/70 tương ứng.
Đáp ứng trên X quang
Liều tải tiêm dưới da được chấp thuận để sử dụng trong lâm sàng chưa thể hiện được sự ức chế tiến triển của tổn thương cấu trúc trong bệnh viêm khớp vảy nến.
Trong nghiên cứu viêm khớp 1, sự ức chế tiến triển của tổn thương cấu trúc được đánh giá bằng X-quang và diễn đạt bằng sự thay đổi thang điểm mTSS (modified Total Sharp Score) và các thành phần của nó, điểm ES (Erosion Score) và điểm JSN (Joint Space Narrowing score) ở tuần 24 và 52, so với lúc ban đầu. Dữ liệu ở tuần 24 được thể hiện trong Bảng 5.
- xem Bảng 5.

Sự ức chế tổn thương về mặt cấu trúc do trị liệu bằng secukinumab được duy trì đến tuần 52.
Tỉ lệ bệnh nhân có bệnh không tiến triển (được xác định là có sự thay đổi điểm mTSS so với ban đầu ≤ 0,5) từ khi phân nhóm ngẫu nhiên đến tuần 24 ở nhóm dùng secukinumab tiêm tĩnh mạch liều tải 10 mg/kg - duy trì liều 75 mg tiêm dưới da là 92,3%, ở nhóm dùng secukinumab tiêm tĩnh mạch liều tải 10 mg/kg - duy trì liều 150 mg tiêm dưới da là 82,3% và ở nhóm dùng giả dược là 75,7%. Tỉ lệ bệnh nhân có bệnh không tiến triển từ tuần 24 đến tuần 52 ở nhóm dùng secukinumab tiêm tĩnh mạch liều tải 10 mg/kg – sau dó dùng duy trì liều 75 mg hoặc 150 mg tiêm dưới da và ở nhóm dùng giả dược chuyển qua tiêm dưới da liều 75 mg hoặc 150 mg mỗi 4 tuần ở tuần 16 hoặc tuần 24 lần lượt là 85,8%, 85,7% và 86,8%.
Chức năng thực thể và chất lượng cuộc sống liên quan đến vấn đề sức khỏe
Trong nghiên cứu viêm khớp vảy nến 2, bệnh nhân dùng secukinumab liều 150 mg (p=0,0555) và 300 mg (p=0,0040) cho thấy sự cải thiện chức năng thực thể so với bệnh nhân dùng giả dược theo đánh giá bằng Chỉ số Tàn tật bằng Bộ câu hỏi Đánh giá Sức khỏe (Heath Assessment Questionnaire-Disability Index - HAQ-DI) ở tuần 24. Sự cải thiện của chỉ số HAQ-DI đã được ghi nhận dù bệnh nhân có dùng kháng TNFα trước đó hay không. Các kết quả tương tự cũng được quan sát thấy trong nghiên cứu viêm khớp vảy nến 1.
Bệnh nhân sử dụng secukinumab có cải thiện đáng kể về chất lượng cuộc sống liên quan đến sức khỏe khi tính điểm SF-36 PCS (Short Form (36) Health Survey Physical Component Summary) (p<0,001). Sự cải thiện đáng kể có ý nghĩa thống kê cũng đã được thấy qua các chỉ tiêu thăm dò đánh giá bởi điểm Đánh giá Chức năng của Liệu pháp Bệnh Mạn tính – Mệt mỏi (Functional Assessment of Chronic Illness Therapy – Fatigue; FACIT-F) ở nhóm bệnh nhân dùng secukinumab liều 150 mg và 300 mg so với giả dược (7,97, 5,97 so với 1,63, tương ứng). Các kết quả tương tự cũng được thấy trong nghiên cứu viêm khớp vảy nến 1 và hiệu quả được duy trì cho đến tuần 52.
Viêm cột sống dính khớp
Tính an toàn và tính hiệu quả của secukinumab trong hai thử nghiệm pha III ngẫu nhiên, mù đôi, đối chứng giả dược đánh giá 590 bệnh nhân viêm cột sống dính khớp giai đoạn hoạt tính bằng Chỉ số đánh giá mức độ hoạt động của bệnh viêm cột sống dính khớp (Bath Ankylosing Spondylitis Disease Activity Index - BASDAI) ≥4 bất kể thuốc kháng viêm không steroids (NSAID), corticoids hay thuốc chống thấp khớp làm thay đổi bệnh (DMARD). Bệnh nhân trong những nghiên cứu này đã được chẩn đoán bệnh trung bình từ 2,7 đến 5,8 năm. Trong cả hai nghiên cứu, tiêu chí đánh giá chính là ít nhất cải thiện 20% tiêu chuẩn Đánh giá của Hội Viêm khớp Cột sống Thế giới (Assessment of Spondyloarthritis International Society) (ASAS20) vào tuần thứ 16.
Trong nghiên cứu viêm cột sống dính khớp 1 (AS Study 1) và viêm cột sống dính khớp 2 (AS Study 2), 2 lần lượt có 27,0% và 38,8% bệnh nhân được điều trị bằng chất kháng TNFα trước đó và đã ngưng dùng do không hiệu quả hay không dung nạp (bệnh nhân có đáp ứng không hoàn toàn với chất kháng TNFα).
Nghiên cứu viêm cột sống dính khớp 1 (MEASURE 1) đánh giá 371 bệnh nhân, với 14,8% trường hợp dùng đồng thời MTX và 33,4% trường hợp dùng đồng thời sulfasalazine. Bệnh nhân được phân ngẫu nhiên vào nhóm sử dụng secukinumab với liều 10 mg/kg tiêm tĩnh mạch vào tuần 0, 2 và 4, sau đó tiếp tục liều 75 mg hay 150 mg tiêm dưới da mỗi tháng bắt đầu từ tuần 8. Bệnh nhân được phân ngẫu nhiên vào nhóm giả dược mà không đáp ứng vào tuần thứ 16 và tất cả các bệnh nhân dùng giả dược khác ở tuần thứ 24 được chuyển sang sử dụng secukinumab (liều 75 mg hoặc 150 mg tiêm dưới da), sau đó mỗi tháng dùng tiếp cùng liều.
Nghiên cứu viêm cột sống dính khớp 2 (MEASURE 2) đánh giá trên 219 bệnh nhân, trong đó có 11,9% trường hợp sử dụng đồng thời MTX và 14,2% trường hợp sử dụng đồng thời sulfasalazine. Bệnh nhân được phân ngẫu nhiên vào nhóm sử dụng secukinumab với liều 75 mg hay 150 mg tiêm dưới da vào tuần 0, 1, 2 và 3, sau đó mỗi tháng dùng tiếp cùng liều bắt đầu từ tuần thứ 4. Vào tuần 16, những bệnh nhân được phân ngẫu nhiên vào nhóm giả dược lúc khởi đầu sẽ được phân ngẫu nhiên lại vào nhóm sử dụng secukinumab (liều 75 mg hoặc 150 mg) tiêm dưới da mỗi tháng.
Dấu hiệu và triệu chứng
Trong nghiên cứu viêm cột sống dính khớp 2, việc điều trị secukinumab 150 mg dẫn đến cải thiện tốt hơn về các chỉ số đánh giá mức độ hoạt tính của bệnh so với giả dược ở tuần 16 (xem Bảng 6).
- xem Bảng 6.

Khởi phát tác dụng của secukinumab 150 mg xảy ra sớm vào tuần thứ 1 với đánh giá ASAS 20 trong nghiên cứu viêm cột sống dính khớp 2 (hơn hẳn giả dược).
Đáp ứng ASAS 20 được cải thiện ở tuần thứ 16 ở cả nhóm bệnh nhân chưa dùng kháng TNFα (68,2% so với 31,1%; p<0,05) lẫn nhóm bệnh nhân đáp ứng không hoàn toàn với kháng TNFα (50,0% so với 24,1%; p<0,05) sử dụng secukinumab 150 mg so với giả dược.
Trong cả hai nghiên cứu viêm cột sống dính khớp, bệnh nhân điều trị bằng secukinumab (150 mg trong nghiên cứu viêm cột sống dính khớp 2 và cả 2 chế độ liều trong nghiên cứu viêm cột sống dính khớp 1) đã biểu hiện sự cải thiện đáng kể về dấu hiệu và triệu chứng ở tuần 16, với mức độ đáp ứng so sánh được và hiệu quả được duy trì cho đến tuần 52 ở cả nhóm bệnh nhân chưa từng dùng kháng TNFα và bệnh nhân có đáp ứng không hoàn toàn với kháng TNFα. Trong nghiên cứu viêm cột sống dính khớp 2, trong số 72 bệnh nhân ngẫu nhiên được sử dụng secukinumab 150 mg ban đầu, 61 (84,7%) bệnh nhân vẫn tiếp tục được điều trị ở tuần 52. Trong số đó, lần lượt 45 và 35 bệnh nhân có đáp ứng ASAS 20 và ASAS 40.
Vận động cột sống: Bệnh nhân điều trị bằng secukinumab 150 mg cho thấy sự cải thiện đáng kể về vận động cột sống khi đánh giá bằng sự thay đổi chỉ số đo lường bệnh viêm cột sống dính khớp (BASMI - Bath Ankylosing Spondylitis Metrology Index) ở tuần 16 trong cả 2 nghiên cứu viêm cột sống dính khớp 1 (-0,40 so với -0,12 ở nhóm dùng giả dược; p=0,0114) và nghiên cứu viêm cột sống dính khớp 2 (-0,51 so với -0,22 ở nhóm dùng giả dược; p=0,0533). Sự cải thiện này được duy trì cho đến tuần 52.
Chức năng thực thể và chất lượng cuộc sống liên quan đến vấn đề sức khoẻ: Trong nghiên cứu viêm cột sống dính khớp 2, bệnh nhân được điều trị với secukinumab 150 mg cho thấy tình trạng cải thiện hơn vào tuần thứ 16 so với giả dược về chức năng thực thể khi đánh giá chất lượng cuộc sống trong bệnh viêm cột sống dính khớp (ASQoL - AS Quality of Life Questionnaire) (p=0,001) và tổng hợp các yếu tố thực thể (SF-36PCS - SF-36 Physical Component Summary) (p<0,001). Bệnh nhân được điều trị với secukinumab 150 mg cũng cho thấy tình trạng cải thiện hơn đáng kể của các tiêu chí thăm dò về chức năng thực thể khi đánh giá chỉ số chức năng trong bệnh viêm cột sống dính khớp (BASFI - the Bath Ankylosing Spondylitis Functional Index) so với giả dược (-2,15 so với -0,68) và về mệt mỏi khi đánh giá Thang điểm Đánh giá Chức năng của Liệu pháp Bệnh Mạn tính – Mệt mỏi (FACIT-Fatigue) so với giả dược (8,10 so với 3,30). Sự cải thiện này kéo dài cho đến tuần 52.
Nhóm bệnh nhân trẻ em
Cơ quan Quản lý Dược phẩm châu Âu (EMA) đã miễn việc bắt buộc nộp những kết quả nghiên cứu secukinumab ở bệnh nhân trẻ em bị vảy nến thể mảng, tuổi từ sơ sinh đến dưới 6 tuổi và ở bệnh nhân trẻ em bị viêm khớp tự phát mãn tính tuổi từ sơ sinh đến dưới 2 tuổi (xem mục Liều lượng và Cách dùng để biết thông tin dùng thuốc ở trẻ em).
Cục Dược phẩm châu Âu cũng đã hoãn việc nộp những kết quả nghiên cứu secukinumab ở bệnh nhân trẻ em bị vảy nến thể mảng, tuổi từ 6 đến dưới 18 và ở bệnh nhân trẻ em bị viêm khớp tự phát mãn tính tuổi từ 2 đến dưới 18 tuổi (xem mục Liều lượng và Cách dùng để biết thông tin dùng thuốc ở trẻ em).
Dược động học
Vảy nến thể mảng
Hấp thu
Theo sau một liều đơn 300 mg tiêm dưới da dung dịch thuốc ở những người tình nguyện khỏe mạnh, secukinumab đạt nồng độ đỉnh trong huyết thanh là 43,2±10,4 μg/ml giữa 2 và 14 ngày sau liều tiêm.
Dựa trên phân tích về dược động học, sau khi tiêm dưới da cho bệnh nhân vảy nến thể mảng một liều đơn 150 mg hoặc 300 mg, secukinumab đạt nồng độ đỉnh trong huyết tương lần lượt là 13,7±4,8 μg/ml hoặc 27,3±9,5 μg/ml, giữa 5 và 6 ngày sau liều tiêm.
Sau khi tiêm liều hằng tuần khởi đầu trong tháng đầu tiên, thời gian để đạt nồng độ tối đa theo phân tích dược động học quần thể là trong khoảng 31-34 ngày.
Trên cơ sở các số liệu sẵn có, nồng độ đỉnh ở trạng thái bền vững (Cmax, ss) sau khi tiêm dưới da liều 150 mg là 27,6 μg/ml hoặc liều 300 mg là 55,2 μg/ml. Phân tích dược động học quần thể gợi ý rằng nồng độ bền vững đạt được sau 20 tuần với phác đồ liều hằng tháng.
Phân tích quần thể về dược động học cũng chỉ ra rằng, so với sau khi tiêm một liều đơn, bệnh nhân được điều trị dùng liều duy trì lặp lại hằng tháng có nồng độ đỉnh và diện tích dưới đường cong (AUC - area under the curve) tăng gấp 2 lần.
Phân tích quần thể về dược động học cho thấy secukinumab được hấp thu với sinh khả dụng tuyệt đối 73% ở bệnh nhân vảy nến thể mảng. Các nghiên cứu cho thấy sinh khả dụng tuyệt đối dao động trong khoảng giữa 60 và 77%.
Phân bố: Thể tích phân bố trung bình trong pha cuối (Vz) theo sau tiêm tĩnh mạch một liều đơn phân bố trong khoảng từ 7,1 đến 8,6 lít ở các bệnh nhân vảy nến thể mảng, điều này cho thấy secukinumab chịu phân bố giới hạn ra các khoang ngoại biên.
Chuyển dạng sinh học: Phần lớn sự bài tiết của IgG xảy ra thông qua quá trình dị hóa nội bào, sau giai đoạn dịch hoặc sự tiêu hóa nội bào qua trung gian thụ thể.
Bài tiết: Độ thanh thải toàn thân trung bình theo sau một liều đơn tiêm tĩnh mạch ở bệnh nhân vảy nến thể mảng dao động từ 0,13 đến 0,36 l/ngày. Khi phân tích dược động học quần thể thì thấy độ thanh thải toàn thân trung bình là 0,19 l/ngày ở bệnh nhân vảy nến thể mảng. Giới tính không ảnh hưởng đến độ thanh thải. Độ thanh thải cũng không phụ thuộc vào liều và thời gian.
Thời gian bán hủy trung bình đo bằng phân tích dược động học quần thể là 27 ngày ở bệnh nhân vảy nến thể mảng, dao động từ 18 đến 46 ngày qua các nghiên cứu vảy nến với đường tiêm tĩnh mạch.
Tuyến tính/phi tuyến tính: Dược động học secukinumab đơn liều và đa liều ở bệnh nhân vảy nến thể mảng đã được xác định trong nhiều nghiên cứu với liều tĩnh mạch từ 1 x 0,3 mg/kg đến 3 x 10 mg/kg và liều tiêm dưới da từ 1 x 25 mg đến đa liều 300 mg. Trong tất cả các phác đồ liều, nồng độ tiếp xúc thuốc là tương ứng theo liều.
Viêm khớp vảy nến: Đặc tính dược động học của secukinumab trên bệnh nhân viêm khớp vảy nến là tương tự như những gì biểu hiện trên bệnh nhân vảy nến thể mảng. Sinh khả dụng của secukinumab trên bệnh nhân viêm khớp vảy nến là 85% dựa trên mô hình dược động học quần thể.
Viêm cột sống dính khớp: Đặc tính dược động học của secukinumab trên bệnh nhân viêm cột sống dính khớp là tương tự như những gì biểu hiện trên bệnh nhân vảy nến thể mảng.
Nhóm bệnh nhân đặc biệt
Bệnh nhân lớn tuổi
Trong 3.430 bệnh nhân vảy nến thể mảng được điều trị bằng secukinumab trong các nghiên cứu lâm sàng, có tất cả 230 bệnh nhân từ 65 tuổi trở lên và 32 bệnh nhân từ 75 tuổi trở lên.
Trong 974 bệnh nhân viêm khớp vảy nến được điều trị bằng secukinumab trong các nghiên cứu lâm sàng, có tất cả 85 bệnh nhân từ 65 tuổi trở lên và 4 bệnh nhân từ 75 tuổi trở lên.
Trong 571 bệnh nhân viêm cột sống dính khớp được điều trị bằng secukinumab trong các nghiên cứu lâm sàng, có tất cả 24 bệnh nhân từ 65 tuổi trở lên và 3 bệnh nhân từ 75 tuổi trở lên.
Dựa trên phân tích dược động học quần thể trên một số lượng giới hạn bệnh nhân lớn tuổi (n=71 đối với bệnh nhân ≥65 tuổi và n=7 đối với bệnh nhân ≥75 tuổi), độ thanh thải ở những bệnh nhân lớn tuổi và bệnh nhân dưới 65 tuổi là tương đương nhau.
Bệnh nhân suy chức năng gan hoặc thận: Không có dữ liệu về dược động học ở những bệnh nhân có suy chức năng gan hoặc suy chức năng thận. Sự bài tiết qua thận của secukinumab nguyên trạng, một kháng thể IgG đơn dòng, được nghĩ là thấp và ít quan trọng. Các IgG chủ yếu được bài tiết qua con đường dị hóa và suy chức năng gan không bị cho là làm ảnh hưởng lên sự thanh thải của secukinumab.
Ảnh hưởng của cân nặng lên dược động học: Độ thanh thải của secukinumab và thể tích phân bố tăng khi trọng lượng cơ thể tăng.
An toàn tiền lâm sàng
Các dữ liệu phi lâm sàng đã chỉ ra không có nguy cơ đặc biệt nào cho con người, dựa trên các nghiên cứu thử nghiệm phản ứng chéo trên mô, dược lý an toàn, liều lặp lại và độc tính trên hệ sinh sản, được tiến hành với secukinumab hoặc một kháng thể của chuột kháng IL-17A của chuột.
Do secukinumab gắn với IL-17A của người và khỉ cynomolgus, nên độ an toàn của chất này đã được nghiên cứu trên khỉ cynomolgus. Không thấy có tác dụng không mong muốn của secukinumab khi tiêm dưới da cho khỉ cynomolgus sau 13 tuần và tiêm tĩnh mạch sau 26 tuần (bao gồm đánh giá dược động học, dược lực học, tính sinh miễn dịch và độc tính miễn dịch (chẳng hạn như đáp ứng kháng thể phụ thuộc tế bào T và hoạt động của tế bào diệt tự nhiên)). Nồng độ trung bình trong huyết thanh ở khỉ sau 13 liều tiêm dưới da mỗi tuần liều 150 mg/kg cao hơn đáng kể so với nồng độ trung bình mong muốn trong huyết thanh của bệnh nhân vảy nến điều trị với liều điều trị cao nhất. Kháng thể kháng secukinumab đã được phát hiện không chỉ ở một trong các động vật tiêm thuốc. Không thấy có phản ứng chéo mô không đặc hiệu khi tiêm secukinumab cho mô người bình thường.
Các nghiên cứu trên động vật chưa được tiến hành để đánh giá về khả năng sinh ung của secukinumab.
Trong một nghiên cứu về phát triển của phôi thai ở khỉ cynomolgus, secukinumab không gây độc cho mẹ, không gây độc cho phôi hay gây quái thai khi tiêm trong giai đoạn phát triển cơ quan và giai đoạn cuối của thai kỳ.
Trong các nghiên cứu về khả năng sinh sản, về sự phát triển phôi và sự phát triển của thai trước và sau sinh ở chuột, không thấy có tác dụng không mong muốn của kháng thể kháng IL-17A. Liều cao đã dùng trong các nghiên cứu này vượt quá liều tối đa có tác dụng về mặt ức chế hay hoạt động của IL-17A (xem mục Sử dụng ở phụ nữ có thai và cho con bú).
Chỉ định/Công dụng
Vảy nến thể mảng: Fraizeron được dùng để điều trị vảy nến thể mảng mức độ trung bình đến nặng ở những bệnh nhân người lớn có chỉ định điều trị đường toàn thân hoặc quang liệu pháp.
Viêm khớp vảy nến: Fraizeron đơn trị hoặc kết hợp với methotrexate (MTX) được chỉ định cho bệnh nhân người lớn bị viêm khớp vảy nến giai đoạn hoạt động khi đáp ứng không đầy đủ với trị liệu bằng các thuốc chống thấp khớp làm thay đổi diễn tiến bệnh (DMARD) (xem phần Dược lực học).
Viêm cột sống dính khớp: Fraizeron được chỉ định cho bệnh nhân người lớn bị viêm cột sống dính khớp giai đoạn hoạt động, đáp ứng không đầy đủ với trị liệu thông thường.
Liều lượng & Cách dùng
Fraizeron được dùng dưới sự hướng dẫn và giám sát của bác sỹ có kinh nghiệm trong chẩn đoán và điều trị các tình trạng bệnh lý được chỉ định.
Liều dùng
Vảy nến thể mảng: Liều khuyến cáo là 300 mg secukinumab tiêm dưới da khởi đầu ở các tuần 0, 1, 2 và 3, sau đó duy trì liều hằng tháng từ tuần thứ 4. Mỗi liều 300 mg được chia làm 2 lần 150 mg tiêm dưới da.
Viêm khớp vảy nến
Đối với những bệnh nhân mắc đồng thời vảy nến thể mảng mức độ từ trung bình đến nặng hoặc bệnh nhân có đáp ứng không hoàn toàn với chất kháng TNFα, liều khuyến cáo là 300 mg tiêm dưới da khởi đầu ở tuần 0, 1, 2 và 3, sau đó là liều duy trì hàng tháng tính từ tuần thứ 4. Liều 300 mg được dùng bằng 2 mũi tiêm dưới da 150 mg.
Đối với các bệnh nhân khác, liều khuyến cáo là 150 mg tiêm dưới da với các liều khởi đầu ở tuần 0, 1, 2 và 3, sau đó là liều duy trì hàng tháng tính từ tuần thứ 4.
Viêm cột sống dính khớp
Liều khuyến cáo là 150 mg tiêm dưới da với các liều khởi đầu ở tuần 0, 1, 2 và 3, sau đó là liều duy trì hàng tháng tính từ tuần thứ 4.
Đối với tất cả các chỉ định trên, dữ liệu hiện có cho thấy đáp ứng lâm sàng thường đạt được trong vòng 16 tuần điều trị. Cân nhắc dừng điều trị ở những bệnh nhân không đáp ứng điều trị sau hơn 16 tuần. Một số bệnh nhân lúc đầu chỉ đáp ứng một phần, sau đó tiếp tục điều trị hơn 16 tuần có thể cải thiện.
Nhóm bệnh nhân đặc biệt
Bệnh nhân cao tuổi (từ 65 tuổi trở lên): Không cần điều chỉnh liều (xem mục Dược động học).
Suy chức năng thận/gan: Fraizeron chưa được nghiên cứu trên quần thể những bệnh nhân này. Chưa có khuyến cáo về liều điều trị.
Bệnh nhân trẻ em: Độ an toàn và hiệu quả của Fraizeron ở trẻ em dưới 18 tuổi vẫn chưa được xác định. Chưa có dữ liệu liên quan.
Cách dùng
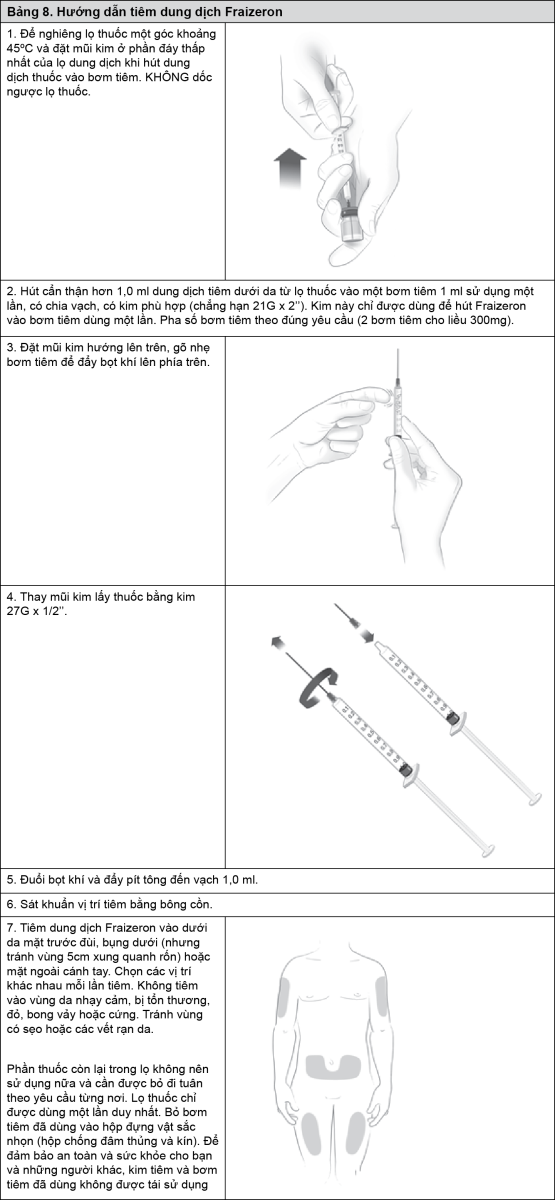
Fraizeron được chỉ định tiêm dưới da. Nếu có thể, các vị trí tiêm cần tránh các vùng da bị vảy nến.
Bột pha dung dịch tiêm cần được pha ngay trước khi sử dụng. Xem phần hướng dẫn pha thuốc trước khi dùng ở mục Thận trọng đặc biệt về hủy thuốc và các xử lý khác và hướng dẫn sử dụng ở toa thuốc trong hộp sản phẩm.
NHỮNG THẬN TRỌNG ĐẶC BIỆT VỀ HỦY THUỐC VÀ CÁC XỬ LÝ KHÁC
Mỗi lọ dùng một lần có chứa 150 mg secukinumab để pha với nước cất để tiêm. Dung dịch sau khi pha tiêm phải trong suốt và không màu đến màu vàng nhạt. Không sử dụng nếu bột đông khô không tan hoàn toàn hoặc nếu dung dịch pha tiêm có thành phần nhìn thấy được bằng mắt thường, đục hoặc có màu nâu rõ rệt. Hướng dẫn chi tiết sử dụng được cung cấp trong tờ toa thuốc trong hộp thuốc.
Phần thuốc không sử dụng và những vật liệu bỏ đi cần được loại bỏ tuân theo yêu cầu từng nơi.
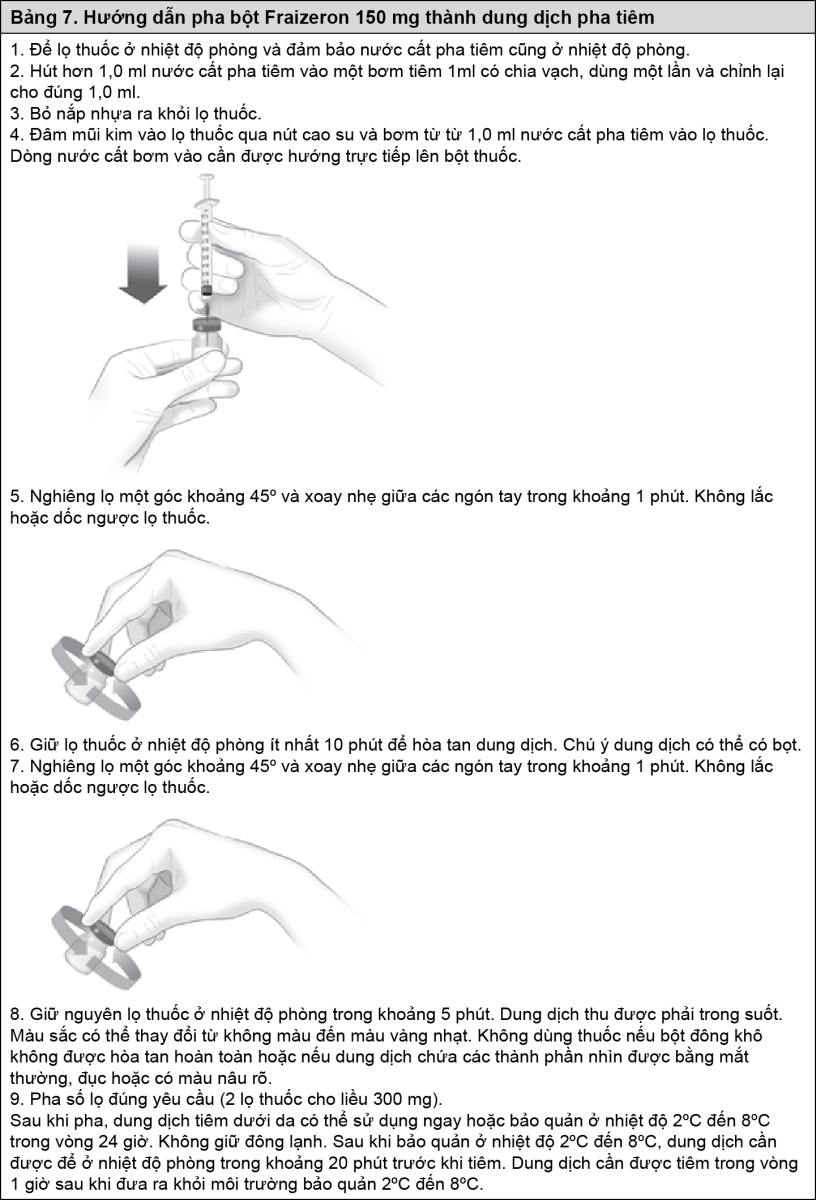
HƯỚNG DẪN PHA BỘT FRAIZERON THÀNH DUNG DỊCH TIÊM
Những thông tin dưới đây chỉ dành cho các bác sỹ và nhân viên y tế.
Bảo quản lọ đựng bột thuốc trong tủ lạnh từ 2ºC đến 8ºC.
Lọ thuốc chứa 150 mg secukinumab dùng một lần duy nhất, dùng để pha với nước cất thành dung dịch tiêm. Không dùng lọ thuốc đã quá hạn sử dụng ghi trên vỏ hộp hoặc lọ thuốc. Nếu thuốc đã quá hạn, trả lại toàn bộ hộp thuốc cho hãng dược.
Việc chuẩn bị pha dung dịch tiêm dưới da cần được tiến hành liên tục không gián đoạn và đảm bảo các kỹ thuật vô khuẩn. Thời gian chuẩn bị từ lúc mở nắp lọ đến khi kết thúc quá trình pha trung bình là 20 phút và không nên kéo dài quá 90 phút.
Để chuẩn bị bột Fraizeron pha dung dịch tiêm, xin vui lòng tuân theo hướng dẫn sau:
- xem Bảng 7 & Bảng 8.
Cảnh báo
Thuốc này chỉ dùng theo sự kê đơn của bác sĩ.
Nhiễm khuẩn
Secukinumab có khả năng làm tăng nguy cơ nhiễm trùng. Trong các nghiên cứu lâm sàng, người ta thấy các nhiễm trùng xuất hiện trên các bệnh nhân dùng secukinumab (xem mục Tác dụng ngoại ý). Hầu hết là các nhiễm khuẩn đường hô hấp trên, ở mức độ nhẹ hoặc trung bình như viêm mũi họng và không cần phải ngừng điều trị.
Do cơ chế tác dụng của secukinumab, nhiễm Candida da-niêm mạc ở mức độ không nặng thường gặp hơn ở nhóm bệnh nhân dùng secukinumab so với nhóm dùng giả dược trong các nghiên cứu lâm sàng về bệnh vảy nến (3,55 trên 100 bệnh nhân-năm ở nhóm secukinumab 300 mg so với 1 trên 100 bệnh nhân-năm ở nhóm dùng giả dược) (xem mục Tác dụng ngoại ý).
Cần thận trọng khi cân nhắc việc sử dụng secukinumab ở những bệnh nhân có nhiễm trùng mạn tính hoặc tiền sử nhiễm trùng tái phát.
Bệnh nhân cần được hướng dẫn đi khám nếu có các dấu hiệu và triệu chứng gợi ý nhiễm trùng. Nếu tiến triển nhiễm trùng nặng, bệnh nhân cần được theo dõi chặt chẽ và không nên dùng secukinumab cho đến khi nhiễm trùng được giải quyết.
Các nghiên cứu lâm sàng đã cho thấy thuốc không làm tăng nhạy cảm với lao. Tuy nhiên, không nên chỉ định secukinumab cho những bệnh nhân nhiễm lao trong giai đoạn hoạt động. Ở những bệnh nhân nhiễm lao tiềm tàng, các thuốc điều trị lao cần được cân nhắc sử dụng trước khi bắt đầu secukinumab.
Bệnh Crohn’s
Cần thận trọng khi dùng secukinumab cho những bệnh nhân mắc bệnh Crohn’s. Trong thử nghiệm lâm sàng, đã quan sát thấy một số trường hợp bệnh nặng lên ở cả 2 nhóm dùng secukinumab và giả dược. Những bệnh nhân đang điều trị bằng secukinumab và có bệnh Crohn’s cần được theo dõi chặt chẽ.
Phản ứng quá mẫn: Trong các nghiên cứu lâm sàng, rất ít các ca phản ứng phản vệ được quan sát thấy ở các bệnh nhân dùng secukinumab. Nếu phản ứng phản vệ hoặc phản ứng dị ứng nghiêm trọng xảy ra, cần ngưng sử dụng secukinumab ngay và tiến hành điều trị thích hợp.
Tiêm phòng
Không nên tiêm vắc xin sống đồng thời với dùng secukinumab.
Những bệnh nhân dùng secukinumab có thể tiêm đồng thời vắc xin bất hoạt hoặc vắc xin chết. Trong một nghiên cứu, sau khi tiêm vắc xin não mô cầu và vắc xin cúm bất hoạt, một tỷ lệ tương đương những người tình nguyện khỏe mạnh được tiêm 150 mg secukinumab và tiêm giả dược, đã có đáp ứng miễn dịch đầy đủ, với nồng độ kháng thể kháng vắc xin não mô cầu và cúm tăng ít nhất 4 lần. Điều này cho thấy rằng, secukinumab không ức chế đáp ứng miễn dịch dịch thể với vắc xin chống não mô cầu và cúm.
Thuốc ức chế miễn dịch đi kèm: Trong các nghiên cứu về vảy nến, tính an toàn và hiệu quả của secukinumab khi phối hợp với các chất ức chế miễn dịch khác, bao gồm các chất sinh học hay quang trị liệu chưa được đánh giá (xem mục Tương tác).
Ảnh hưởng đến khả năng lái xe và vận hành máy móc: Secukinumab không ảnh hưởng hoặc ảnh hưởng không đáng kể lên khả năng lái xe và vận hành máy móc.
Quá Liều
Trong các nghiên cứu lâm sàng, không có báo cáo trường hợp quá liều thuốc nào.
Trong các nghiên cứu lâm sàng, liều thuốc lên đến 30 mg/kg (khoảng 2.000-3.000 mg) được dùng qua tiêm tĩnh mạch mà không gây độc tính liên quan với liều. Trong trường hợp quá liều, bệnh nhân cần được theo dõi để phát hiện bất kỳ dấu hiệu, triệu chứng nào của phản ứng bất lợi, và các biện pháp điều trị toàn thân cần được tiến hành ngay.
Chống chỉ định
Phản ứng quá mẫn nặng với hoạt chất hoặc bất cứ thành phần nào của các tá dược được nêu trong mục ''Tá dược''.
Nhiễm trùng quan trọng, có biểu hiện trên lâm sàng (chẳng hạn như lao ở giai đoạn hoạt động, xem mục Cảnh báo).
Sử dụng ở phụ nữ có thai và cho con bú
Phụ nữ trong độ tuổi mang thai: Phụ nữ trong độ tuổi mang thai nên sử dụng biện pháp tránh thai hiệu quả trong suốt quá trình điều trị và ít nhất 20 tuần sau điều trị.
Phụ nữ mang thai: Không có đủ dữ liệu về việc sử dụng secukinumab trên phụ nữ mang thai. Các nghiên cứu trên động vật không chỉ ra tác hại trực tiếp hay gián tiếp đối với phụ nữ mang thai, sự phát triển của phôi/bào thai, quá trình sinh nở và sự phát triển sau sinh (xem mục An toàn tiền lâm sàng). Để thận trọng thì tốt nhất nên tránh dùng secukinumab cho phụ nữ mang thai.
Phụ nữ cho con bú: Vẫn chưa biết secukinumab có được bài tiết qua sữa mẹ hay không. Các globulin miễn dịch được bài tiết qua sữa mẹ nhưng vẫn chưa biết secukinumab có được hấp thu toàn thân sau khi tiêu hóa hay không. Vì những phản ứng bất lợi có thể có từ secukinumab trong việc cho con bú sữa mẹ, quyết định nên dừng việc cho con bú trong và 20 tuần sau quá trình điều trị, hay dừng điều trị bằng secukinumab cần được cân nhắc giữa lợi ích của việc cho con bú và việc điều trị secukinumab cho bà mẹ.
Khả năng sinh sản: Tác dụng của secukinumab lên sự sinh đẻ của người chưa được đánh giá. Những nghiên cứu trên động vật không chỉ ra tác hại trực tiếp và gián tiếp lên sự mang thai ở người (xem mục An toàn tiền lâm sàng).
Tương tác
Vắc xin sống không được dùng đồng thời với secukinumab (xem thêm mục Cảnh báo).
Chưa có nghiên cứu về sự tương tác được tiến hành trên người. Không có bằng chứng trực tiếp về vai trò của IL-17A trong sự biểu hiện của enzyme CYP450. Sự hình thành của một số enzyme CYP450 bị ức chế bởi sự tăng các cytokine trong viêm mạn tính. Vì vậy, các chất chống viêm, chẳng hạn như secukinumab ức chế IL-17A, có thể làm bình thường hóa nồng độ CYP450 kèm theo là giảm nồng độ tiếp xúc của các thuốc chuyển hóa qua CYP450 dùng đồng thời. Vì vậy, ảnh hưởng về lâm sàng trên các cơ chất CYP450 với chỉ số điều trị hẹp (khi liều thuốc được điều chỉnh tùy từng bệnh nhân, chẳng hạn như warfarin) có thể không được loại trừ. Khi bắt đầu điều trị secukinumab ở những bệnh nhân đang dùng các loại thuốc này, cần cân nhắc việc theo dõi điều trị.
Không thấy có tương tác thuốc nào xảy ra khi sử dụng đồng thời secukinumab với methotrexate (MTX) và/hoặc corticosteroids trong các nghiên cứu về viêm khớp (bao gồm cả viêm khớp vảy nến và viêm cột sống dính khớp).
Tương kỵ
Thuốc này không nên pha trộn với các loại thuốc khác, ngoại trừ những thuốc được đề cập ở mục Hướng dẫn pha thuốc trước khi dùng ở phần Thận trọng đặc biệt về hủy thuốc và các xử lý khác.
Tác dụng ngoại ý
Tóm tắt sơ lược về dữ liệu an toàn
Tổng số 6.804 bệnh nhân được điều trị bằng secukinumab trong các nghiên cứu lâm sàng mù và không mù, với các chỉ định khác nhau (vảy nến thể mảng, viêm khớp vảy nến, viêm cột sống dính khớp và các bệnh tự miễn khác). Trong số đó, có 3.671 bệnh nhân được dùng secukinumab trong ít nhất 1 năm đại diện cho 6.450 bệnh nhân-năm sử dụng thuốc.
Phản ứng bất lợi trong chỉ định vảy nến thể mảng
Bốn nghiên cứu pha III, đối chứng giả dược trên bệnh nhân vảy nến thể mảng đã được tính gộp để đánh giá tính an toàn của secukinumab so với giả dược 12 tuần sau bắt đầu điều trị. Có tất cả 2.076 bệnh nhân được đánh giá (692 bệnh nhân dùng liều 150mg, 690 bệnh nhân dùng liều 300mg và 694 bệnh nhân dùng giả dược).
Phản ứng bất lợi của thuốc (ADRs) thường gặp nhất là nhiễm khuẩn đường hô hấp trên (thường gặp nhất là viêm mũi họng, viêm mũi). Hầu hết các phản ứng đều ở mức độ nhẹ đến trung bình.
Phản ứng bất lợi trong chỉ định viêm khớp vảy nến: Secukinumab được nghiên cứu trong hai thử nghiệm lâm sàng viêm khớp vảy nến đối chứng giả dược trên 1.003 bệnh nhân (703 bệnh nhân dùng secukinumab và 300 bệnh nhân dùng giả dược) trong tổng số 1.061 bệnh nhân-năm dùng thuốc nghiên cứu (thời gian trung bình dùng thuốc của nhóm bệnh nhân điều trị secukinumab là 456 ngày trong nghiên cứu viêm khớp vảy nến 1 và 245 ngày trong nghiên cứu viêm khớp vảy nến 2). Các dữ liệu về an toàn thấy được trên viêm khớp vảy nến sử dụng secukinumab tương tự như dữ liệu an toàn trong bệnh vảy nến.
Phản ứng bất lợi trong chỉ định viêm cột sống dính khớp: Secukinumab được nghiên cứu trong hai thử nghiệm lâm sàng viêm cột sống dính khớp đối chứng giả dược trên 590 bệnh nhân (394 bệnh nhân dùng secukinumab và 196 bệnh nhân dùng giả dược) trong tổng số 755 bệnh nhân – năm dùng thuốc nghiên cứu (thời gian trung bình dùng thuốc của nhóm điều trị secukinumab là 469 ngày trong nghiên cứu viêm cột sống dính khớp 1 và 460 ngày trong nghiên cứu viêm cột sống dính khớp 2). Các dữ liệu về an toàn thấy được trên bệnh nhân viêm cột sống dính khớp sử dụng secukinumab tương tự như dữ liệu an toàn trong bệnh vảy nến.
Danh mục các phản ứng bất lợi của thuốc
Các phản ứng bất lợi của thuốc (ADRs) từ các nghiên cứu lâm sàng về vảy nến, viêm khớp vảy nến và viêm cột sống dính khớp (Bảng 9) được liệt kê theo phân loại theo hệ cơ quan MedDRA. Trong mỗi phân loại theo hệ cơ quan MedDRA, các phản ứng bất lợi của thuốc được sắp xếp theo mức độ thường gặp với phản ứng hay gặp nhất xếp đầu tiên. Trong mỗi nhóm mức độ thường gặp, các phản ứng bất lợi của thuốc được xếp theo thứ tự giảm dần mức độ trầm trọng. Hơn nữa, xếp loại các mức độ thường gặp tương ứng với mỗi phản ứng bất lợi dựa vào quy ước sau: rất thường gặp (≥1/10); thường gặp (≥1/100 đến <1/10); ít gặp (≥1/1000 đến <1/100); hiếm gặp (≥1/10000 đến <1/1000); rất hiếm gặp (<1/10000).
- xem Bảng 9.

Mô tả một số phản ứng bất lợi chọn lọc
Nhiễm khuẩn
Trong giai đoạn đối chứng giả dược của các nghiên cứu lâm sang trên bệnh nhân vảy nến thể mảng (tổng số 1.382 bệnh nhân được điều trị với secukinumab và 694 bệnh nhân được điều trị với giả dược trong 12 tuần), nhiễm khuẩn xuất hiện ở 28,7% bệnh nhân được điều trị bằng secukinumab so với 18,9% bệnh nhân điều trị bằng giả dược. Các nhiễm khuẩn chính bao gồm nhiễm khuẩn đường hô hấp trên không nghiêm trọng, từ nhẹ đến trung bình, chẳng hạn như viêm mũi họng và không phải dừng điều trị. Số bệnh nhân bị nhiễm Candida da hoặc niêm mạc tăng, phù hợp với cơ chế hoạt động, nhưng các trường hợp này đều ở mức độ nhẹ hoặc trung bình, không nghiêm trọng, đáp ứng với điều trị chuẩn và không cần phải dừng điều trị. Các nhiễm khuẩn nghiêm trọng xảy ra ở 0,14% bệnh nhân điều trị bằng secukinumab và 0,3% bệnh nhân điều trị bằng giả dược (xem mục Cảnh báo).
Tính trên trọn thời gian điều trị (3.430 bệnh nhân điều trị bằng secukinumab, đa số trong 52 tuần), có 47,5% bệnh nhân nhóm secukinumab (0,9 trên bệnh nhân-năm của giai đoạn theo dõi) được báo cáo là bị nhiễm trùng. Nhiễm trùng nặng được báo cáo là 1,2% bệnh nhân nhóm secukinumab (0,015 trên bệnh nhân-năm của giai đoạn theo dõi).
Tỉ lệ nhiễm trùng được quan sát thấy trong các thử nghiệm lâm sàng về viêm khớp vảy nến và viêm cột sống dính khớp tương tự như trong các nghiên cứu về vảy nến.
Giảm bạch cầu đa nhân trung tính
Trong các nghiên cứu lâm sàng pha 3 về bệnh vảy nến, giảm bạch cầu đa nhân trung tính xuất hiện ở những bệnh nhân điều trị bằng secukinumab nhiều hơn so với nhóm dùng giả dược, nhưng đa số các trường hợp đều nhẹ, thoáng qua và có thể hồi phục. Giảm bạch cầu đa nhân trung tính từ dưới 1,0 đến 0,5x109/l (CTCAE độ 3) đã được báo cáo ở 18 trên 3.430 bệnh nhân (0,5%) dùng secukinumab, không phụ thuộc liều điều trị và không có mối liên quan về thời gian với các bệnh nhiễm khuẩn trên 15 trong số 18 bệnh nhân này. Không có trường hợp giảm bạch cầu đa nhân trung tính nào trầm trọng hơn được báo cáo. Các nhiễm khuẩn không nặng, thường đáp ứng với chăm sóc chuẩn và không cần phải ngừng điều trị secukinumab được báo cáo ở 3 ca bệnh.
Tỉ lệ giảm bạch cầu đa nhân trung tính trong các thử nghiệm lâm sàng về viêm khớp vảy nến và viêm cột sống dính khớp tương tự như trong các nghiên cứu về vảy nến.
Hiếm có các trường hợp giảm bạch cầu đa nhân trung tính dưới 0,5x109/l (CTCAE độ 4) được báo cáo.
Phản ứng quá mẫn: Trong các nghiên cứu lâm sàng, mày đay và các trường hợp hiếm gặp phản ứng phản vệ do secukinumab đã được báo cáo (xem mục Cảnh báo).
Tính sinh miễn dịch: Trong các nghiên cứu lâm sàng về bệnh vảy nến, viêm khớp vảy nến và viêm cột sống dính khớp, dưới 1% bệnh nhân được điều trị bằng secukinumab xuất hiện các kháng thể kháng lại secukinumab cho đến 52 tuần điều trị. Khoảng một nửa các kháng thể kháng thuốc phát sinh trong điều trị này bị trung hòa, nhưng không liên quan với sự giảm hiệu quả hay các bất thường về dược động học.
Bảo quản
Bảo quản ở nhiệt độ từ 2-8oC, bảo quản trong bao bì gốc, tránh ánh sáng. Thuốc được khuyến cáo dùng ngay lập tức sau khi hoàn nguyên. Dung dịch sau khi pha ổn định trong 24 giờ ở nhiệt độ 2-8oC.
Phân loại ATC
L04AC10 - secukinumab
Trình bày/Đóng gói
Bột đông khô pha tiêm: hộp 1 lọ.
- Abacavir
- Abernil
- Abiiogran
- Acarbose
- ACC
- Acebutolol
- Acenocoumarol
- Acetate Ringer's
- Acetazolamide
- Acetylcystein
- Acetylsalicylic acid
- Aciclovir
- Acid acetylsalicylic
- Acid aminocaproic
- Acid ascorbic
- Acid boric
- Acid chenodeoxycholic
- Acid ethacrynic
- Acid folic
- Acid fusidic
- Acid iopanoic
- Acid ioxaglic
- Acid nalidixic
- Acid pantothenic
- Acid para-aminobenzoic
- Acid salicylic
- Acid tranexamic
- Acid valproic
- Acid zoledronic
- Acitretin
- Aclasta
- Aclon
- Actapulgite
- Actelsar
- Actelsar HCT
- Actemra
- Actilyse
- Acular
- Acupan
- Acuvail
- Acyclovir STADA
- Acyclovir STADA Cream
- Adalat
- Adenosin
- Adenosin Ebewe
- Adipiodon
- Advagraf
- Aerius
- Afinitor
- Agicarvir
- Agifovir-E
- Agilosart
- Agilosart-H
- Agimepzol
- Agimosarid
- Agimstan
- Agimstan-H
- Agiremid
- Agivastar
- Aibezym
- Air-X
- Alaxan
- Albendazol
- Albiomin
- Albumin
- Albumin người Grifols 20%
- Albuminar
- AlbuRx
- Albutein
- Alcuronium chloride
- Aldesleukin
- Alendronat
- Alertin
- Alfa-Lipogamma 600 Oral
- Alfuzosin hydrochlorid
- Algotra
- Alimemazin
- Alimta
- Allipem
- Allopurinol
- Allopurinol STADA
- Aloxi
- Alprazolam
- Alpha Chymotrypsin
- Alpha tocopherol
- Alphachymotrypsin Glomed
- Alphagan-P
- Aluvia
- Alzental
- Amaryl
- Ambroco
- Ambroxol
- Amcinol-Paste
- Amigold
- Amikacin
- Aminocaproic acid
- Aminoleban
- Aminoleban Oral
- Aminosteril N-Hepa
- Amiparen
- Amitriptyline
- Amiyu
- Amlodipine
- Amlor
- Amoxicillin
- Amoxicillin & clavulanate
- Ampicillin
- Amquitaz
- Anaferon for children
- Anargil
- Anaropin
- Andriol Testocaps
- Anepzil
- Anyfen
- Apaisac
- Apidra SoloStar
- Apitim 5
- Aprovel
- Aquaphil
- Arcalion
- Arcoxia
- Aricept Evess
- Arimidex
- Arnetine
- Artrodar
- A-Scabs
- Ascorbic acid
- Asperlican/Candinazol
- Aspilets EC
- Aspirin
- Asthmatin
- Atelec
- Atocib 120
- Atocib 90
- Atosiban PharmIdea
- Atozet
- Attapulgite
- Atussin
- Atropin
- Augbactam
- Augmentin Sachet
- Augmentin SR
- Augmentin Tablets
- Augmex
- Avamys
- Avastin
- Avelox Dịch truyền
- Avelox Viên nén
- Avodart
- Axcel Cefaclor-125 Suspension
- Axcel Cetirizine Syrup
- Axcel Chlorpheniramine
- Axcel Dexchlorpheniramine
- Axcel Dicyclomine-S Syrup
- Axcel Diphenhydramine Paediatric Syrup
- Axcel Erythromycin ES
- Axcel Eviline
- Axcel Fungicort Cream
- Axcel Fusidic acid Cream
- Axcel Fusidic acid-B Cream
- Axcel Hydrocortisone Cream
- Axcel Lignocaine 2% Sterile Gel
- Axcel Loratadine
- Axcel Miconazole Cream
- Axcel Paracetamol
- Axcel Urea Cream
- Axitan
- Azenmarol
- Azicine
- Aziphar
- Azithromycin






