Nhà sản xuất
Bayer Pharma AG
Nhà tiếp thị
Bayer (South East Asia)
Thành phần
Mỗi viên: Dienogest 2mg.
Mô tả
Viên nén có màu trắng đến trắng ngà, tròn, bề mặt phẳng, vát cạnh với một mặt được đánh dấu bằng chữ "B" ở một bên và có đường kính 7mm.
Dược lý
Các đặc tính dược lực học
Nhóm dược điều trị: Progestogens
Mã ATC: G03D
Cơ chế tác dụng
Dienogest tác động trên nội mạc tử cung bằng cách giảm sản xuất estradiol nội sinh và do đó ức chế tác dụng sinh dưỡng của estradiol trên nội mạc tử cung cả ở vị trí bình thường và lạc chỗ. Khi được dùng liên tục, dienogest tạo ra một môi trường nội tiết giảm estrogen, tăng progesterone gây phản ứng màng rụng ban đầu của mô nội mạc tử cung, tiếp theo là teo những tổn thương nội mạc. Các đặc tính bổ sung, như các tác dụng trên miễn dịch và chống tạo mạch, dường như góp phần vào tác dụng ức chế của dienogest trên sự nhân lên của tế bào.
Tác dụng dược lực học
Dienogest là một dẫn chất nortestosterone không có hoạt tính androgen mà có hoạt tính kháng androgen tương đương khoảng một phần ba hoạt tính của cyproterone acetate. Dienogest liên kết với các thụ thể progesterone của tử cung người với chỉ 10% ái lực tương đối của progesterone. Mặc dù ái lực thấp với các thụ thể progesterone, dienogest có tác dụng progestogen mạnh in vivo. Dienogest không có hoạt tính androgen, mineralocorticoid hoặc glucocorticoid đáng kể in vivo.
Hiệu quả lâm sàng và độ an toàn
Dữ liệu về hiệu quả
Hiệu quả vượt trội của Visanne so với giả dược về tác dụng giảm đau vùng chậu có liên quan đến lạc nội mạc tử cung (EAPP) và giảm đau có ý nghĩa lâm sàng so với trước điều trị đã được chứng minh trong một nghiên cứu kéo dài 3 tháng bao gồm 102 bệnh nhân dùng Visanne. EAPP được đo trên thang VAS (0-100 mm). Sau 3 tháng điều trị với Visanne, đã chứng minh có khác biệt có ý nghĩa thống kê so với giả dược (Δ = 12,3 mm, 95% CI: 6,4-18,1; p<0,0001) và giảm đau có ý nghĩa lâm sàng so với trước điều trị (giảm trung bình = 27,4 mm ± 22,9).
Sau 3 tháng điều trị, có 37,3% bệnh nhân dùng Visanne (giả dược: 19,8%) có giảm EAPP lớn hơn hoặc bằng 50% mà không làm tăng có ý nghĩa việc sử dụng thuốc giảm đau dùng đồng thời; 18,6% bệnh nhân dùng Visanne (giả dược: 7,3%) có giảm EAPP ở mức 75% trở lên mà không làm tăng có ý nghĩa việc sử dụng thuốc giảm đau dùng đồng thời.
Pha nghiên cứu mở rộng sử dụng nhãn mở của nghiên cứu đối chứng giả dược này cho thấy tiếp tục cải thiện đau vùng chậu liên quan đến lạc nội mạc tử cung trong khoảng thời gian điều trị lên đến 15 tháng (giảm trung bình khi kết thúc điều trị = 43,2±21,7 mm).
Ngoài ra, hiệu quả trên triệu chứng đau vùng chậu liên quan đến lạc nội mạc tử cung đã được thể hiện trong một thử nghiệm kéo dài 6 tháng so sánh Visanne với dẫn chất đồng vận GnRHleuprorelinacetate (LA) bao gồm 120 bệnh nhân sử dụng Visanne. EAPP được đo trên thang VAS (0-100 mm). Đã quan sát thấy giảm đau có ý nghĩa lâm sàng so với ban đầu ở cả hai nhóm điều trị (Visanne: 47,5±28,8 mm, LA: 46,0±24,8 mm). Hiệu quả không thua kém so với LA dựa trên định biên không thua kém được xác định trước là 15 mm đã được chứng minh (p<0,0001).
Ba nghiên cứu bao gồm tổng cộng 252 bệnh nhân dùng một liều hàng ngày 2 mg dienogest đã chứng minh giảm đáng kể các tổn thương lạc nội mạc tử cung sau 6 tháng điều trị.
Một nghiên cứu ngẫu nhiên, mù đôi, nhóm song song (n=20 đến 23 cho mỗi nhóm liều) đã nghiên cứu tác dụng dược lực học của bốn mức liều dienogest (0.5, 1.0, 2.0 hoặc 3.0 mg/ngày) trong tối đa là 72 ngày. Đã quan sát thấy rụng trứng ở 14% và 4% phụ nữ lần lượt ở các nhóm dùng 0,5 mg và 1 mg. Không có sự rụng trứng xảy ra ở nhóm dùng 2 mg và 3 mg. Trong nhóm dùng 2 mg, sự rụng trứng đã được xác nhận ở 80% phụ nữ trong vòng 5 tuần sau khi ngừng điều trị. Visanne chưa được thử nghiệm về hiệu quả ngừa thai trong các nghiên cứu lớn hơn.
Hiệu quả của Visanne đã được chứng minh trong điều trị các triệu chứng liên quan lạc nội mạc tử cung (đau khung xương chậu, đau bụng khi hành kinh và đau khi giao hợp) trong một nghiên cứu 12 tháng trên 111 đối tượng bệnh nhân thanh thiếu niên nữ (sau khi hành kinh tuổi từ 12 đến 18 tuổi).
Dữ liệuvề an toàn
Nồng độ estrogen nội sinh chỉ bị ức chế ở mức độ trung bình trong khi điều trị với Visanne. Mật độ khoáng xương (BMD) đã được đánh giá ở 21 bệnh nhân người lớn trước và sau 6 tháng điều trị và mật độ xương trung bình không bị giảm. Trong một nghiên cứu 12 tháng liên quan đến 103 đối tượng thanh thiếu niên, độ thay đổi tương đối trung bình mật độ xương ở xương sống thắt lưng (L2-L4) so với mức cơ bản (baseline) là 1,2%. Trên một nhóm nhỏ bệnh nhân giảm mật độ xương, một phép đo theo dõi đã được tiến hành trong 6 tháng sau khi kết thúc điều trị và cho thấy sự tăng trở lại mật độ xương đến mức cơ bản (baseline).
Không có tác động đáng kể trên các thông số xét nghiệm tiêu chuẩn, bao gồm huyết học, sinh hóa máu, men gan, các lipid, và HbA1C được quan sát thấy trong khi điều trị với Visanne trong khoảng thời gian lên đến 15 tháng (n=168).
Tính an toàn trên thanh thiếu niên
Tính an toàn của Visanne trên mật độ xương được nghiên cứu trong một thử nghiệm lâm sàng không đối chứng kéo dài 12 tháng trên 111 bệnh nhân thanh thiếu niên (12 tới < 18 tuổi) được chẩn đoán xác định hoặc có nghi ngờ trên lâm sàng lạc nội mạc tử cung. Thay đổi trung bình về mật độ xương thắt lưng (L2-L4) so với lúc chưa điều trị trên 103 bệnh nhân là -1,2%. Trong phân nhóm bệnh nhân có mật độ xương giảm, đo lại mật độ xương 6 tháng sau khi kết thúc điều trị cho thấy mật độ xương tăng tới -0,6%.
Đặc tính dược động học
Hấp thu
Dienogest dùng đường uống được hấp thu nhanh chóng và gần như hoàn toàn. Nồng độ đỉnh 47 ng/mL đạt được khoảng 1,5 giờ sau khi uống liều duy nhất. Sinh khả dụng khoảng 91%. Dược động học của dienogest là tỷ lệ với liều dùng trong khoảng liều 1-8mg.
Phân bố
Dienogest liên kết với albumin huyết thanh và không gắn với globulin gắn hormone sinh dục (sex hormone binding globulin - SHBG) hoặc globulin gắn corticoid (corticoid binding globulin - CBG). 10% tổng nồng độ thuốc trong huyết thanh là hiện diện dưới dạng steroid tự do, 90% liên kết không đặc biệt với albumin.
Thể tích phân bố biểu kiến (Vd/F) của dienogest là 40L.
Chuyển hóa/ Biến đổi sinh học
Dienogest được chuyển hóa hoàn toàn bởi những con đường đã biết của chuyển hóa steroid, với sự tạo thành các chất chuyển hóa phần lớn là không có hoạt tính nội tiết. Dựa trên các nghiên cứu in vitro và in vivo, CYP3A4 là enzyme chủ yếu liên quan đến chuyển hóa của dienogest. Các chất chuyển hóa được bài xuất rất nhanh chóng, do vậy, trong huyết tương, dienogest dạng không đổi là phần chiếm chủ yếu.
Tốc độ thanh thải khỏi huyết thanh qua quá trình chuyển hóa Cl/F là 64mL/phút.
Thải trừ
Nồng độ trong huyết thanh của dienogest giảm theo hai pha. Pha cuối cùng được đặc trưng bởi một thời gian bán thải khoảng 9-10 giờ. Dienogest được bài xuất dưới dạng các chất chuyển hóa được bài xuất qua nước tiểu và qua phân với một tỷ lệ khoảng 3:1 sau khi uống liều 0,1 mg/kg. Thời gian bán thải của quá trình bài xuất chất chuyển hóa trong nước tiểu là 14 giờ. Sau khi uống, khoảng 86% liều dùng được thải trừ trong vòng 6 ngày, phần lớn lượng này được bài xuất trong vòng 24 giờ đầu tiên, chủ yếu qua nước tiểu.
Trạng thái ổn định
Dược động học của dienogest không bị ảnh hưởng bởi nồng độ SHBG. Sau khi uống hàng ngày nồng độ thuốc tăng khoảng 1,24 lần khi đạt được trạng thái ổn định sau 4 ngày điều trị. Dược động học của dienogest sau khi dùng liều lặp lại của Visanne có thể được dự đoán từ dược động học liều duy nhất.
Dữ liệu an toàn tiền lâm sàng
Dữ liệu tiền lâm sàng cho thấy không có nguy cơ đặc biệt đối với người dựa trên các nghiên cứu thông thường về dược lý an toàn, độc tính liều lặp lại, độc tính trên gen, khả năng gây ung thư và độc tính trên sinh sản. Tuy nhiên, cần lưu ý là các steroid sinh dục có thể thúc đẩy sự phát triển của một số các mô và các khối u phụ thuộc hormone.
Chỉ định/Công dụng
Điều trị lạc nội mạc tử cung.
Liều lượng & Cách dùng
Cách dùng: Dùng đường uống.
Chế độ liều
Có thể bắt đầu uống viên nén vào bất cứ ngày nào của chu kỳ kinh nguyệt.
Liều dùng của Visanne là một viên mỗi ngày mà không cần bất kỳ giai đoạn nghỉ nào, tốt nhất là uống cùng một lúc mỗi ngày với một lượng chất lỏng khi cần thiết. Có thể uống thuốc cùng hoặc không cùng thức ăn. Phải uống liên tục các viên, bất kể chảy máu âm đạo hay không. Khi uống hết một vỉ, nên bắt đầu ngay vỉ tiếp theo không có thời gian nghỉ gián đoạn.
Xử lý khi quên liều
Hiệu quả của Visanne có thể bị giảm trong trường hợp bỏ lỡ viên nén, nôn mửa và/hoặc tiêu chảy (nếu xảy ra trong vòng 3-4 giờ sau khi uống viên nén). Trong trường hợp một hoặc nhiều viên bị bỏ lỡ, người phụ nữ chỉ cần uống một viên nén, ngay khi nhớ ra, và sau đó sẽ tiếp tục uống viên thuốc vào ngày hôm sau theo lịch trình bình thường. Nên uống bù viên thuốc không được hấp thu do nôn mửa hoặc tiêu chảy.
Thông tin bổ sung về các quần thể bệnh nhân đặc biệt
Trẻ em và thanh thiếu niên
Visanne không được chỉ định ở trẻ em chưa có kinh nguyệt. Tính an toàn và hiệu quả của Visanne được chứng minh trong nghiên cứu không đối chứng 12 tháng trên 111 nữ thanh thiếu niên (12 < 18 tuổi) được chẩn đoán xác định lạc nội mạc tử cung hoặc nghi ngờ về lâm sàng (xem phần Cảnh báo và Dược lý).
Bệnh nhân cao tuổi
Không có chỉ định sử dụng Visanne phù hợp trong quần thể bệnh nhân cao tuổi.
Bệnh nhân suy gan
Chống chỉ định dùng Visanne ở bệnh nhân hiện tại hay tiền sử bị bệnh gan nặng (xem Chống chỉ định).
Bệnh nhân suy thận
Không có dữ liệu cho thấy cần phải điều chỉnh liều ở bệnh nhân suy thận.
Cảnh báo
Trước khi bắt đầu điều trị bằng Visanne, phải loại trừ tình trạng mang thai (xem phần Sử dụng ở phụ nữ có thai và cho con bú).
Nên dừng các biện pháp tránh thai bằng hormone trước khi bắt đầu điều trị với Visanne. Nếu cần phải tránh thai, nên sử dụng các biện pháp tránh thai không có hormone (ví dụ như phương pháp màng ngăn).
Nếu có thai xảy ra ở phụ nữ sử dụng chế phẩm thuốc tránh thai chỉ chứa progestogen (ví dụ như minipill) thì khả năng có thai ngoài tử cung sẽ cao hơn ở nhóm phụ nữ sử dụng thuốc tránh thai kết hợp. Vì vậy, ở những phụ nữ có tiền sử mang thai ngoài tử cung hoặc suy giảm chức năng vòi trứng, việc sử dụng Visanne cần được quyết định chỉ sau khi cân nhắc cẩn thận những lợi ích so với các nguy cơ.
Do Visanne là một chế phẩm chỉ chứa progestogen, nên có thể xem những cảnh báo đặc biệt và thận trọng đặc biệt đối với việc sử dụng các chế phẩm chỉ chứa progestogen khác cũng có giá trị trong việc sử dụng Visanne mặc dù không phải tất cả những cảnh báo và thận trọng này đều dựa trên những thử nghiệm lâm sàng của Visanne.
Nếu bất kỳ một trong các tình trạng/yếu tố nguy cơ được đề cập dưới đây là hiện có hoặc xấu hơn, nên thực hiện phân tích lợi ích - rủi ro của từng yếu tố trước khi bắt đầu hoặc tiếp tục Visanne.
Các rối loạn tuần hoàn
Từ các nghiên cứu dịch tễ học, có rất ít bằng chứng về mối liên quan giữa các chế phẩm chỉ chứa progestogen và tăng nguy cơ nhồi máu cơ tim hoặc thuyên tắc huyết khối mạch não. Nguy cơ các tai biến tim mạch và não khá liên quan đến sự gia tăng tuổi, tăng huyết áp và hút thuốc. Ở phụ nữ bị tăng huyết áp, nguy cơ đột quỵ có thể tăng nhẹ bởi các thuốc chỉ chứa progestogen.
Một số nghiên cứu chỉ ra rằng có thể có tăng nguy cơ hơn một chút, nhưng không có ý nghĩa thống kê của thuyên tắc huyết khối tĩnh mạch (huyết khối tĩnh mạch sâu, thuyên tắc phổi) liên quan đến việc sử dụng các chế phẩm chỉ có progestogen. Nói chung, các yếu tố nguy cơ được công nhận cho thuyên tắc huyết khối tĩnh mạch (VTE) bao gồm tiền sử cá nhân hoặc tiền sử gia đình bị VTE (VTE ở anh chị em hoặc cha mẹ ở độ tuổi tương đối sớm), tuổi tác, béo phì, bất động kéo dài, đại phẫu hoặc chấn thương nặng. Trong trường hợp bất động kéo dài thì nên ngưng sử dụng Visanne (ít nhất bốn tuần trước trong trường hợp mổ chương trình) và không tiếp tục điều trị cho đến hai tuần sau khi vận động lại hoàn toàn.
Phải xem xét sự gia tăng nguy cơ thuyên tắc huyết khối trong giai đoạn sau sinh.
Nên dừng điều trị ngay lập tức nếu có những triệu chứng của một biến cố huyết khối động mạch hoặc tĩnh mạch hoặc nghi ngờ có những biến cố đó.
Các khối u
Một phân tích gộp từ 54 nghiên cứu dịch tễ học cho thấy có tăng nhẹ nguy cơ tương đối (RR=1,24) của việc chẩn đoán ung thư vú ở những phụ nữ đang sử dụng thuốc tránh thai đường uống (OC), chủ yếu là các chế phẩm có estrogen-progestogen. Nguy cơ này dần dần giảm đi trong khoảng thời gian 10 năm sau khi ngừng sử dụng thuốc tránh thai đường uống phối hợp (COC). Do ung thư vú hiếm gặp ở phụ nữ dưới 40 tuổi, sự tăng nguy cơ chẩn đoán mắc ung thư vú ở người hiện đang sử dụng và sử dụng gần đây COC là nhỏ so với nguy cơ tổng của bệnh ung thư vú. Nguy cơ có chẩn đoán ung thư vú ở người sử dụng thuốc chỉ có progestogen có thể có mức độ tương tự như nguy cơ của COC. Tuy nhiên, so với các COC thì chế phẩm chỉ có progestogen có bằng chứng dựa trên các mẫu dân số nhỏ hơn nhiều và do vậy là ít thuyết phục hơn. Những nghiên cứu này không cung cấp bằng chứng về mối quan hệ nhân quả. Kiểu gia tăng nguy cơ được quan sát có thể là do việc chẩn đoán sớm ung thư vú ở người sử dụng OC, hoặc do các tác dụng sinh học của các OC hoặc kết hợp cả hai. Các trường hợp ung thư vú được chẩn đoán ở những người từng sử dụng có xu hướng ít tiến triển lâm sàng hơn so với các trường hợp ung thư được chẩn đoán ở người chưa bao giờ sử dụng.
Trong những trường hợp hiếm gặp như u gan lành tính, và hiếm hơn nữa là u gan ác tính đã được báo cáo ở những người dùng các thành phần hormon như thành phần trong Visanne.
Trong một số trường hợp cá biệt, những khối u này dẫn đến xuất huyết trong ổ bụng đe dọa tính mạng. Một khối u gan nên được xem xét trong chẩn đoán phân biệt khi có đau nặng ở vùng bụng trên, gan to hoặc có các dấu hiệu xuất huyết trong ổ bụng xảy ra ở phụ nữ đang dùng Visanne.
Những thay đổi trong chảy máu kinh nguyệt
Điều trị Visanne ảnh hưởng đến kiểu chảy máu kinh nguyệt ở đa số các phụ nữ (xem phần Tác dụng ngoại ý).
Chảy máu nặng ở tử cung
Chảy máu tử cung, ví dụ như phụ nữ có lạc nội mạc trong cơ tử cung (bệnh cơ tuyến tử cung) hoặc u xơ tử cung, có thể trầm trọng khi sử dụng Visanne. Nếu chảy máu nặng và liên tục theo thời gian, có thể dẫn đến thiếu máu (mức độ nặng trong một số trường hợp). Cần xem xét ngừng Visanne trong trường hợp này.
Thay đổi mật độ xương (BMD)
Việc sử dụng Visanne ở bệnh nhân thanh thiếu niên (12 - < 18 tuổi) trên 12 tháng điều trị dẫn đến sự giảm sút mật độ xương (Bone Minera Density – BMD) ở xương sống thắt lưng (L2-L4). Mức thay đổi trung bình của mật độ xương từ lúc bắt đầu điều trị tới lúc kết thúc điều trị là -1,2% trong khoảng giữa -6% và 5% (khoảng tin cậy IC 95%: -1,70% và -0,78%, n=103). Đo lại mật độ xương vào thời điểm 6 tháng sau khi kết thúc điều trị ở nhóm bệnh nhân bị giảm mật độ xương cho thấy có khuynh hướng hồi phục (thay đổi trung bình so với lúc ban đầu: -2,3% tại thời điểm kết thúc điều trị và -0,6% tại thời điểm 6 tháng sau khi kết thúc điều trị với khoảng giữa -9% và 6% (IC 95%: -1,20% và 0,06%, n=60). Giảm mật độ xương là điều đáng lưu tâm riêng cho đối tượng bệnh nhân thanh thiếu niên và đầu độ tuổi trưởng thành – giai đoạn then chốt của quá trình phát triển xương. Chưa biết liệu việc giảm mật độ xương ở những đối tượng này có làm giảm khối lượng xương tối đa và tăng nguy cơ gãy xương trong cuộc sống sau này hay không (xem mục “Bệnh nhân nhi khoa” và “Dược lực học”).
Trên những bệnh nhân có tăng nguy cơ loãng xương nên đánh giá cẩn thận nguy cơ – lợi ích trước khi bắt đầu điều trị Visanne bởi vì nồng độ estrogen nội sinh giảm không nhiều lắm trong quá trinh điều trị với Visanne (xem mục Dược lực học).
Dùng đầy đủ Calcium và Vitamin D, trong khẩu phần ăn hay phần bổ sung, là yếu tố quan trọng cho sức khỏe xương ở phụ nữ tất cả các lứa tuổi.
Các bệnh lý khác
Những bệnh nhân có tiền sử trầm cảm nên được theo dõi cẩn thận và ngừng thuốc nếu trầm cảm tái diễn với mức độ nghiêm trọng.
Nói chung, Visanne dường như không ảnh hưởng đến huyết áp ở phụ nữ có huyết áp bình thường. Tuy nhiên, nếu tăng huyết áp đáng kể về mặt lâm sàng vẫn tiếp tục diễn ra trong khi sử dụng Visanne, nên ngừng Visanne và điều trị tăng huyết áp.
Cần ngừng Visanne khi có tái phát vàng da ứ mật và/hoặc ngứa mà hiện tượng này xảy ra lần đầu tiên trong quá trình mang thai hoặc đợt sử dụng trước đó của các steroid sinh dục.
Visanne có thể có một tác dụng nhẹ trên kháng insulin ngoại vi và dung nạp glucose. Phụ nữ mắc bệnh đái tháo đường, đặc biệt là những người có tiền sử đái tháo đường thai kỳ, nên được theo dõi cẩn thận trong khi dùngVisanne.
Sạm da đôi khi có thể xảy ra, đặc biệt là ở những phụ nữ có tiền sử sạm da thai kỳ. Phụ nữ có xu hướng sạm da nên tránh tiếp xúc với ánh nắng mặt trời hoặc bức xạ tia cực tím khi đang dùng Visanne.
Nang buồng trứng kéo dài (thường được gọi là u nang buồng trứng chức năng) có thể xảy ra trong khi sử dụng Visanne. Hầu hết các nang này không có triệu chứng, mặc dù một số có thể kèm theo đau vùng chậu.
Lactose
Mỗi viên Visanne chứa 62,8mg lactose monohydrate. Nên cân nhắc tới điều này khi sử dụng Visanne ở những bệnh nhân có vấn đề về di truyền không dung nạp galactose, bệnh nhân có sự thiếu hụt Lapp lactase hoặc chứng kém hấp thu glucose-galactose ở những bệnh nhân ăn kiêng không có lactose.
Thăm khám y tế
Trước khi bắt đầu hoặc tái sử dụng Visanne, cần biết toàn bộ bệnh sử và cần khám sức khỏe và khám phụ khoa theo định hướng bởi các chống chỉ định (xem phần Chống chỉ định) và các cảnh báo (xem phần Cảnh báo) và những thăm khám này cần tiến hành định kỳ trong quá trình sử dụng Visanne. Tần suất và tính chất của những đánh giá này nên được điều chỉnh phù hợp với từng cá thể người phụ nữ nhưng nói chung nên bao gồm liên quan đặc biệt đến huyết áp, vú, các cơ quan vùng bụng và vùng chậu, và cũng nên bao gồm tế bào cổ tử cung.
Tác dụng trên khả năng lái xe và vận hành máy móc
Chưa ghi nhận tác động lên khả năng lái xe và vận hành máy móc của sản phẩm chứa dienogest.
Quá Liều
Các nghiên cứu độc tính cấp tính thực hiện với Visanne đã không chỉ ra một nguy cơ tác dụng có hại cấp tính trong trường hợp vô ý uống một liều gấp nhiều lần liều điều trị hàng ngày. Không có thuốc giải độc đặc hiệu. 20-30 mg dienogest mỗi ngày (liều cao hơn 10 đến 15 lần trong Visanne) trong 24 tuần sử dụng đều được dung nạp rất tốt.
Chống chỉ định
Cũng như các chế phẩm chỉ có progestogen khác, không nên sử dụng Visanne khi có bất kỳ tình trạng nào được liệt kê dưới đây. Bất kỳ tình trạng nào xuất hiện trong quá trình sử dụng Visanne, phải ngưng điều trị ngay lập tức.
• Bệnh lý thuyên tắc huyết khối tĩnh mạch tiến triển
• Hiện có hoặc tiền sử có bệnh động mạch và bệnh tim mạch (ví dụ như nhồi máu cơ tim, tai biến mạch máu não, bệnh tim thiếu máu cục bộ)
• Đái tháo đường có biến chứng mạch máu
• Hiện có hoặc tiền sử bị bệnh gan nặng, với chức năng gan chưa trở lại bình thường
• Hiện có hoặc tiền sử bị u gan (lành tính hoặc ác tính)
• Đã biết hoặc nghi ngờ bị các loại ung thư phụ thuộc hormone sinh dục
• Chảy máu âm đạo chưa được chẩn đoán
• Quá mẫn với hoạt chất hoặc bất kỳ tá dược nào.
Sử dụng ở phụ nữ có thai và cho con bú
Phụ nữ có thai
Có ít dữ liệu từ việc sử dụng dienogest ở phụ nữ mang thai. Các nghiên cứu trên động vật và dữ liệu từ những phụ nữ tiếp xúc với dienogest trong khi mang thai cho thấy không có nguy cơ đặc biệt trên mang thai, sự phát triển của phôi/thai, quá trình sinh nở hoặc quá trình phát triển sau khi sinh ở người (xem Dữ liệu an toàn tiền lâm sàng). Tuy nhiên, không nên dùng Visanne cho phụ nữ mang thai vì không có nhu cầu điều trị lạc nội mạc tử trong khi mang thai.
Phụ nữ cho con bú
Không khuyến cáo điều trị bằng Visanne trong thời kỳ cho con bú. Các đặc tính hoá lý và dữ liệu trên động vật cho thấy dienogest bài xuất trong sữa mẹ. Phải quyết định là ngừng cho con bú hoặc không điều trị Visanne, có cân nhắc đến lợi ích của việc cho con bú đối với trẻ và lợi ích của điều trị đối với người phụ nữ.
Khả năng sinh sản
Dựa trên dữ liệu có sẵn, sự rụng trứng bị ức chế ở phần lớn các bệnh nhân trong khi điều trị với Visanne. Tuy nhiên, Visanne không phải là một thuốc tránh thai. Nếu cần thiết phải tránh thai, nên sử dụng phương pháp không có hormon (xem phần Cảnh báo). Dựa trên dữ liệu hiện có, chu kỳ kinh nguyệt trở lại bình thường trong vòng 2 tháng sau khi ngừng điều trị bằng Visanne.
Tương tác
Lưu ý: Cần tham khảo thông tin kê đơn của các thuốc dùng cùng để xác định những tương tác thuốc có khả năng xảy ra.
Tác dụng của loại thuốc khác trên Visanne
Progestins bao gồm dienogest được chuyển hóa chủ yếu bởi hệ thống cytochrome P450 3A4(CYP3A4) nằm cả ở niêm mạc ruột và trong gan. Do đó, các thuốc gây cảm ứng hoặc ức chế CYP3A4 có thể ảnh hưởng đến chuyển hóa thuốc progestogen.
Tăng thanh thải các hormone sinh dục do cảm ứng enzyme có thể làm giảm hiệu quả điều trị của Visanne và có thể gây ra các tác dụng không mong muốn ví dụ như những thay đổi trong kiểu chảy máu tử cung.
Giảm thanh thải các hormone sinh dục do ức chế enzyme có thể làm tăng mức độ tiếp xúc với dienogest và có thể gây ra các tác dụng không mong muốn.
- Các chất làm tăng thanh thải hormone sinh dục (giảm hiệu quả bởi sự cảm ứng enzyme), ví dụ: Phenytoin, barbiturate, primidone, carbamazepine, rifampicin, và cũng có thể với oxcarbazepine, topiramate, felbamate, griseofulvin.
Sự cảm ứng enzyme có thể quan sát thấy sau một vài ngày điều trị. Sự cảm ứng enzyme tối đa thường được quan sát thấy trong vòng một vài tuần. Sau khi kết thúc quá trình điều trị, sự cảm ứng enzyme có thể tiếp tục duy trì trong khoảng 4 tuần.
Tác động của chất cảm ứng CYP 3A4 rifampicin được nghiên cứu trên người mãn kinh khỏe mạnh. Dùng chung rifampicin với viên chứa estradiol valerate/dienogest dẫn tới giảm đáng kể nồng độ ở trạng thái hằng định và nồng độ toàn thân của dienogest. Nồng độ toàn thân của dienogest và estradiol ở trạng thái hằng định, đo bởi AUC (0-24giờ), giảm tương ứng khoảng 83% và 44%.
- Các chất có ảnh hưởng khác nhau đến độ thanh thải của hormone sinh dục, ví dụ:
Khi dùng đồng thời với hormone sinh dục, nhiều chất ức chế protease HIV/HCV và chất ức chế sao chép ngược không phải nucleoside có thể làm tăng hoặc giảm nồng độ progestin trong huyết tương. Những thay đổi này có thể có liên quan về mặt lâm sàng trong một vài trường hợp.
- Các chất làm giảm thanh thải hormone sinh dục (chất ức chế enzyme)
Dienogest là chất nền của cytochrome P450 (CYP) 3A4.
Sự tương quan về mặt lâm sàng của tương tác có thể xảy ra với các thuốc ức chế men còn chưa biết.
Dùng cùng với các thuốc ức chế mạnh CYP3A4 có thể làm tăng nồng độ huyết tương của dienogest.
Chất ức chế CYP3A4 trung bình và mạnh như các thuốc kháng nấm nhóm azole (ví dụ itraconazole, voriconazole, fluconazole), verapamil, các macrolide (ví dụ clarithromycin, erythromycin), diltiazem và nước ép bưởi có thể làm tăng nồng độ huyết tương của progestin.
Trong nghiên cứu chứng minh tác động của các thuốc ức chế CYP3A4 (ketoconazole, erythromycin) lên thuốc phối hợp estradiol valerate/dienogest, nồng độ huyết tương ở trạng thái hằng định của dienogest tăng. Dùng cùng với thuốc ức chế mạnh ketoconazole làm tăng AUC (0-24giờ) ở trạng thái hằng định của dienogest lên 2,86 lần. Khi dùng cùng với thuốc ức chế vừa như erythromycin, AUC (0-24giờ) của dienogest ở trạng thái hằng định tăng 1,62 lần. Sự liên quan về mặt lâm sàng của những tương tác này vẫn chưa được biết.
Tác dụng của Visanne trên các thuốc khác
Dựa trên các nghiên cứu ức chế in vitro, không có tương tác có ý nghĩa lâm sàng của Visanne với chuyển hóa qua trung gian enzym cytochrome P450 của các thuốc khác.
Tương tác thuốc-thức ăn
Một bữa ăn nhiều chất béo được tiêu chuẩn hóa không làm ảnh hưởng đến sinh khả dụng của Visanne.
Các dạng tương tác khác
Việc sử dụng các progestins có thể ảnh hưởng đến kết quả xét nghiệm, bao gồm cả các thông số sinh hóa của gan, tuyến giáp, tuyến thượng thận và chức năng thận, nồng độ trong huyết tương của (chất mang) protein, ví dụ: các thành phần của lipid/lipoprotein, các thông số của quá trình chuyển hóa carbohydrate và các thông số đông máu và ly giải fibrin. Nói chung, những thay đổi vẫn nằm trong phạm vi giá trị xét nghiệm thông thường.
Tác dụng ngoại ý
Tóm tắt về tính an toàn
Các tác dụng không mong muốn phổ biến hơn trong những tháng đầu tiên sau khi bắt đầu uống Visanne, và giảm dần theo thời gian điều trị. Các tác dụng không mong muốn sau đây đã được báo cáo ở những người dùng Visanne.
Các tác dụng không mong muốn được báo cáo thường xuyên nhất trong quá trình điều trị, được đánh giá ít nhất là có thể có liên quan đến Visanne là nhức đầu (9,0%), khó chịu ở vú (5,4%), tâm trạng chán nản (5,1%), và mụn trứng cá (5,1%).
Ngoài ra, phần lớn bệnh nhân điều trị với Visanne có thay đổi về kiểu chảy máu trong kỳ kinh nguyệt. Các kiểu chảy máu trong kỳ kinh nguyệt được đánh giá một cách hệ thống sử dụng nhật ký của bệnh nhân và được phân tích sử dụng phương pháp đánh giá của WHO trong giai đoạn 90 ngày đầu sử dụng nội tiết.
Trong vòng 90 ngày điều trị với Visanne, các kiểu chảy máu sau đây được ghi nhận (n=290, 100%): mất kinh (1,7%), chảy máu không thường xuyên (27,2%), chảy máu thường xuyên (13,4%), chảy máu không đều (35,2%), chảy máu kéo dài (38,3%), chảy máu bình thường (24,2%), nghĩa là không thuộc các loại trên (22,8%).
Các thay đổi về các kiểu chảy máu thỉnh thoảng được ghi nhận từ bệnh nhân như phản ứng có hại (xem bảng phản ứng có hại dưới đây).
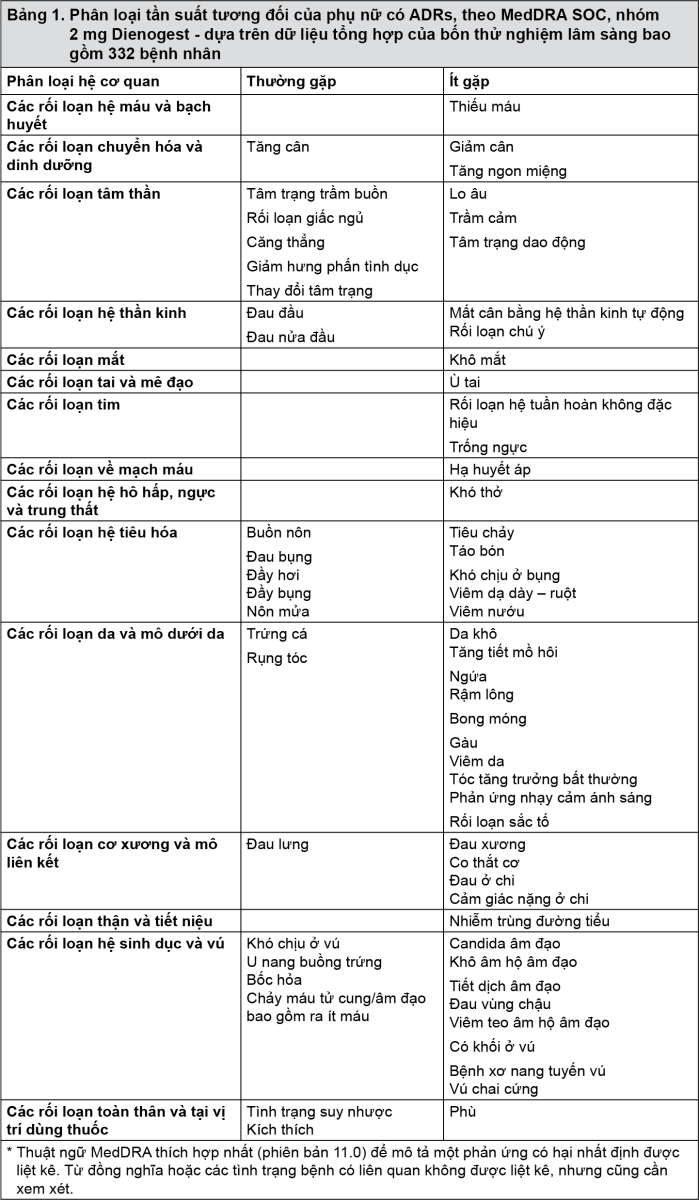
Bảng các phản ứng có hại
Bảng 1, tần suất của các phản ứng có hại của thuốc (ADR) phân loại theo hệ cơ quan MedDRA (MedDRA SOC) được báo cáo với Visanne được tóm tắt trong bảng dưới đây.
Trong mỗi nhóm tần số, các tác dụng không mong muốn được thể hiện theo thứ tự tần suất giảm dần.
Tần suất được xác định là thường gặp (≥1/100 đến <1/10) và ít gặp (≥1/1000 đến <1/100).
*Các tần số được tính dựa trên dữ liệu gộp của bốn thử nghiệm lâm sàng bao gồm 332 bệnh nhân (100,0%).
- xem Bảng 1.
Mô tả các phản ứng có hại được lựa chọn
Chảy máu tử cung bất thường
Các kiểu chảy máu sau đây đã được quan sát thấy: Vô kinh, chảy máu không thường xuyên, chảy máu thường xuyên, chảy máu bất thường, ra huyết kéo dài.
Giảm mật độ xương
Trong nghiên cứu không đối chứng trên 111 thanh thiếu niên nữ (12 tới <18 tuổi) được điều trị với Visanne, 103 bệnh nhân được đo mật độ xương. Khoảng 72% những người tham gia nghiên cứu này có mật độ xương thắt lưng (L2-L4) giảm sau 12 tuần sử dụng (xem phần Cảnh báo).
Bảo quản
Bảo quản dưới 30oC.
Phân loại ATC
G03DB08 - dienogest
Trình bày/Đóng gói
Viên nén: hộp 2 vỉ x 14 viên.
- Abacavir
- Abernil
- Abiiogran
- Acarbose
- ACC
- Acebutolol
- Acenocoumarol
- Acetate Ringer's
- Acetazolamide
- Acetylcystein
- Acetylsalicylic acid
- Aciclovir
- Acid acetylsalicylic
- Acid aminocaproic
- Acid ascorbic
- Acid boric
- Acid chenodeoxycholic
- Acid ethacrynic
- Acid folic
- Acid fusidic
- Acid iopanoic
- Acid ioxaglic
- Acid nalidixic
- Acid pantothenic
- Acid para-aminobenzoic
- Acid salicylic
- Acid tranexamic
- Acid valproic
- Acid zoledronic
- Acitretin
- Aclasta
- Aclon
- Actapulgite
- Actelsar
- Actelsar HCT
- Actemra
- Actilyse
- Acular
- Acupan
- Acuvail
- Acyclovir STADA
- Acyclovir STADA Cream
- Adalat
- Adenosin
- Adenosin Ebewe
- Adipiodon
- Advagraf
- Aerius
- Afinitor
- Agicarvir
- Agifovir-E
- Agilosart
- Agilosart-H
- Agimepzol
- Agimosarid
- Agimstan
- Agimstan-H
- Agiremid
- Agivastar
- Aibezym
- Air-X
- Alaxan
- Albendazol
- Albiomin
- Albumin
- Albumin người Grifols 20%
- Albuminar
- AlbuRx
- Albutein
- Alcuronium chloride
- Aldesleukin
- Alendronat
- Alertin
- Alfa-Lipogamma 600 Oral
- Alfuzosin hydrochlorid
- Algotra
- Alimemazin
- Alimta
- Allipem
- Allopurinol
- Allopurinol STADA
- Aloxi
- Alprazolam
- Alpha Chymotrypsin
- Alpha tocopherol
- Alphachymotrypsin Glomed
- Alphagan-P
- Aluvia
- Alzental
- Amaryl
- Ambroco
- Ambroxol
- Amcinol-Paste
- Amigold
- Amikacin
- Aminocaproic acid
- Aminoleban
- Aminoleban Oral
- Aminosteril N-Hepa
- Amiparen
- Amitriptyline
- Amiyu
- Amlodipine
- Amlor
- Amoxicillin
- Amoxicillin & clavulanate
- Ampicillin
- Amquitaz
- Anaferon for children
- Anargil
- Anaropin
- Andriol Testocaps
- Anepzil
- Anyfen
- Apaisac
- Apidra SoloStar
- Apitim 5
- Aprovel
- Aquaphil
- Arcalion
- Arcoxia
- Aricept Evess
- Arimidex
- Arnetine
- Artrodar
- A-Scabs
- Ascorbic acid
- Asperlican/Candinazol
- Aspilets EC
- Aspirin
- Asthmatin
- Atelec
- Atocib 120
- Atocib 90
- Atosiban PharmIdea
- Atozet
- Attapulgite
- Atussin
- Atropin
- Augbactam
- Augmentin Sachet
- Augmentin SR
- Augmentin Tablets
- Augmex
- Avamys
- Avastin
- Avelox Dịch truyền
- Avelox Viên nén
- Avodart
- Axcel Cefaclor-125 Suspension
- Axcel Cetirizine Syrup
- Axcel Chlorpheniramine
- Axcel Dexchlorpheniramine
- Axcel Dicyclomine-S Syrup
- Axcel Diphenhydramine Paediatric Syrup
- Axcel Erythromycin ES
- Axcel Eviline
- Axcel Fungicort Cream
- Axcel Fusidic acid Cream
- Axcel Fusidic acid-B Cream
- Axcel Hydrocortisone Cream
- Axcel Lignocaine 2% Sterile Gel
- Axcel Loratadine
- Axcel Miconazole Cream
- Axcel Paracetamol
- Axcel Urea Cream
- Axitan
- Azenmarol
- Azicine
- Aziphar
- Azithromycin