Nhà sản xuất
Janssen-Cilag
Nhà phân phối
DKSH
Thành phần
Mỗi viên: Itraconazol (dạng vi hạt) 100mg.
Mô tả
Viên nang với nắp nang màu xanh đục và thân nang màu hồng trong suốt.
Dược lực học
Phân loại dược lý điều trị: Thuốc kháng nấm dùng đường toàn thân, dẫn xuất triazol.
Mã ATC: J02A C02
Cơ chế tác dụng: Các nghiên cứu in vitro cho thấy itraconazol làm giảm tổng hợp ergosterol trong tế bào vi nấm. Ergosterol là một thành phần thiết yếu của màng tế bào vi nấm. Sự suy giảm tổng hợp này tạo nên hiệu quả kháng nấm.
Mối quan hệ Dược động học (PK)/Dược lực học (PD): Mối quan hệ PK/PD của itraconazol và của nhóm các triazol nói chung ít được hiểu rõ.
Tác dụng dược lực học:
Vi sinh
Itraconazol, một dẫn xuất triazol, có phổ kháng nấm rộng.
Đối với itraconazol, điểm thiết lập độ nhạy với thuốc (breakpoint) chỉ được thiết lập cho Candida spp. từ các loại nhiễm nấm nông (CLSI M27-A2). Điểm breakpoint theo CLSI như sau: nhạy cảm ≤0,125; nhạy cảm phụ thuộc liều 0,25-0,5 và đề kháng ≥1mcg/mL. Các điểm breakpoint có thể diễn dịch đã không được thiết lập theo CLSI cho nấm sợi.
Điểm breakpoint theo EUCAST cho itraconazol đã được thiết lập cho Aspergillus flavus, A. fumigatus, A. nidulans và A. terreus, như sau: nhạy cảm ≤1mg/L, đề kháng >2mg/L. Điểm breakpoint theo EUCAST chưa được thiết lập cho itraconazol và Candida spp.
Các nghiên cứu in vitro cho thấy rằng itraconazol ức chế sự phát triển của nhiều loại vi nấm gây bệnh cho người ở nồng độ thông thường ≤1mcg/mL. Các vi nấm này bao gồm: Candida spp. (bao gồm Candida albicans, Candida tropicalis, Candida parapsilosis, và Candida dubliniensis), Aspergillus spp., Blastomyces dermatitidis, Cladosporium spp., Coccidioides immitis, Cryptococus neoformans, Geotrichum spp., Histoplasma spp., bao gồm H. capsulatum, Paracoccidioides brasiliensis, Penicillium marneffei, Sporothrix schenekii và Trichosporon spp. Trên thử nghiệm in vitro, itraconazol cũng có hoạt tính đối với Epidermophyton floccosum, Fonsecaea spp., Malassezia spp., Microsporum spp., Pseudallescheria boydii, Trichophyton spp. và các loại nấm men và vi nấm khác.
Candida krusei, Candida glabrata và Candida guillermondii thường là các chủng Candida kém nhạy cảm nhất, ở vài thử nghiệm phân lập in vitro cho thấy chúng đề kháng không rõ rệt với itraconazol.
Các loại vi nấm chính không bị ức chế với itraconazol là Zygomycetes (như Rhizopus spp., Rhizomucor spp., Mucor spp. và Absidia spp.), Fusarium spp., Scedosporium spp. và Scopulariopsis spp.
Sự đề kháng azol có vẻ hình thành chậm và thường là kết quả của vài đột biến gen. Các cơ chế được mô tả như là sự biểu hiện quá mức của ERG11 làm mã hóa enzym đích 14α-demethylase, đột biến điểm trong ERG11 dẫn đến sự giảm ái lực đích và/hoặc sự biểu hiện quá mức của chất vận chuyển dẫn đến tăng bơm ra ngoài. Đề kháng chéo giữa các azol đã được quan sát thấy ở Candida spp., mặc dù sự đề kháng của 1 thuốc trong nhóm không nhất thiết có nghĩa là đề kháng với các azol khác. Chủng nấm Aspergillus fumigatus đã được báo cáo có đề kháng với itraconazol.
Dược động học
Đặc tính dược động học tổng quát: Nồng độ đỉnh trong huyết tương của itraconazol đạt được trong khoảng 2 đến 5 giờ sau khi uống thuốc. Do đặc tính động học không tuyến tính, itraconazol tích lũy trong huyết tương khi sử dụng đa liều. Nhìn chung, nồng độ trong trạng thái hằng định đạt được khoảng 15 ngày, với giá trị Cmax 0,5mcg/mL; 1,1mcg/mL và 2,0mcg/mL tương ứng với sau khi uống liều 100mg x 1 lần/ngày, 200mg x 1 lần/ngày và 200mg x 2 lần/ngày. Thời gian bán hủy cuối của itraconazol thường trong khoảng 16 đến 28 giờ sau khi sử dụng đơn liều và tăng lên 34 đến 42 giờ sau khi sử dụng liều lặp lại. Ngay khi ngừng điều trị, nồng độ itraconazol trong huyết tương giảm xuống đến nồng độ hầu như không còn phát hiện được trong 7 đến 14 ngày, tùy thuộc vào liều và thời gian điều trị. Tổng độ thanh thải trung bình của itraconazol sau khi dùng đường tĩnh mạch là 278mL/phút. Độ thanh thải của itraconazol giảm ở liều cao hơn vì chuyển hóa ở gan có thể bị bão hòa.
Hấp thu: Itraconazol được hấp thu nhanh sau khi uống. Nồng độ đỉnh trong huyết tương của thuốc không biến đổi đạt được trong vòng 2 đến 5 giờ sau uống 1 viên nang. Sinh khả dụng tuyệt đối đường uống của itraconazol khoảng 55%, sinh khả dụng đường uống đạt tối đa khi viên nang được uống ngay sau khi ăn no.
Sự hấp thu của viên nang itraconazol giảm ở những bệnh nhân giảm acid dịch vị, như những bệnh nhân uống những thuốc đã biết ức chế tiết acid dịch vị (như thuốc đối kháng thụ thể H2, ức chế bơm proton) hoặc những bệnh nhân thiếu toan dịch vị do một số bệnh (xem Cảnh báo và Tương tác). Hấp thu của itraconazol khi đói ở những bệnh nhân này tăng lên khi uống viên nang SPORAL cùng với đồ uống có tính acid (như là nước uống giải khát cola). Khi uống viên nang SPORAL với liều đơn 200mg lúc đói với nước giải khát cola sau khi điều trị bằng ranitidin, một chất đối kháng thụ thể H2, sự hấp thu của itraconazol tương đương khi uống một mình SPORAL (xem Tương tác).
Nồng độ itraconazol trong máu là thấp đối với dạng viên nang so với dạng dung dịch uống khi dùng cùng mức liều (xem Cảnh báo).
Phân bố: Hầu hết itraconazol kết hợp với protein huyết tương (99,8%) chủ yếu là với albumin (99,6% ở dạng chất chuyển hóa hydroxy). Nó có ái lực mạnh với lipid. Chỉ 0,2% itraconazol trong huyết tương tồn tại dưới thuốc dạng tự do. Itraconazol được phân bố khắp toàn bộ cơ thể (>700L) cho thấy khả năng phân bố rộng rãi đến các mô. Nồng độ ở phổi, thận, gan, xương, dạ dày, lách và cơ cao gấp 2 đến 3 lần nồng độ ở huyết tương, và gấp 4 lần phân bố ở mô sừng, đặc biệt ở da. Nồng độ trong dịch não tủy thấp hơn nhiều so với trong huyết tương, nhưng đã được chứng minh có hiệu quả chống nhiễm khuẩn ở dịch não tủy.
Chuyển hóa: Itraconazol được chuyển hóa mạnh mẽ ở gan thành nhiều chất chuyển hóa. Các nghiên cứu in vitro đã cho thấy CYP3A4 là enzym chuyển hóa chính có liên quan đến sự chuyển hóa của itraconazol. Chất chuyển hóa chính là hydroxy-itraconazol có hoạt tính kháng nấm in vitro tương đương itraconazol; nồng độ đáy của chất chuyển hóa này trong huyết tương gấp 2 lần itraconazol.
Thải trừ: Itraconazol được thải trừ chủ yếu dưới dạng chất chuyển hóa không hoạt tính trong nước tiểu (35%) và phân (54%) trong vòng 1 tuần sau khi uống một liều dung dịch. Sự thải trừ qua thận của itraconazol và chất chuyển hóa có hoạt tính hydroxy-itraconazol thấp hơn 1% so với dùng đường tĩnh mạch. Dựa trên một liều thuốc đánh dấu phóng xạ đường uống, sự thải trừ qua phân của thuốc không chuyển hóa khoảng 3% đến 18% liều dùng.
Sự tái phân phối của itraconazol từ tổ chức sừng là không đáng kể, sự thải trừ của itraconazol từ tổ chức này liên quan đến sự tái sinh của biểu bì. Ngược lại với huyết tương, nồng độ thuốc tồn tại ở da khoảng 2 đến 4 tuần sau khi kết thúc liệu trình điều trị 4 tuần và ở tổ chức sừng của móng, nơi mà itraconazol có thể phát hiện rất sớm chỉ 1 tuần sau khi bắt đầu điều trị, nồng độ thuốc tồn tại thêm ít nhất là 6 tháng sau khi kết thúc liệu trình điều trị 3 tháng.
Nhóm bệnh nhân đặc biệt
Suy gan: Itraconazol được chuyển hóa chủ yếu ở gan. Một nghiên cứu dược động học đã được tiến hành trên 6 người khỏe mạnh và 12 bệnh nhân xơ gan uống liều duy nhất 100mg itraconazol dạng viên nang. Đã thấy Cmax trung bình giảm đáng kể (47%) có ý nghĩa thống kê và thời gian bán thải tăng hai lần (37±17 giờ so với 16±5 giờ) ở người xơ gan so với người khỏe mạnh. Tuy nhiên, dựa trên AUC, nồng độ trong máu chung của itraconazol là như nhau ở nhóm xơ gan và nhóm khỏe mạnh. Không có dữ liệu về việc dùng itraconazol lâu dài ở nhóm xơ gan (xem Liều lượng và Cách dùng và Cảnh báo).
Suy thận: Có ít dữ liệu về việc sử dụng itraconazol đường uống cho bệnh nhân suy thận. Một nghiên cứu dược động học sử dụng liều duy nhất 200mg itraconazol (4 viên nang 50mg) đã được tiến hành trên 3 nhóm bệnh nhân suy thận (ure huyết: n=7; thẩm tách máu: n=7 và thẩm phân phúc mạc liên tục ngoại trú: n=5). Ở nhóm bệnh nhân ure huyết với độ thanh thải creatinin trung bình là 13mL/phút x 1,73m2, nồng độ, dựa trên giá trị AUC, giảm nhẹ so với nhóm bình thường. Nghiên cứu này không khẳng định bất kỳ ảnh hưởng đáng kể nào của thẩm tách máu hay thẩm tách phúc mạc liên tục ngoại trú đối với dược động học của itraconazol (Tmax, Cmax và AUC0-8h). Thông tin về nồng độ trong huyết tương theo thời gian cho thấy sự khác biệt lớn giữa các đối tượng ở cả 3 nhóm.
Sau một liều duy nhất đường tĩnh mạch, thời gian bán hủy trung bình của itraconazol ở những bệnh nhân suy thận nhẹ (định nghĩa trong nghiên cứu này là CrCL 50-79mL/phút), trung bình (định nghĩa trong nghiên cứu này là CrCl 20-49mL/phút) và suy thận nặng (định nghĩa trong nghiên cứu này là CrCl <20mL/phút) là tương tự như ở những người khỏe mạnh (ngưỡng trung bình lần lượt là 42-49 giờ ở những bệnh nhân suy thận và 48 giờ ở người khỏe mạnh). Nồng độ trong máu của itraconazol, dựa trên AUC, giảm ở những bệnh nhân suy thận trung bình khoảng 30% và suy thận nặng khoảng 40% so với những người có chức năng thận bình thường.
Chưa có dữ liệu ở những bệnh nhân suy thận điều trị lâu dài với itraconazol. Lọc thận không có tác động trên thời gian bán hủy hay thanh thải itraconazol hoặc hydroxy-itraconazol (xem Liều lượng và Cách dùng và Cảnh báo).
Bệnh nhân nhi: Dữ liệu dược động học khi sử dụng itraconazol trên nhóm bệnh nhân nhi còn hạn chế. Những nghiên cứu dược động học lâm sàng ở trẻ em và thanh thiếu niên ở độ tuổi từ 5 tháng đến 17 tuổi tiến hành với itraconazol viên nang, dung dịch uống hoặc đường tĩnh mạch. Liều cho mỗi bệnh nhân dùng viên nang và dung dịch uống là từ 1,5 đến 12,5mg/kg/ngày, 1 hoặc 2 lần/ngày. Dạng dùng tĩnh mạch được truyền liều duy nhất 2,5mg/kg hoặc 2,5mg/kg truyền 1 hoặc 2 lần mỗi ngày. Đối với liều hàng ngày giống nhau, liều hai lần/ngày so với liều một lần/ngày cho nồng độ đáy và nồng độ đỉnh tương đương với người lớn dùng một liều hàng ngày. Không thấy có sự phụ thuộc đáng kể vào lứa tuổi đối với AUC và tổng lượng thanh thải toàn cơ thể, trong khi ghi nhận được sự liên hệ mờ nhạt giữa tuổi và thể tích phân bố itraconazol, Cmax và tốc độ thải trừ giai đoạn cuối. Độ thanh thải biểu kiến và thể tích phân bố của itraconazol dường như liên quan đến trọng lượng cơ thể.
An toàn tiền lâm sàng
Itraconazol đã trải qua bộ thử nghiệm chuẩn về các nghiên cứu an toàn tiền lâm sàng.
Những nghiên cứu độc tính cấp với itraconazol trên chuột nhắt, chuột cống, chuột lang và chó cho thấy giới hạn an toàn rộng. Những nghiên cứu độc tính mạn đường uống trên chuột cống và trên chó cho thấy độc tính mạn ở nhiều cơ quan hoặc mô đích như: vỏ thượng thận, gan và hệ đại thực bào đơn nhân cũng như các rối loạn chuyển hóa lipid thể hiện bằng những tế bào xanthoma trong nhiều cơ quan khác nhau.
Ở liều cao, khảo sát mô học của vỏ thượng thận cho thấy sự phù nề có thể hồi phục với sự phì đại tế bào của vùng lưới và vùng bó của vỏ thượng thận, thỉnh thoảng kèm sự mỏng đi ở vùng tiểu cầu. Thay đổi ở gan có thể hồi phục được thấy ở liều cao. Thay đổi nhẹ được thấy trong các tế bào xoang gan và tạo không bào của tế bào gan, tạo không bào cho thấy rối loạn chức năng tế bào, nhưng không có biểu hiện viêm gan hay hoại tử tế bào gan. Thay đổi mô học của hệ thống thực bào đơn nhân được đặc trưng chính bởi đại thực bào với tăng những chất tương tự protein trong nhiều mô nhu mô.
Mật độ khoáng trong xương ở toàn cơ thể thấp hơn ở chó chưa trưởng thành sau khi dùng itraconazol kéo dài.
Trong 3 nghiên cứu độc tính trên chuột, itraconazol gây các khiếm khuyết ở xương. Các khiếm khuyết gây ra gồm giảm hoạt động của xương dẹt, làm mỏng vùng đặc của các xương lớn và dòn xương tăng lên.
Khả năng gây ung thư và đột biến gen: Itraconazol không phải là một chất có khả năng gây ung thư nguyên phát trên chuột nhắt hay chuột cống. Tuy nhiên trên chuột cống đực, có tần suất sarcom mô mềm cao hơn, có thể do tăng các phản ứng viêm mạn, không ác tính của mô liên kết như là một hệ quả của tăng cholesterol và lắng đọng cholesterol trong mô liên kết.
Không có dấu hiệu nào cho thấy itraconazol có khả năng gây đột biến gen.
Độc tính trên sinh sản: Itraconazol được cho là gây tăng có liên quan liều trong độc tính trên mẹ, độc tính cho phôi thai, và gây dị tật thai trên chuột cống và chuột nhắt ở liều cao. Trên chuột cống, dị tật thai bao gồm những khiếm khuyết hệ xương chính; trên chuột nhắt dị tật thai bao gồm thoát vị não và phì đại lưỡi.
Khả năng sinh sản: Không có bằng chứng cho thấy ảnh hưởng chính trên sự sinh sản khi điều trị với itraconazol.
Chỉ định/Công dụng
Viên nang SPORAL được chỉ định để điều trị các bệnh sau:
• Phụ khoa: Nhiễm Candida âm đạo - âm hộ.
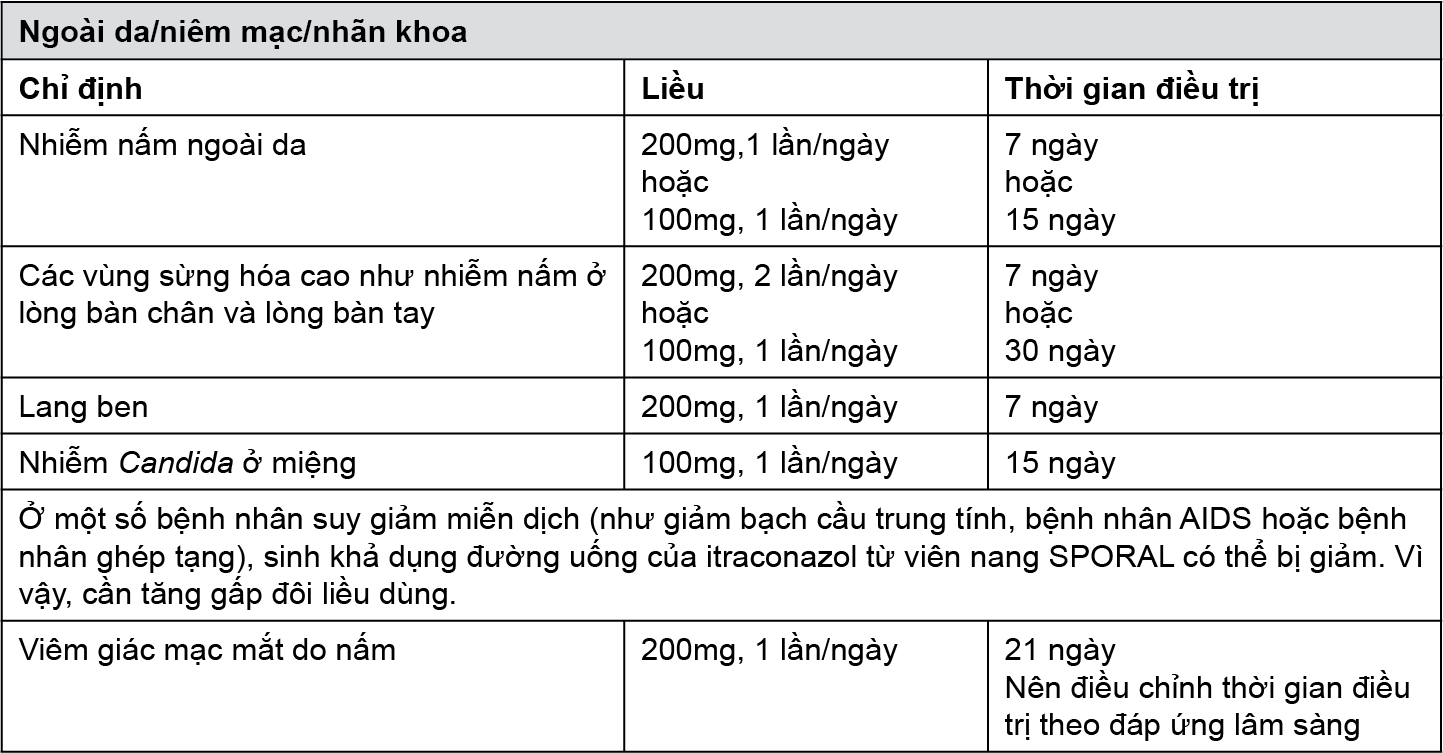
• Ngoài da/niêm mạc/nhãn khoa:
- Nhiễm nấm ngoài da
- Lang ben
- Nhiễm Candida ở miệng
- Viêm giác mạc mắt do nấm
• Nấm móng do Dermatophyte và/hoặc nấm men.
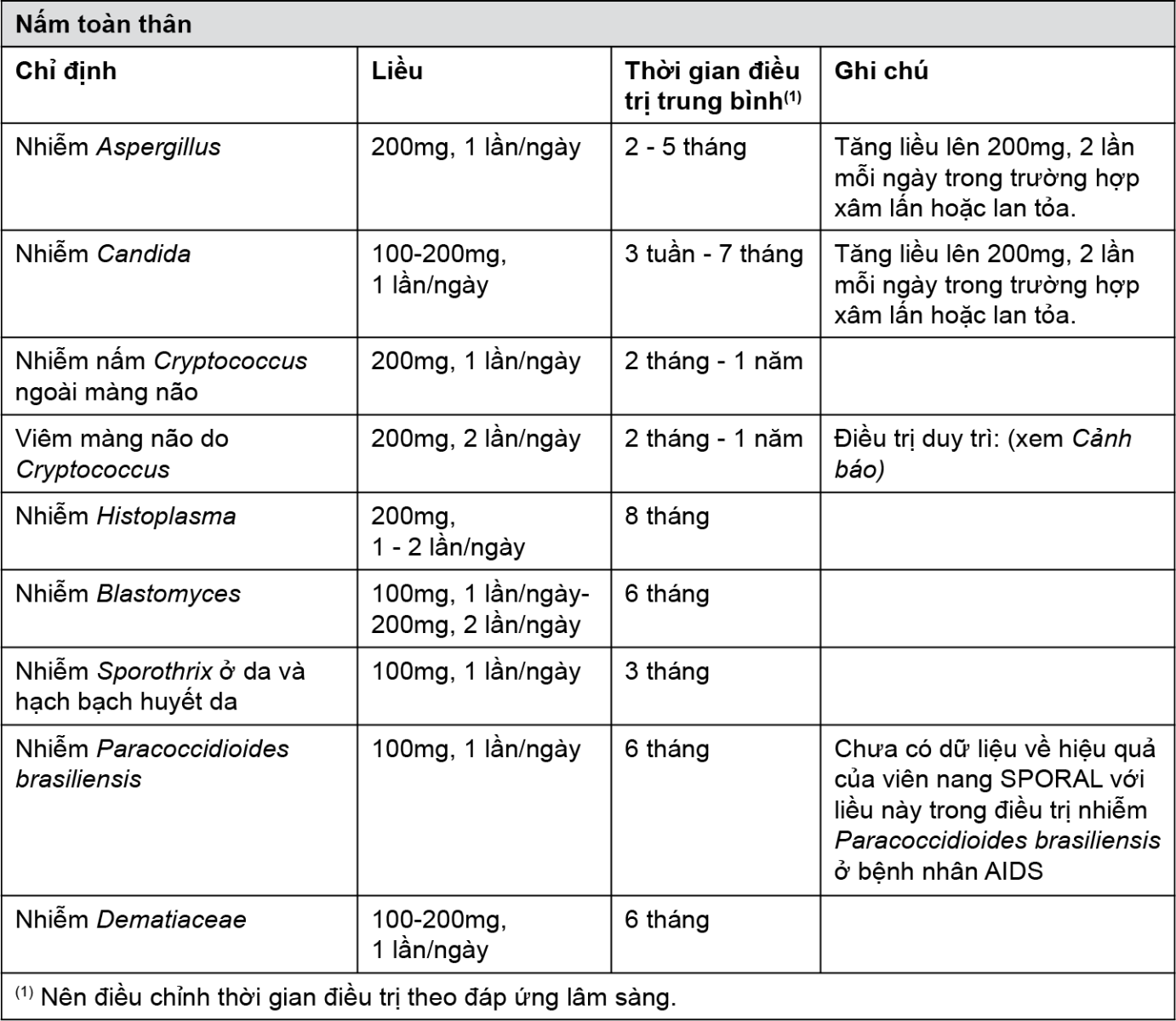
• Nấm toàn thân:
- Nhiễm nấm toàn thân do Aspergillus và Candida;
- Nhiễm nấm Cryptococcus (kể cả viêm màng não do Cryptococcus): ở những bệnh nhân suy giảm miễn dịch bị nhiễm Cryptococcus và tất cả bệnh nhân nhiễm Cryptococcus ở hệ thần kinh trung ương, chỉ sử dụng SPORAL khi liệu pháp ban đầu tỏ ra không phù hợp hoặc được chứng minh không hiệu quả;
- Nhiễm nấm Histoplasma;
- Nhiễm nấm Blastomyces;
- Nhiễm nấm Sporothrix;
- Nhiễm nấm Paracoccidioides;
- Các nhiễm nấm toàn thân hoặc nhiễm nấm vùng nhiệt đới hiếm gặp khác.
Liều lượng & Cách dùng
Uống viên nang SPORAL ngay sau khi ăn no để đạt sự hấp thu tối đa.
Phải nuốt cả viên nang.


Sự thải trừ itraconazol khỏi tổ chức da và móng chậm hơn sự thải trừ khỏi huyết tương. Đáp ứng tối ưu về lâm sàng và vi nấm đạt được 2 đến 4 tuần sau khi kết thúc điều trị nấm da và 6 đến 9 tháng sau khi kết thúc điều trị nấm móng.
Nhóm bệnh nhân đặc biệt
Trẻ em: Dữ liệu lâm sàng về việc sử dụng viên nang SPORAL trong nhi khoa còn hạn chế. Không nên dùng viên nang SPORAL cho bệnh nhân nhi trừ khi xác định lợi ích điều trị vượt trội nguy cơ có thể xảy ra (xem Cảnh báo).
Người cao tuổi: Dữ liệu lâm sàng khi sử dụng viên nang SPORAL trên người cao tuổi còn hạn chế. Chỉ nên sử dụng viên nang SPORAL trên những bệnh nhân này khi xác định lợi ích điều trị vượt trội nguy cơ có thể xảy ra. Nói chung cần cân nhắc khi chọn liều cho bệnh nhân cao tuổi tương ứng với tần số cao hơn suy giảm chức năng gan, thận, tim và các bệnh đang mắc hoặc các thuốc khác đang sử dụng (xem Cảnh báo).
Suy gan: Dữ liệu về việc sử dụng itraconazol đường uống cho bệnh nhân suy gan còn hạn chế. Nên thận trọng khi sử dụng thuốc cho những bệnh nhân này (xem Dược động học: Nhóm bệnh nhân đặc biệt - Suy gan).
Suy thận: Dữ liệu về việc sử dụng itraconazol đường uống cho bệnh nhân suy thận còn hạn chế. Nồng độ itraconazol có thể thấp hơn ở một số bệnh nhân suy thận. Nên thận trọng khi sử dụng thuốc cho những bệnh nhân này và có thể cân nhắc điều chỉnh liều.
Cảnh báo
Ảnh hưởng trên tim: Trong một nghiên cứu trên những người tình nguyện khỏe mạnh sử dụng SPORANOX IV, đã thấy có giảm phân suất tống máu thất trái thoáng qua không có triệu chứng và hồi phục trước lần truyền liều tiếp theo. Mối liên quan lâm sàng của những ảnh hưởng này với dạng bào chế dùng đường uống chưa được biết đến.
Itraconazol cho thấy có hiệu ứng co bóp cơ tim âm và SPORAL có liên quan đến những báo cáo suy tim sung huyết. Suy tim thường được báo cáo thường xuyên hơn trong các báo cáo tự phát ở những bệnh nhân dùng liều tổng cộng 400 mg/ngày so với nhóm dùng tổng liều hàng ngày thấp hơn, vì vậy nguy cơ suy tim có thể tăng khi tổng liều itraconazol trong ngày tăng.
Không nên dùng SPORAL ở những bệnh nhân bị suy tim sung huyết hoặc có tiền sử suy tim sung huyết trừ khi lợi ích điều trị vượt trội nguy cơ. Đánh giá lợi ích/nguy cơ theo từng bệnh nhân nên cân nhắc về những yếu tố như sự chỉ định chính xác, chế độ liều dùng (ví dụ tổng liều hàng ngày) và các yếu tố nguy cơ của từng bệnh nhân đối với suy tim sung huyết. Những yếu tố nguy cơ này bao gồm bệnh tim, như thiếu máu cục bộ và bệnh van tim; bệnh phổi nặng như bệnh phổi tắc nghẽn mạn tính; và suy thận và các rối loạn phù nề khác. Nên thông báo cho những bệnh nhân này các dấu hiệu và triệu chứng của suy tim sung huyết, nên thận trọng khi điều trị và nên được theo dõi các dấu hiệu và triệu chứng suy tim sung huyết trong thời gian điều trị. Nên ngừng SPORAL nếu xuất hiện các dấu hiệu hoặc triệu chứng trên.
Những thuốc chẹn (ức chế) kênh calci có thể có hiệu ứng co bóp cơ tim âm nên có thể cộng hợp với hiệu ứng của itraconazol. Thêm nữa, itraconazol có thể ức chế chuyển hóa của thuốc chẹn kênh calci. Vì vậy, cần thận trọng khi sử dụng đồng thời itraconazol và các thuốc chẹn kênh calci vì làm gia tăng nguy cơ suy tim sung huyết (CHF).
Tiềm năng tương tác thuốc: Dùng đồng thời một số thuốc chuyên biệt với itraconazol có thể dẫn đến những thay đổi hiệu quả của itraconazol và/hoặc thuốc dùng chung, đe dọa tính mạng và/hoặc đột tử. Các thuốc bị chống chỉ định, không được khuyến cáo hoặc khuyên sử dụng thận trọng khi kết hợp với itraconazol được liệt kê trong phần Tương tác.
Nhạy cảm chéo: Có rất ít thông tin đề cập đến nhạy cảm chéo giữa itraconazol và các thuốc kháng nấm nhóm azol khác. Cần thận trọng khi sử dụng viên nang SPORAL cho những bệnh nhân nhạy cảm với các thuốc nhóm azol khác.
Bệnh lý thần kinh: Nếu xuất hiện bệnh lý thần kinh có thể do viên nang SPORAL, nên ngừng điều trị.
Mất thính lực: Bệnh nhân sử dụng itraconazol được ghi nhận là có thể bị mất khả năng nghe tạm thời hay vĩnh viễn. Một vài báo cáo này có sử dụng đồng thời quinidin là thuốc bị chống chỉ định dùng chung (xem Chống chỉ định và Tương tác - Các thuốc có thể tăng nồng độ trong huyết tương do itraconazol). Mất thính lực thường hồi phục khi ngừng điều trị, nhưng có thể kéo dài ở một số bệnh nhân.
Đề kháng chéo: Trong nhiễm Candida toàn thân, nếu nghi ngờ các chủng Candida đề kháng fluconazol, thì không thể cho rằng nó nhạy cảm với itraconazol, vì vậy khuyến cáo nên xét nghiệm tính nhạy cảm trước khi bắt đầu điều trị với itraconazol.
Khả năng thay thế lẫn nhau: Không khuyến cáo sử dụng thay thế giữa viên nang SPORAL và dung dịch uống SPORANOX. Do nồng độ thuốc là cao hơn khi dùng dạng dung dịch so với dạng viên nang với cùng liều dùng.
Ảnh hưởng trên gan: Rất hiếm trường hợp độc tính gan nghiêm trọng, kể cả suy gan cấp gây tử vong, khi dùng SPORAL. Hầu hết những trường hợp này là ở bệnh nhân có tiền sử bệnh gan, đã được điều trị cho các chỉ định nhiễm nấm toàn thân, có những bệnh lý đáng kể khác và/hoặc đã sử dụng những thuốc khác có độc tính trên gan. Một vài bệnh nhân không có yếu tố nguy cơ rõ ràng về bệnh gan. Một vài trường hợp được quan sát thấy trong tháng điều trị đầu tiên, kể cả trong tuần điều trị đầu tiên. Nên theo dõi chức năng gan ở những bệnh nhân điều trị với SPORAL. Hướng dẫn cho bệnh nhân báo cáo ngay cho bác sĩ các dấu hiệu và triệu chứng gợi ý viêm gan như biếng ăn, buồn nôn, nôn, mệt mỏi, đau bụng hoặc nước tiểu sậm màu. Những bệnh nhân này nên được ngừng điều trị ngay và cho làm xét nghiệm chức năng gan.
Có ít dữ liệu về việc sử dụng itraconazol đường uống ở những bệnh nhân suy gan. Cần thận trọng khi sử dụng thuốc cho những bệnh nhân này. Khuyến cáo theo dõi chức năng gan thận trọng ở những bệnh nhân suy gan. Trong thử nghiệm lâm sàng đã quan sát thấy thời gian bán thải của itraconazol kéo dài sau khi uống liều duy nhất viên nang itraconazol trên bệnh nhân xơ gan nên cần thận trọng khi quyết định bắt đầu điều trị với các thuốc khác chuyển hóa bởi CYP3A4.
Ở những bệnh nhân có tăng hoặc bất thường enzym gan hoặc bệnh gan tiến triển, hoặc những người đã bị độc tính trên gan do các thuốc khác, không nên dùng SPORAL trừ tình trạng nghiêm trọng hoặc đe dọa tính mạng mà lợi ích vượt trội nguy cơ. Nên theo dõi chức năng gan cho những bệnh nhân đã bị bất thường chức năng gan trước đó hoặc đã từng bị độc tính gan với các thuốc khác (xem Dược động học: Nhóm bệnh nhân đặc biệt - Suy gan).
Giảm acid dạ dày: Sự hấp thu itraconazol từ viên nang SPORAL sẽ kém khi giảm acid dạ dày. Ở những bệnh nhân bị giảm acid dạ dày, hoặc do bệnh (ví dụ bệnh nhân bị thiếu toan dịch vị) hoặc do thuốc dùng chung (ví dụ bệnh nhân đang uống thuốc làm giảm acid dịch vị), nên uống viên nang SPORAL với đồ uống có tính acid (như nước giải khát cola). Nên theo dõi tác dụng kháng nấm và tăng liều itraconazol khi thật cần thiết (xem Tương tác - Các thuốc có thể làm giảm nồng độ itraconazol trong huyết tương và phần Dược động học - Hấp thu).
Trẻ em: Các dữ liệu lâm sàng về việc dùng viên nang SPORAL ở bệnh nhi còn hạn chế. Không khuyến cáo sử dụng viên nang SPORAL cho bệnh nhi trừ khi xác định lợi ích điều trị vượt trội nguy cơ có thể xảy ra.
Người cao tuổi: Dữ liệu lâm sàng về việc dùng SPORAL ở người cao tuổi còn hạn chế. Chỉ nên dùng SPORAL ở những bệnh nhân này khi xác định lợi ích điều trị vượt trội nguy cơ có thể xảy ra. Nói chung, nên cân nhắc khi chọn liều cho bệnh nhân cao tuổi, phù hợp với phản ánh tần suất lớn hơn của giảm chức năng gan, thận, hoặc tim, và bệnh đồng thời hoặc điều trị bằng thuốc khác.
Suy thận: Có ít dữ liệu về việc sử dụng itraconazol đường uống cho bệnh nhân suy thận. Nồng độ của itraconazol có thể thấp hơn ở một số bệnh nhân suy thận. Nên thận trọng khi sử dụng thuốc cho những bệnh nhân này và có thể cân nhắc điều chỉnh liều.
Bệnh nhân suy giảm miễn dịch: Trong vài bệnh nhân suy giảm miễn dịch (ví dụ giảm bạch cầu trung tính, AIDS hoặc bệnh nhân ghép tạng), sinh khả dụng đường uống của viên nang SPORAL có thể giảm.
Bệnh nhân nhiễm nấm toàn thân đe dọa tính mạng: Do đặc tính dược động học (xem Dược động học), không khuyến cáo sử dụng viên nang SPORAL để điều trị khởi đầu cho những bệnh nhân nhiễm nấm toàn thân đe dọa tính mạng.
Bệnh nhân AIDS: Điều trị nhiễm nấm toàn thân ở bệnh nhân AIDS như nhiễm nấm Sporothix, Blastomyces, Histoplasma hoặc Cryptococcus (viêm màng não và ngoài màng não) và những bệnh nhân có nguy cơ tái phát, bác sĩ nên cân nhắc điều trị duy trì.
Xơ nang: Trên những bệnh nhân xơ nang, tính biến thiên về nồng độ điều trị của itraconazol đã được quan sát thấy với mức liều ở trạng thái ổn định của dung dịch uống itraconazol 2,5mg/kg, 2 lần mỗi ngày. Nồng độ ở trạng thái ổn định >250ng/mL đã đạt được ở khoảng 50% bệnh nhân trên 16 tuổi, nhưng không đạt được ở bất kỳ bệnh nhân nào dưới 16 tuổi. Nếu bệnh nhân không đáp ứng với viên nang SPORAL, nên cân nhắc chuyển qua liệu pháp điều trị thay thế khác.
Thông tin về một vài thành phần của SPORAL: Viên nang SPORAL có chứa 192,00 mg các hạt đường hình cầu. Bệnh nhân mắc các bệnh di truyền hiếm gặp về không dung nạp fructose, kém hấp thu glucose-galactose hoặc thiếu sucrase-isomaltase không nên dùng thuốc này.
Ảnh hưởng trên khả năng lái xe và vận hành máy móc: Không thực hiện nghiên cứu về ảnh hưởng trên khả năng lái xe và vận hành máy móc. Khi lái xe và vận hành máy móc, khả năng phản ứng bất lợi như chóng mặt, rối loạn thị giác và mất thính lực (xem Tác dụng ngoại ý) có thể xảy ra trong một số trường hợp nên phải lưu ý.
Quá Liều
Triệu chứng và dấu hiệu: Nói chung, những biến cố bất lợi được báo cáo khi quá liều phù hợp với những biến cố được báo cáo khi sử dụng itraconazol (xem Tác dụng ngoại ý).
Điều trị: Trong trường hợp quá liều, nên áp dụng các biện pháp hỗ trợ. Có thể sử dụng than hoạt nếu như thấy thích hợp.
Không thể loại bỏ itraconazol bằng thẩm phân máu.
Không có thuốc giải độc đặc hiệu.
Chống chỉ định
• Không dùng viên nang SPORAL ở những bệnh nhân đã biết quá mẫn với itraconazol hoặc với bất kỳ thành phần nào của thuốc.
• Các thuốc sau chống chỉ định dùng chung với viên nang SPORAL (xem Tương tác):
- Chống chỉ định dùng viên nang SPORAL cùng với các thuốc được chuyển hóa bởi CYP3A4 mà có thể gây kéo dài khoảng QT ví dụ: astemizol, cisaprid, dofetilid, levacetylmethadol (levomethadyl), mizolastin, pimozid, quinidin, sertindol và terfenadin. Dùng chung có thể làm gia tăng nồng độ các thuốc này trong huyết tương, mà có thể dẫn đến kéo dài khoảng QT và hiếm xảy ra xoắn đỉnh.
- Các thuốc ức chế HMG-CoA reductase được chuyển hóa bởi CYP3A4 như lovastatin và simvastatin.
- Triazolam và midazolam uống.
- Các thuốc ergot alkaloid như dihydroergotamin, ergometrin (ergonovin), ergotamin và methylergometrin (methylergonovin).
- Nisoldipin
Đối với các thuốc chống chỉ định khác, xem thêm ở phần Tương tác.
• Viên nang SPORAL không nên dùng cho bệnh nhân có bằng chứng rối loạn chức năng tâm thất như suy tim sung huyết (CHF) hoặc có tiền sử bị CHF ngoại trừ trường hợp có nguy hại đến tính mạng hoặc bị nhiễm khuẩn nặng (xem Cảnh báo).
• Viên nang SPORAL chống chỉ định cho phụ nữ có thai (ngoại trừ những trường hợp đe dọa tính mạng) (xem Sử dụng ở phụ nữ có thai và cho con bú).
• Phụ nữ có khả năng mang thai đang dùng SPORAL nên thận trọng ngừa thai. Nên tiếp tục sử dụng các biện pháp tránh thai hiệu quả sau khi kết thúc điều trị với SPORAL cho tới kỳ kinh kế tiếp.
Sử dụng ở phụ nữ có thai và cho con bú
Phụ nữ có thai
Không được dùng SPORAL cho phụ nữ mang thai ngoại trừ những trường hợp đe dọa tính mạng mà đã được cân nhắc lợi ích điều trị vượt trội nguy cơ có hại cho bào thai (xem Chống chỉ định).
Các nghiên cứu itraconazol trên động vật cho thấy độc tính trên sinh sản (xem An toàn tiền lâm sàng).
Các thông tin về sử dụng SPORAL ở phụ nữ có thai còn hạn chế. Đã có báo cáo dị tật bẩm sinh sau khi đưa thuốc ra thị trường, bao gồm những dị tật về xương, đường sinh dục tiết niệu, tim mạch, nhãn khoa cũng như các dị tật về nhiễm sắc thể và đa dị tật. Chưa xác định được mối quan hệ nhân quả với việc sử dụng SPORAL.
Dữ liệu dịch tễ học về việc sử dụng SPORAL trong 3 tháng đầu thai kỳ ở hầu hết bệnh nhân điều trị nấm Candida âm đạo-âm hộ trong thời gian ngắn đã không cho thấy sự gia tăng nguy cơ về những dị tật so với nhóm chứng không có trường hợp quái thai nào. Đã chứng minh itraconazol qua được nhau thai ở mô hình trên chuột.
Phụ nữ trong tuổi sinh đẻ: Phụ nữ trong tuổi sinh đẻ cần sử dụng biện pháp tránh thai khi dùng viên nang SPORAL. Các phương pháp ngừa thai hiệu quả nên được tiếp tục cho đến chu kỳ kinh nguyệt tiếp theo sau khi kết thúc điều trị với SPORAL.
Phụ nữ cho con bú: Chỉ một lượng rất nhỏ itraconazol được tiết vào sữa người mẹ. Vì vậy, nên cân nhắc lợi ích điều trị bằng viên nang SPORAL so với nguy cơ tiềm tàng ở phụ nữ đang cho con bú. Trong trường hợp nghi ngờ, bệnh nhân không được cho con bú.
Khả năng sinh sản: Tham khảo An toàn tiền lâm sàng về khả năng sinh sản trên động vật liên quan đến itraconazol.
Tương tác
Itraconazol được chuyển hóa chủ yếu bởi CYP3A4. Các chất khác có chung đường chuyển hóa hoặc làm thay đổi hoạt tính CYP3A4 có thể ảnh hưởng đến dược động học của itraconazol. Tương tự, itraconazol có thể thay đổi dược động học của các chất khác có chung con đường chuyển hóa. Itraconazol là chất ức chế CYP3A4 mạnh và chất ức chế P-glycoprotein. Khi sử dụng thuốc kết hợp, nên tham khảo thông tin về đường chuyển hóa và có thể cần điều chỉnh liều.
Các thuốc có thể làm giảm nồng độ itraconazol trong huyết tương: Những thuốc làm giảm acid dạ dày (ví dụ thuốc trung hòa acid như hydroxid nhôm, hoặc những thuốc ức chế tiết acid dịch vị như thuốc đối kháng thụ thể H2 và ức chế bơm proton) làm giảm hấp thu itraconazol từ viên nang itraconazol. Khuyến cáo nên thận trọng khi dùng đồng thời những thuốc này với viên nang itraconazol:
- Khuyến cáo nên uống itraconazol với đồ uống có tính acid (như nước giải khát cola) khi điều trị kết hợp với các thuốc làm giảm acid dịch vị.
- Khuyến cáo nên uống các thuốc trung hòa acid (ví dụ hydroxid nhôm) ít nhất trước 1 giờ hoặc sau 2 giờ sau khi uống viên nang SPORAL.
- Khi sử dụng đồng thời, nên theo dõi tác dụng kháng nấm và có thể tăng liều itraconazol nếu thật cần.
Dùng đồng thời itraconazol với thuốc gây cảm ứng mạnh enzym CYP3A4 có thể làm giảm sinh khả dụng của itraconazol và hydroxy-itraconazol đến một mức độ mà có thể làm giảm hiệu quả điều trị. Ví dụ như:
- Kháng sinh: isoniazid, rifabutin (xem Các thuốc có thể bị tăng nồng độ trong huyết tương do itraconazol), rifampicin;
- Chống co giật: carbamazepin (xem Các thuốc có thể bị tăng nồng độ trong huyết tương do itraconazol), phenobarbital, phenytoin;
- Kháng virus: efavirenz, nevirapin.
Vì vậy không nên dùng kết hợp các thuốc gây cảm ứng mạnh CYP3A4 với itraconazol. Nên tránh sử dụng những thuốc này trước hai tuần hoặc trong khi đang dùng itraconazol trừ khi lợi ích vượt trội nguy cơ có thể xảy ra do itraconazol. Khi dùng kết hợp, nên theo dõi tác dụng kháng nấm và tăng liều itraconazol khi thật cần thiết.
Các thuốc có thể làm tăng nồng độ itraconazol trong huyết tương: Các chất ức chế mạnh CYP3A4 có thể làm tăng sinh khả dụng của itraconazol. Ví dụ như:
- Kháng sinh: ciprofloxacin, clarithromycin, erythromycin;
- Kháng virus: darunavir dùng cùng ritonavir và fosamprenavir dùng cùng ritonavir, indinavir (xem Các thuốc có thể bị tăng nồng độ trong huyết tương do itraconazol phía dưới), ritonavir (xem Các thuốc có thể bị tăng nồng độ trong huyết tương do itraconazol phía dưới) và telaprevir.
Khuyến cáo nên thận trọng khi dùng phối hợp những thuốc này với viên nang itraconazol. Những bệnh nhân phải sử dụng đồng thời itraconazol với các thuốc ức chế mạnh CYP3A4 nên được kiểm soát chặt chẽ các dấu hiệu hoặc triệu chứng của việc tăng hay kéo dài tác dụng dược lý của itraconazol, và giảm liều itraconazol khi cần thiết. Khi thích hợp, nên định lượng nồng độ của itraconazol trong huyết tương.
Các thuốc có thể bị tăng nồng độ trong huyết tương do itraconazol: Itraconazol và chất chuyển hóa chính của nó, hydroxy-itraconazol có thể ức chế sự chuyển hoá của những thuốc được chuyển hóa bởi CYP3A4 và có thể ngăn chặn việc vận chuyển thuốc bởi P-glycoprotein, mà có thể dẫn đến tăng nồng độ trong huyết tương của các thuốc này và/hoặc các chất chuyển hóa có hoạt tính của nó khi nó kết hợp với itraconazol. Nồng độ cao trong huyết tương có thể làm tăng hoặc kéo dài tác dụng điều trị và tác dụng phụ của các thuốc này. Những thuốc chuyển hóa bởi CYP3A4 được biết là kéo dài khoảng QT có thể bị chống chỉ định với itraconazol vì khi kết hợp có thể dẫn đến nhịp nhanh thất bao gồm cả xoắn đỉnh, một chứng loạn nhịp tim có thể gây tử vong. Khi ngừng điều trị, nồng độ itraconazol trong huyết tương giảm đến nồng độ gần như không thể phát hiện được trong vòng 7 đến 14 ngày, phụ thuộc vào liều dùng và thời gian điều trị. Ở những bệnh nhân xơ gan hoặc những bệnh nhân dùng thuốc ức chế CYP3A4, sự suy giảm nồng độ trong huyết tương có thể chậm hơn. Điều này đặc biệt quan trọng khi bắt đầu điều trị với các thuốc có chuyển hóa bị ảnh hưởng bởi itraconazol.
Các loại thuốc tương tác được phân loại như sau:
- “Chống chỉ định”: Là loại thuốc không được dùng chung với itraconazol trong mọi trường hợp và đến hai tuần sau khi ngừng điều trị với itraconazol.
- “Không khuyến cáo”: Nên tránh sử dụng thuốc trong thời gian điều trị và đến hai tuần sau khi ngừng điều trị với itraconazol, trừ khi lợi ích vượt trội nguy cơ của các tác dụng phụ. Nếu không tránh được việc dùng kết hợp, nên theo dõi dấu hiệu lâm sàng hoặc triệu chứng của việc tăng hoặc kéo dài tác dụng phụ của các loại thuốc tương tác, và liều dùng của thuốc nên được giảm hoặc ngừng khi cần thiết. Cần định lượng nồng độ trong huyết tương nếu cần.
- “Sử dụng thận trọng”: Theo dõi cẩn thận khi thuốc được dùng chung với itraconazol. Khi dùng chung, khuyến cáo rằng các bệnh nhân được theo dõi chặt chẽ các dấu hiệu hoặc triệu chứng của tăng hoặc kéo dài tác dụng hoặc tác dụng phụ của các loại thuốc tương tác, và được giảm liều khi cần thiết. Cần định lượng nồng độ thuốc trong huyết tương nếu cần.
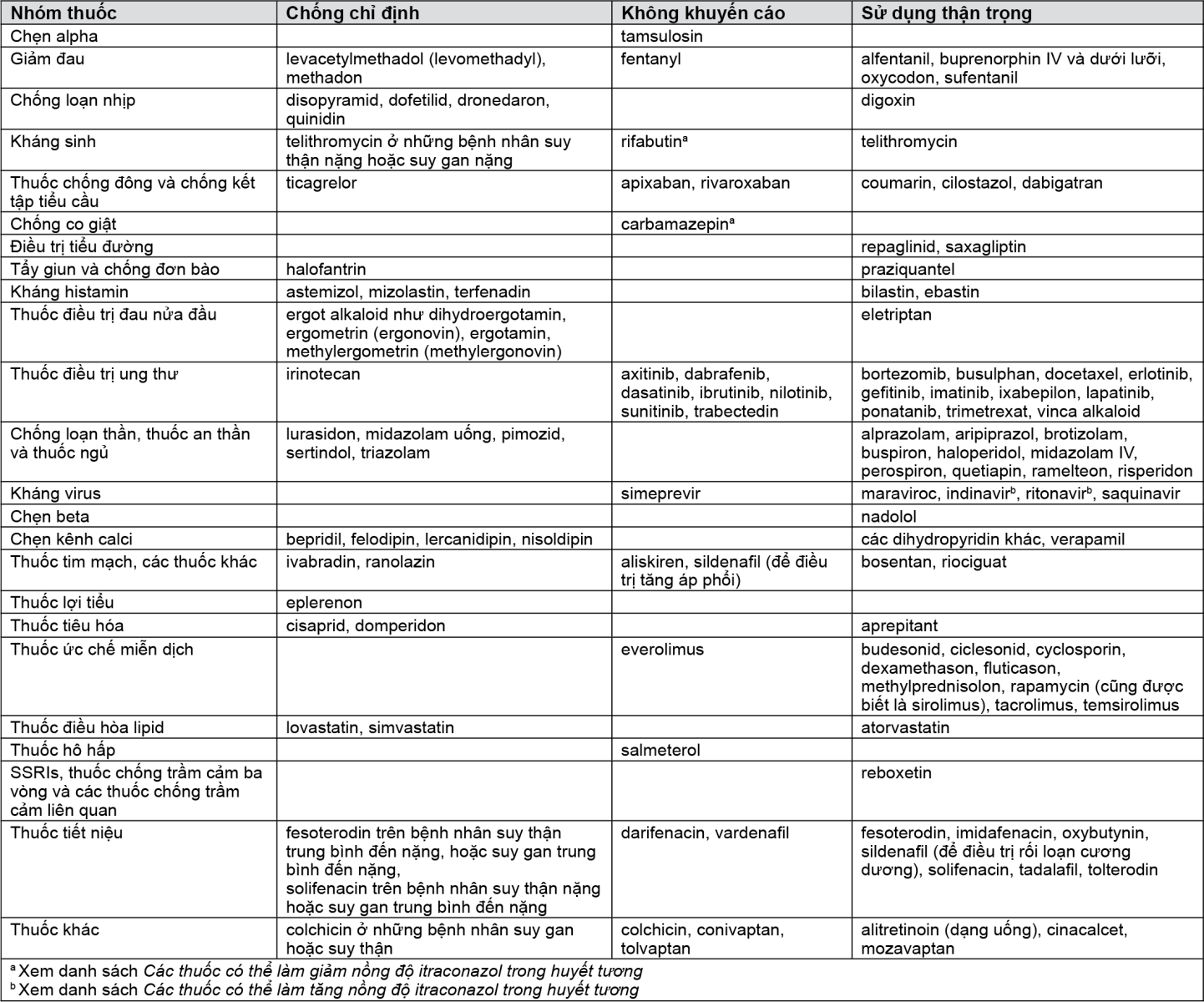
Ví dụ về các thuốc mà có thể tăng nồng độ trong huyết tương do itraconazol được trình bày theo nhóm thuốc sau, với những khuyến cáo về việc dùng chung với itraconazol:
Các thuốc có thể bị giảm nồng độ trong huyết tương do itraconazol: Dùng đồng thời itraconazol với thuốc chống viêm meloxicam không steroid có thể làm giảm nồng độ trong huyết tương của meloxicam. Khuyến cáo nên sử dụng thận trọng meloxicam kết hợp với itraconazol, và nên theo dõi ảnh hưởng hoặc tác dụng phụ của nó. Nên điều chỉnh liều meloxicam khi dùng chung với itraconazol nếu cần.
Bệnh nhân nhi: Nghiên cứu tương tác chỉ được thực hiện ở người lớn.
Tác dụng ngoại ý
Phần này trình bày những phản ứng bất lợi. Phản ứng bất lợi là những biến cố bất lợi được xem như phần nào có liên quan tới việc sử dụng itraconazol dựa trên đánh giá toàn diện thông tin biến cố bất lợi có sẵn. Mối liên hệ nhân quả với itraconazol không thể xác định một cách chắc chắn từ các trường hợp riêng lẻ. Hơn nữa, bởi vì các thử nghiệm lâm sàng được tiến hành trong các điều kiện khác nhau, tỷ lệ phản ứng bất lợi quan sát được ở các thử nghiệm lâm sàng của một thuốc không thể so sánh trực tiếp với tỷ lệ của các thử nghiệm lâm sàng của thuốc khác và không thể phản ánh tỷ lệ trong thực hành lâm sàng.
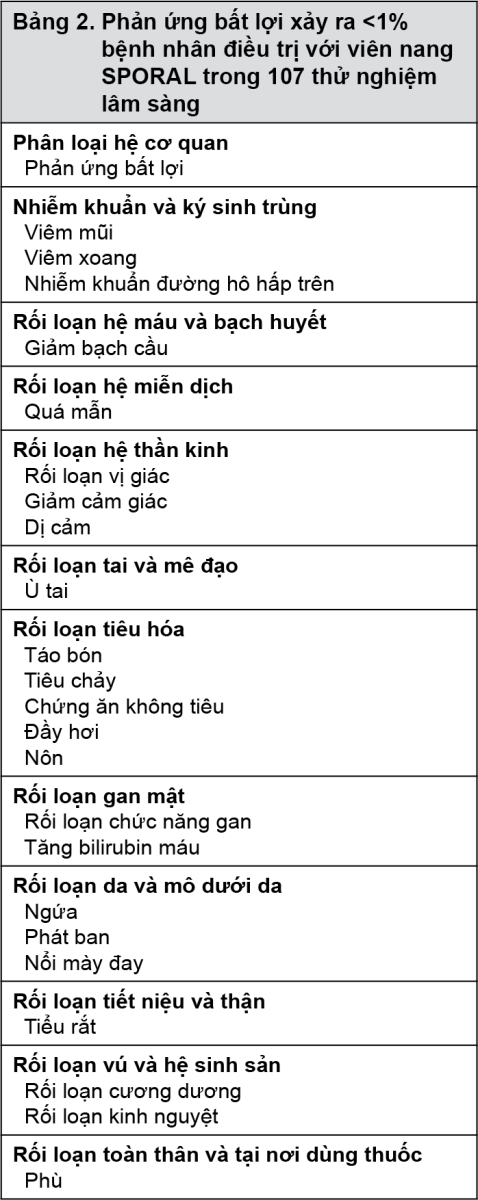
Dữ liệu thử nghiệm lâm sàng: Sự an toàn của viên nang SPORAL đã được đánh giá trên 8499 bệnh nhân tham gia trong 107 thử nghiệm lâm sàng nhãn mở, mù đôi. Trong 8499 bệnh nhân điều trị với viên nang SPORAL, có 2104 bệnh nhân được điều trị với viên nang SPORAL trong các thử nghiệm mù đôi. Tất cả 8499 bệnh nhân dùng ít nhất một liều viên nang SPORAL để điều trị bệnh nấm da hoặc nấm móng và cung cấp dữ liệu an toàn. Phản ứng bất lợi được báo cáo ≥1% bệnh nhân được điều trị với viên nang SPORAL trong những thử nghiệm lâm sàng này được thể hiện trong Bảng 1.

Phản ứng bất lợi xảy ra <1% bệnh nhân điều trị với viên nang SPORAL trong những thử nghiệm lâm sàng này được liệt kê ở Bảng 2.
Sau đây là danh sách các phản ứng bất lợi bổ sung liên quan đến itraconazol đã được báo cáo trong các thử nghiệm lâm sàng của dung dịch uống SPORANOX và/hoặc SPORANOX IV, không bao gồm các phản ứng bất lợi “Viêm tại nơi tiêm” mà cụ thể cho đường tiêm.
Rối loạn hệ máu và bạch huyết: giảm bạch cầu hạt, giảm tiểu cầu.
Rối loạn hệ miễn dịch: phản ứng phản vệ.
Rối loạn chuyển hóa và dinh dưỡng: tăng đường huyết, tăng kali máu, giảm kali máu, giảm magnesi máu.
Rối loạn tâm thần: tình trạng lú lẫn.
Rối loạn hệ thần kinh: bệnh thần kinh ngoại biên, choáng váng, ngủ gà.
Rối loạn tim: suy tim, suy thất trái, nhịp tim nhanh.
Rối loạn mạch máu: tăng huyết áp, hạ huyết áp.
Rối loạn hô hấp, ngực và trung thất: phù phổi, khản tiếng, ho.
Rối loạn tiêu hóa: rối loạn dạ dày-ruột.
Rối loạn gan mật: suy gan, viêm gan, vàng da.
Rối loạn da và mô dưới da: ban đỏ, tăng tiết mồ hôi.
Rối loạn cơ xương và mô liên kết: đau cơ, đau khớp.
Rối loạn thận và tiết niệu: suy thận, tiểu không kiểm soát.
Rối loạn toàn thân và tại nơi dùng thuốc: phù toàn thân, phù mặt, đau ngực, sốt, đau, mệt mỏi, ớn lạnh.
Cận lâm sàng: tăng alanin aminotransferase, tăng aspartat aminotransferase, tăng phosphat kiềm trong máu, tăng lactat dehydrogenase máu, tăng ure máu, tăng gamma-glutamyltransferase, tăng men gan, bất thường phân tích nước tiểu.
Bệnh nhân nhi: Sự an toàn của viên nang SPORAL đã được đánh giá trên 165 bệnh nhân nhi từ 1 đến 17 tuổi tham gia trong 14 thử nghiệm lâm sàng (4 thử nghiệm mù đôi, đối chứng với giả dược; 9 thử nghiệm nhãn mở; 1 thử nghiệm có một pha nhãn mở và tiếp theo là pha mù đôi). Những bệnh nhân này đã nhận được ít nhất một liều viên nang SPORAL để điều trị nhiễm nấm và cung cấp dữ liệu an toàn.
Dựa trên dữ liệu an toàn tổng hợp từ những thử nghiệm lâm sàng này, các phản ứng bất lợi ở bệnh nhân nhi được báo cáo phổ biến là đau đầu (3,0%), nôn (3,0%), đau bụng (2,4%), tiêu chảy (2,4%), bất thường chức năng gan (1,2%), hạ huyết áp (1,2%), buồn nôn (1,2%) và nổi mày đay (1,2%). Nói chung, bản chất của phản ứng bất lợi ở bệnh nhân nhi là tương tự như quan sát thấy ở người lớn, nhưng tỉ lệ mắc cao hơn ở bệnh nhân nhi.
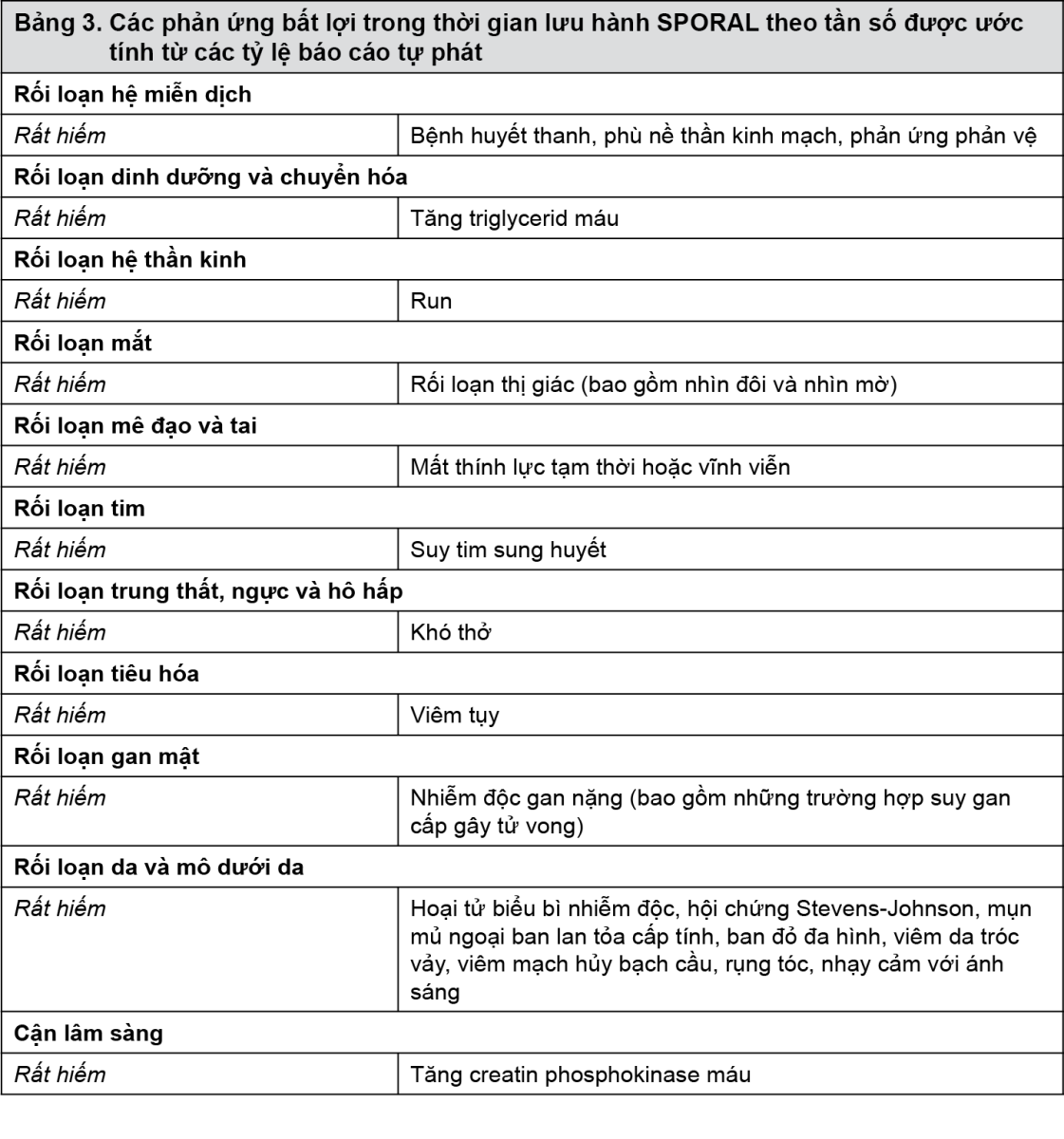
Dữ liệu sau khi đưa ra thị trường: Ngoài các phản ứng bất lợi được báo cáo trong các nghiên cứu lâm sàng và được kể trên, các phản ứng bất lợi sau đã được báo cáo trong quá trình đưa thuốc ra thị trường (Bảng 3). Trong bảng, các tần số được cung cấp theo quy ước sau đây: Rất thường gặp (≥1/10); Thường gặp (≥1/100 và <1/10); Ít gặp (≥1/1000 và <1/100); Hiếm (≥1/10000 và <1/1000); Rất hiếm (<1/10000), bao gồm cả các báo cáo riêng lẻ.
Trong Bảng 3, các phản ứng bất lợi được trình bày theo tần số dựa theo tỷ lệ báo cáo tự phát.
 Bảo quản
Bảo quản
Bảo quản dưới 30oC.
Phân loại ATC
J02AC02 - itraconazole
Trình bày/Đóng gói
Viên nang: hộp 1 vỉ x 4 viên.
- Abacavir
- Abernil
- Abiiogran
- Acarbose
- ACC
- Acebutolol
- Acenocoumarol
- Acetate Ringer's
- Acetazolamide
- Acetylcystein
- Acetylsalicylic acid
- Aciclovir
- Acid acetylsalicylic
- Acid aminocaproic
- Acid ascorbic
- Acid boric
- Acid chenodeoxycholic
- Acid ethacrynic
- Acid folic
- Acid fusidic
- Acid iopanoic
- Acid ioxaglic
- Acid nalidixic
- Acid pantothenic
- Acid para-aminobenzoic
- Acid salicylic
- Acid tranexamic
- Acid valproic
- Acid zoledronic
- Acitretin
- Aclasta
- Aclon
- Actapulgite
- Actelsar
- Actelsar HCT
- Actemra
- Actilyse
- Acular
- Acupan
- Acuvail
- Acyclovir STADA
- Acyclovir STADA Cream
- Adalat
- Adenosin
- Adenosin Ebewe
- Adipiodon
- Advagraf
- Aerius
- Afinitor
- Agicarvir
- Agifovir-E
- Agilosart
- Agilosart-H
- Agimepzol
- Agimosarid
- Agimstan
- Agimstan-H
- Agiremid
- Agivastar
- Aibezym
- Air-X
- Alaxan
- Albendazol
- Albiomin
- Albumin
- Albumin người Grifols 20%
- Albuminar
- AlbuRx
- Albutein
- Alcuronium chloride
- Aldesleukin
- Alendronat
- Alertin
- Alfa-Lipogamma 600 Oral
- Alfuzosin hydrochlorid
- Algotra
- Alimemazin
- Alimta
- Allipem
- Allopurinol
- Allopurinol STADA
- Aloxi
- Alprazolam
- Alpha Chymotrypsin
- Alpha tocopherol
- Alphachymotrypsin Glomed
- Alphagan-P
- Aluvia
- Alzental
- Amaryl
- Ambroco
- Ambroxol
- Amcinol-Paste
- Amigold
- Amikacin
- Aminocaproic acid
- Aminoleban
- Aminoleban Oral
- Aminosteril N-Hepa
- Amiparen
- Amitriptyline
- Amiyu
- Amlodipine
- Amlor
- Amoxicillin
- Amoxicillin & clavulanate
- Ampicillin
- Amquitaz
- Anaferon for children
- Anargil
- Anaropin
- Andriol Testocaps
- Anepzil
- Anyfen
- Apaisac
- Apidra SoloStar
- Apitim 5
- Aprovel
- Aquaphil
- Arcalion
- Arcoxia
- Aricept Evess
- Arimidex
- Arnetine
- Artrodar
- A-Scabs
- Ascorbic acid
- Asperlican/Candinazol
- Aspilets EC
- Aspirin
- Asthmatin
- Atelec
- Atocib 120
- Atocib 90
- Atosiban PharmIdea
- Atozet
- Attapulgite
- Atussin
- Atropin
- Augbactam
- Augmentin Sachet
- Augmentin SR
- Augmentin Tablets
- Augmex
- Avamys
- Avastin
- Avelox Dịch truyền
- Avelox Viên nén
- Avodart
- Axcel Cefaclor-125 Suspension
- Axcel Cetirizine Syrup
- Axcel Chlorpheniramine
- Axcel Dexchlorpheniramine
- Axcel Dicyclomine-S Syrup
- Axcel Diphenhydramine Paediatric Syrup
- Axcel Erythromycin ES
- Axcel Eviline
- Axcel Fungicort Cream
- Axcel Fusidic acid Cream
- Axcel Fusidic acid-B Cream
- Axcel Hydrocortisone Cream
- Axcel Lignocaine 2% Sterile Gel
- Axcel Loratadine
- Axcel Miconazole Cream
- Axcel Paracetamol
- Axcel Urea Cream
- Axitan
- Azenmarol
- Azicine
- Aziphar
- Azithromycin