Nhà sản xuất
Merck Sharp & Dohme
Thành phần
Mỗi lọ: Ertapenem 1g.
Đặc điểm
INVANZ (Ertapenem dùng để tiêm) là 1-β methyl-carbapenem tổng hợp, vô khuẩn, dùng đường tiêm, có tác dụng kéo dài và có cấu trúc dạng beta-lactam, như là penicillin và cephalosporin, có hoạt tính chống lại nhiều vi khuẩn kỵ khí và ưa khí, cả gram âm và gram dương.
Dược lực học
Ertapenem có tác dụng in vitro chống nhiều vi khuẩn ưa khí và kỵ khí, cả gram dương và gram âm. Tác dụng diệt khuẩn của ertapenem là do ức chế tổng hợp vách vi khuẩn: ertapenem gắn vào các protein gắn penicillin (PBP). Ở E. coli, ertapenem có ái lực mạnh với các PBP 1a, 1b, 2, 3, 4 và 5, chủ yếu là với PBP2 và PBP3. Ertapenem rất bền vững, không bị thủy phân bởi phần lớn các loại β-lactamase, kể cả các penicillinase và cephalosporinase, và các β-lactamase phổ rộng nhưng không chống được metallo-β-lactamase.
INVANZ có hoạt tính chống được hầu hết các chủng của những vi khuẩn sau đây cả trên in vitro và trên lâm sàng (xem Chỉ định):
VI KHUẨN GRAM DƯƠNG ƯA KHÍ VÀ KỴ KHÍ KHÔNG BẮT BUỘC:
Staphylococcus aureus - tụ cầu vàng (bao gồm chủng tiết penicillinase)
Streptococcus agalactiae
Streptococcus pneumoniae
Streptococcus pyogenes
Chú thích: Tụ cầu kháng methicillin kháng INVANZ. Nhiều chủng Enterococcus faecalis và hầu hết chủng Enterococcus faecium cũng kháng INVANZ.
VI KHUẨN GRAM ÂM ƯA KHÍ VÀ KỴ KHÍ KHÔNG BẮT BUỘC:
Escheria coli
Haemophilus influenzae (bao gồm chủng tiết β-lactamase)
Klebsiella pneumoniae
Moraxella catarrhalis
Proteus mirabilis
VI KHUẨN KỴ KHÍ
Bacteroides fragilis và các loài khác trong nhóm B. fragilis
Loài Clostridium (trừ C. difficile)
Loài Eubacterium
Loài Peptostreptococcus
Porphyromonas asaccharolytica
Loài Prevotella
Những dữ liệu in vitro sau đây hiện có sẵn, nhưng chưa rõ ý nghĩa lâm sàng.
Nồng độ ức chế tối thiểu (MIC) in vitro của INVANZ là ≤1 mcg/mL cho phần lớn (≥ 90%) các chủng của Streptococcus bao gồm Streptococcus pneumoniae, nồng độ ≤0,5 mcg/mL chống được phần lớn (≥ 90%) chủng của Haemophilus, ≤2 mcg/mL chống được phần lớn (≥ 90%) chủng vi khuẩn ưa khí và kỵ khí không bắt buộc và nồng độ ≤4 mcg/mL chống được phần lớn (≥ 90%) chủng các vi khuẩn kỵ khí bắt buộc trong danh sách dưới đây; tuy nhiên, hiệu lực và tính an toàn của INVANZ trong điều trị các bệnh nhiễm khuẩn trên lâm sàng do nhiễm các vi khuẩn nêu trên thì chưa chứng minh được trong các nghiên cứu lâm sàng có đối chứng tốt và thích hợp:
VI KHUẨN GRAM DƯƠNG ƯA KHÍ VÀ KỴ KHÍ KHÔNG BẮT BUỘC:
Staphylococcus, coagulase âm tính, nhạy cảm với methicillin.
Streptococcus pneumoniae kháng penicillin
Các Streptococcus viridans.
Chú thích: Tụ cầu kháng methicillin kháng INVANZ. Nhiều chủng Enterococcus faecalis và hầu hết các chủng Enterococcus faecium cũng kháng INVANZ.
VI KHUẨN GRAM ÂM ƯA KHÍ VÀ KỴ KHÍ KHÔNG BẮT BUỘC:
Citrobacter freundii
Enterobacter acrogenes
Enterobacter cloaceae
Escherichia coli tiết ESBL
Haemophilus parainfluenzae
Klebsiella oxytoca
Klebsiella pneumoniae tiết ESBL
Morganella morganii
Proteus vulgaris
Serratia marcescens
Chú thích: Nhiều chủng của các vi khuẩn nêu trên có đa đề kháng với các kháng sinh khác, như các penicillin, cephalasporin (bao gồm thế hệ thứ ba) và các aminoglycosid, nhưng nhạy cảm với INVANZ.
VI KHUẨN KỴ KHÍ
Loài Fusobacterium
Xét nghiệm tính nhạy cảm với kháng sinh: Khi có những kết quả in vitro về tính nhạy cảm với kháng sinh của vi khuẩn, nên báo cáo định kỳ cho thầy thuốc, trong đó mô tả đặc tính nhạy cảm của vi khuẩn gây bệnh ở bệnh viện và lây nhiễm ở cộng đồng. Những báo cáo này sẽ giúp thầy thuốc lựa chọn được kháng sinh hiệu quả nhất.
Kỹ thuật pha loãng: Dùng các phương pháp định lượng để xác định nồng độ ức chế tối thiểu (MIC). Những trị số MIC này sẽ cung cấp trị số ước tính về tính nhạy cảm của vi khuẩn đối với kháng sinh. MIC được xác định bằng một quy trình chuẩn hóa. Quy trình chuẩn hóa dựa vào phương pháp pha loãng† (canh cấy hoặc thạch) hoặc tương đương với nồng độ chuẩn hóa của chất cấy truyền và nồng độ chuẩn hóa của bột ertapenem. Phân tích các trị số MIC theo các tiêu chí được cung cấp ở Bảng 1.
Kỹ thuật khuếch tán: Những phương pháp định lượng đo đường kính của vòng vô khuẩn cũng cung cấp những trị số ước tính có thể lặp lại về tính nhạy cảm của vi khuẩn đối với các kháng sinh. Một quy trình chuẩn hoá như thế †† đòi hỏi sử dụng những nồng độ chuẩn hóa của chất cấy truyền. Kỹ thuật này dùng những đĩa giấy tròn thấm 10 mcg ertapenem để thử tính nhạy cảm của vi khuẩn đối với ertapenem. Những chỉ tiêu biểu thị sự khuếch tán của thuốc tẩm vào đĩa giấy được cung cấp ở Bảng 1.
Kỹ thuật kỵ khí: Với vi khuẩn kỵ khí, có thể xác định tính nhạy cảm với ertapenem qua MIC với một phương pháp thử nghiệm chuẩn hóa †††§. Phân tích các trị số MIC thu được theo các tiêu chí được cung cấp ở Bảng 1.
- xem Bảng 1.
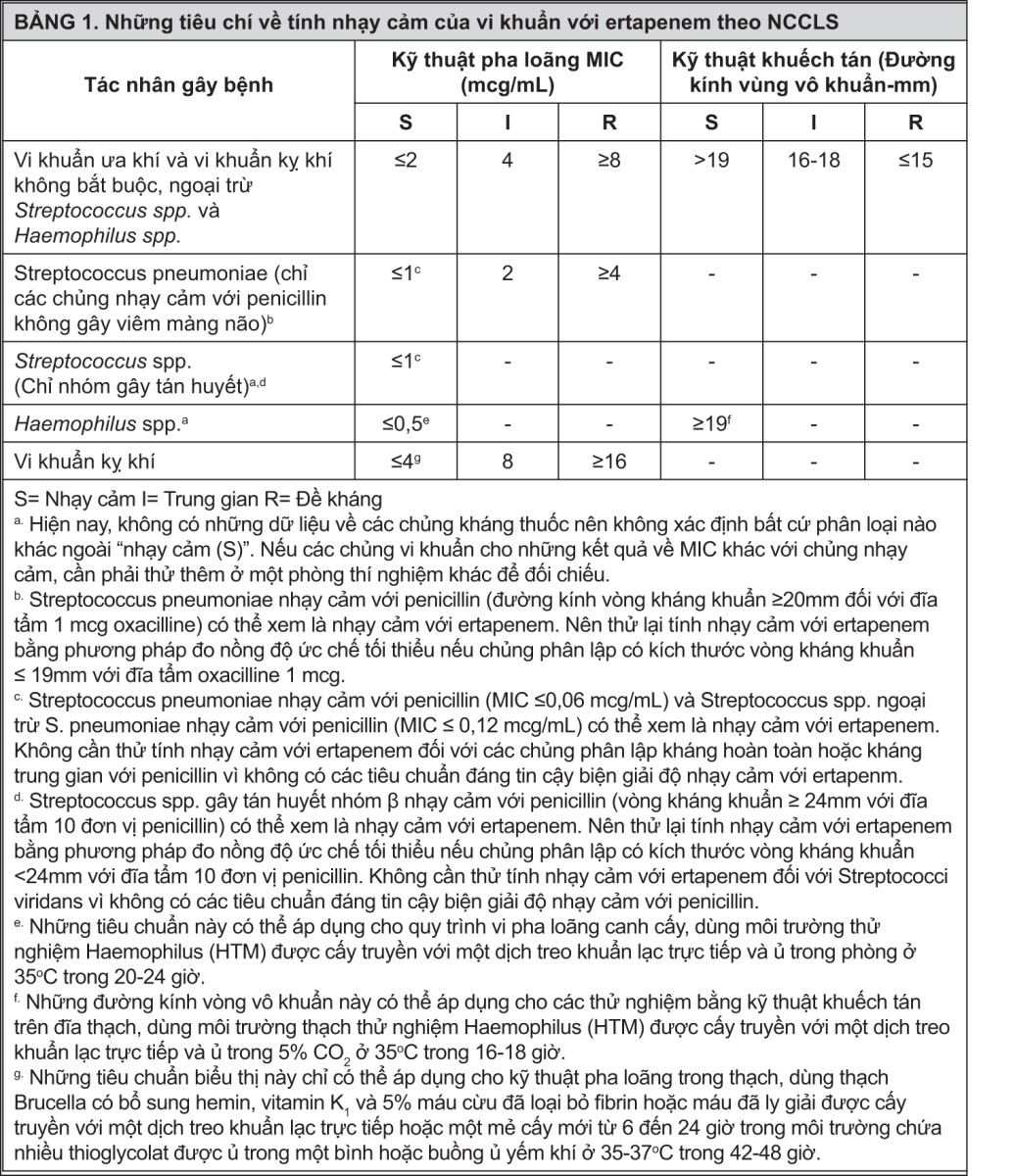
Một báo cáo gọi là "Nhạy cảm" nếu tác nhân gây bệnh có thể bị ức chế ở nồng độ kháng sinh thử nghiệm thường đạt được trong máu. Một báo cáo gọi là "Trung gian" nếu kết quả được xem không rõ ràng và nếu vi khuẩn không hoàn toàn nhạy cảm đối với những thuốc khác được xem là nhạy cảm trên lâm sàng, thì cần lặp lại xét nghiệm. Phân loại này cho biết vẫn có thể dùng thuốc trên lâm sàng nếu những vị trí của cơ thể có nồng độ phân bố thuốc cao hoặc trong trường hợp có thể dùng thuốc với liều cao. Phân loại này cũng cung cấp một vùng đệm nhằm ngăn ngừa những yếu tố sai sót kỹ thuật nhỏ có thể gây nên những khác biệt lớn khi phân tích kết quả. Một báo cáo gọi là "Kháng" nếu tác nhân gây bệnh có thể không bị ức chế ở nồng độ kháng sinh thử nghiệm thường đạt được trong máu; do đó cần lựa chọn liệu pháp khác.
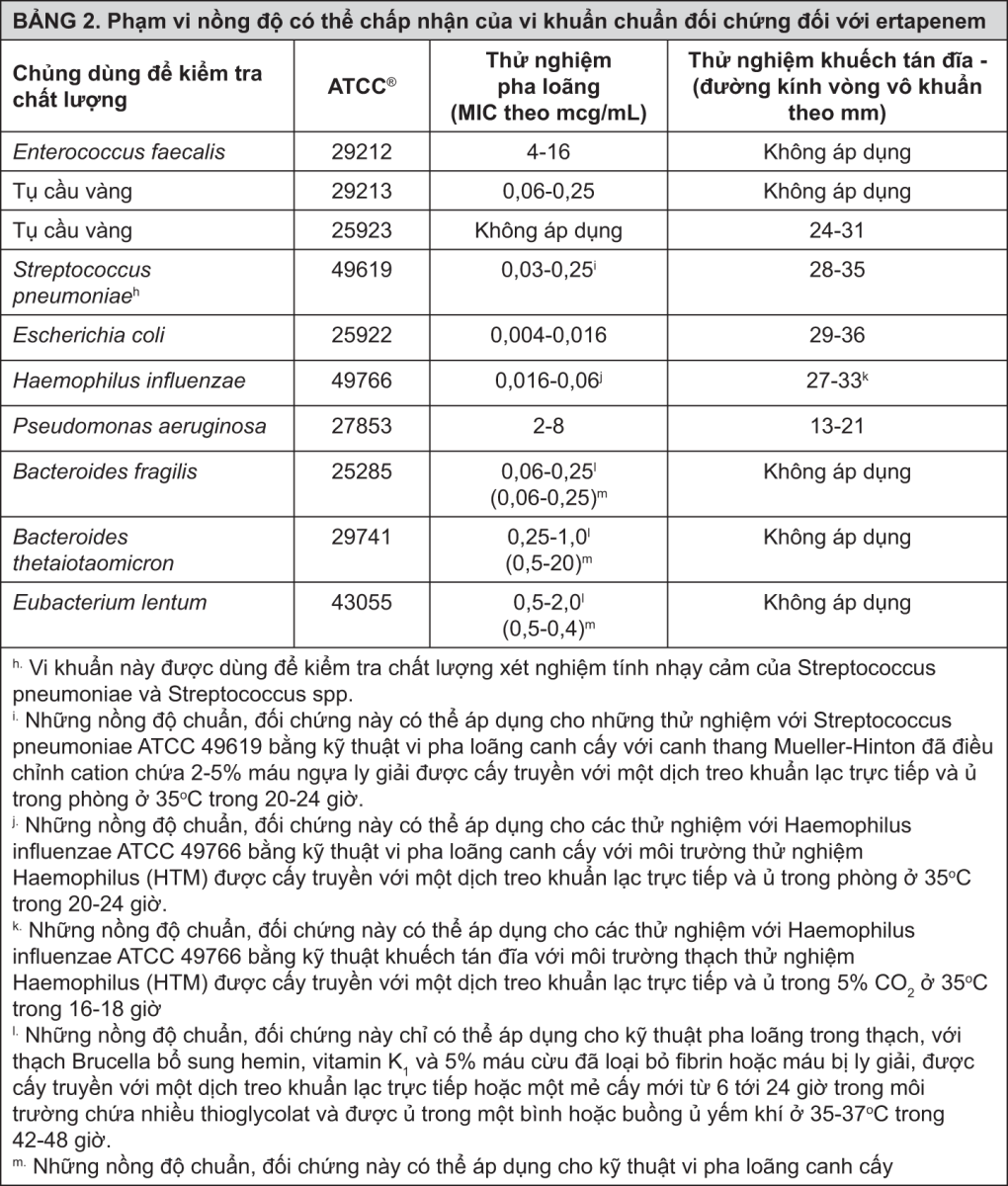
Kiểm tra chất lượng: Những quy trình chuẩn hóa thử nghiệm tính nhạy cảm chuẩn hóa cần dùng những chủng vi khuẩn chuẩn đối chứng nhằm kiểm tra những mặt kỹ thuật của quy trình thử nghiệm. Bột ertapenem chuẩn cung cấp các giá trị nồng độ ghi ở bảng 2 dưới đây. Các vi khuẩn chuẩn đối chứng là những chủng vi khuẩn đặc hiệu có những tính chất sinh học nội tại. Những chủng chuẩn đối chứng phải rất ổn định, luôn cho mô hình nhạy cảm có tính chuẩn mực và có tính lặp lại. Những chủng đặc hiệu dùng trong kiểm tra chất lượng xét nghiệm vi sinh học không có ý nghĩa về mặt lâm sàng.
- xem Bảng 2.
Các nghiên cứu lâm sàng
Người lớn: Ertapenem đã được đánh giá trong một thử nghiệm lâm sàng ở 665 người lớn điều trị nhiễm khuẩn ổ bụng có biến chứng: so sánh ertapenem (mỗi ngày một lần 1 g truyền tĩnh mạch) với piperacillin/tazobactam (truyền tĩnh mạch 3,375 g mỗi 6 giờ), dùng trong 5-14 ngày. Tại thời điểm 1-2 tuần sau thời kỳ điều trị, tỷ lệ thành công về lâm sàng và vi sinh là 89,6% (190/212) với ertapenem và 82,7% (162/196) với piperacillin/lazobactam; sau khi điều trị 4-6 tuần (đánh giá khỏi bệnh), tỷ lệ thành công là 86,7% (176/203) với ertapenem và 81,3% (157/193) với piperacillin/tazobactam.
Trong thử nghiệm lâm sàng, đánh giá ertapenem ở 540 người lớn điều trị viêm da và cấu trúc da có biến chứng, so sánh ertapenem (mỗi ngày truyền tĩnh mạch một lần 1 g) với piperacillin/tazobactam (truyền tĩnh mạch mỗi 6 giờ; mỗi lần 3,375 g) dùng trong 7-14 ngày, bao gồm nhiễm khuẩn chi dưới do đái tháo đường đường, áp-xe sâu mô mềm, nhiễm khuẩn vết thương sau chấn thương, viêm mô tế bào đang dẫn lưu mủ. Tỷ lệ thành công trên lâm sàng vào 10-21 ngày sau thời kỳ điều trị (đánh giá khỏi bệnh) là 82,2% (152/185) với ertapenem và 84,5% (147/174) với piperacillin/tazobactam.
Ertapenem được đánh giá hiệu quả trong điều trị nhiễm trùng bàn chân do đái tháo đường trong một thử nghiệm lâm sàng có đối chứng, mù đôi, đa trung tâm, phân nhóm ngẫu nhiên. Nghiên cứu này so sánh (1 g IV ngày 1 lần) với piperacillin/tazobactam (3,375 g IV mỗi 6 giờ) trên 586 bệnh nhân. Cả 2 phác đồ điều trị đều cho phép chuyển sang liệu pháp amoxicillin/clavuclanate đường uống với thời gian điều trị tổng cộng là 5-28 ngày (cả đường tiêm và đường uống). Tỷ lệ thành công trên lâm sàng trong vào 10 ngày sau trị liệu là 87,4% (180/206) đối với ertapenem và 82,7% (162/196) đối với piperacillin/tazobactam.
Trong hai thử nghiệm lâm sàng trên 866 người lớn điều trị viêm phổi mắc phải tại cộng đồng, ertapenem (mỗi ngày tiêm một lần 1 g) được so sánh với ceftriaxone (mỗi ngày tiêm một lần 1 g). Cả hai phác đồ đều cho phép chuyển sang liệu pháp amoxicillin/clavulanate đường uống với thời gian điều trị tổng cộng là 10-14 ngày (cả tiêm và uống). Tỷ lệ thành công trên lâm sàng (gộp 2 nghiên cứu) vào 7-14 ngày sau thời kỳ điều trị (đánh giá khỏi bệnh) là 92% (335/364) với ertapenem và 91,8% (270/294) với ceftriaxone.
Trong hai thử nghiệm lâm sàng trên 850 người lớn điều trị viêm đường tiết niệu có biến chứng, bao gồm viêm thận-bể thận, ertapenem (mỗi ngày tiêm 1 lần 1 g) được so sánh với ceftriaxone (mỗi ngày tiêm một lần 1 g). Cả hai phác đồ đều cho phép chuyển sang liệu pháp ciprofloxacin đường uống (500 mg, ngày uống 2 lần) với thời gian điều trị tổng cộng là 10-14 ngày (cả tiêm và uống). Tỷ lệ thành công về vi sinh học (gộp 2 nghiên cứu) vào 5-9 ngày sau thời kỳ điều trị (đánh giá khỏi bệnh) là 89,5% (229/256) với ertapenem và 91,1% (204/224) với ceftriaxone.
Trong một thử nghiệm lâm sàng, đánh giá ertapenem (1 g truyền tĩnh mạch, ngày 1 lần) so với piperacillin/tazobactam (3,375 g tiêm tĩnh mạch mỗi 6 giờ) dùng trong 3-10 ngày trong điều trị viêm vùng chậu cấp trên tổng cộng 412 người lớn bao gồm 350 người nhiễm trùng lúc sinh/sau khi sinh và 45 người nạo thai nhiễm khuẩn. Tỷ lệ thành công trên lâm sàng vào 2-4 tuần sau thời kỳ điều trị (đánh giá khỏi bệnh) là 93,9% (153/163) với ertapenem và 91,5% (140/153) với piperacillin/tazobactam.
Một thử nghiệm đa trung tâm, mù đôi, phân nhóm ngẫu nhiên đánh giá hiệu quả dự phòng trong phẫu thuật trên 1002 người lớn, so sánh INVANZ IV (1 g) với cefotetan IV (2 g) tiêm truyền kéo dài 30 phút vào 1giờ trước khi phẫu thuật đại trực tràng theo chương trình. Tỷ lệ đáp ứng lâm sàng có lợi nói chung vào 4 tuần sau phẫu thuật (tiêu chí chủ yếu đánh giá hiệu quả) là 72,0% cho nhóm bệnh nhân dùng ertapenem (N=338) và 57,2% ở nhóm dùng cefotetan (N=334) (khác biệt 14,8%, [95% CI là 7,5%-21,9%]), cho thấy hiệu quả vượt trội của ertapenem so với thuốc đối chứng trong điều trị dự phòng cho các bệnh nhân phẫu thuật đại trực tràng theo chương trình.
Trẻ em: Ertapenem được đánh giá trong hai thử nghiệm lâm sàng đa trung tâm, mù đôi, phân nhóm ngẫu nhiên trên các bệnh nhi từ 3 tháng đến 17 tuổi. Thử nghiệm đầu tiên kết nạp 404 bệnh nhi, so sánh ertapenem (15 mg/kg truyền tĩnh mạch mỗi 12 giờ trên bệnh nhi từ 3 tháng đến 12 tuổi, và 1g truyền tĩnh mạch ngày 1 lần cho bệnh nhi tử 13 tuổi đến 17 tuổi) với ceftriaxone (50 mg/kg/ngày truyền tĩnh mạch chia 2 lần trên bệnh nhi từ 3 tháng đến 12 tuổi và 50 mg/kg/ngày truyền tĩnh mạch ngày 1 lần trên bệnh nhi từ 13 tuổi đến 17 tuổi trong điều trị nhiễm khuẩn tiết niệu có biến chứng, nhiễm khuẩn da và mô mềm hoặc viêm phổi mắc phải tại cộng đồng. Cả hai phác đồ đều cho phép chuyển sang dạng uống amoxicillin/clavulanate với thời gian điều trị tổng cộng 14 ngày (tiêm và uống). Tỉ lệ thành công về vi khuẩn học được đánh giá trong một phân tích dựa trên protocol ở các bệnh nhi nhiễm khuẩn tiết niệu có biến chứng cho thấy là 87,0% (40/46) đối với ertapenem và 90,0% (18/20) đối với ceftriazone. Tỉ lệ thành công trong một phân tích dựa trên protocol ở các bệnh nhi được điều trị nhiễm khuẩn da và mô mềm là 95,5% (64/67) đối với ertapenem và 100% (26/26) đối với ceftriaxone, và ở các bệnh nhân được điều trị viêm phổi mắc phải tại cộng đồng là 96,1% (74/77) đối với ertapenem và 96,4% (27/28) đối với ceftriaxone.
Thử nghiệm thứ hai kết nạp 112 bệnh nhi và so sánh ertapenem (15 mg/kg truyền tĩnh mạch mỗi 12 giờ trên các bệnh nhi từ 3 tháng đến 12 tuổi, và 1g truyền tĩnh mạch ngày 1 lần trên bệnh nhi từ 13 tuổi đến 17 tuổi) với ticarcillin/clavulanate (50 mg/kg đối với bệnh nhi <60 kg hoặc 3,0 g đối với bệnh nhi >60 kg, ngày 4 hoặc 6 lần) trong thời gian 14 ngày trong điều trị nhiễm khuẩn ổ bụng có biến chứng và nhiễm khuẩn vùng chậu cấp. Trên các bệnh nhi được điều trị nhiễm khuẩn ổ bụng có biến chứng (là những bệnh nhi trước đây có lỗ dò hoặc viêm ruột thừa có biến chứng) tỉ lệ thành công trên lâm sàng là 83,7% (36/43) đối với ertapenem và 63,6% (7/11) đối với ticarcillin/clavulanate trong một phân tích dựa trên protocol. Trên các bệnh nhi được điều trị nhiễm khuẩn vùng chậu cấp (hậu phẫu hoặc viêm nội mạc tử cung sản khoa tự phát hoặc phá thai nhiễm trùng) tỉ lệ thành công lâm sàng là 100% (23/23) đối với ertapenem và 100% (4/4) đối với đối với ticarcillin/clavulanate trong một phân tích dựa trên protocol.
Dược động học
• Hấp thu: Thuốc tiêm ertapenem pha với dung dịch tiêm lidocain HCI 1% (Dược điển Mỹ), pha trong nước muối không có epinephrine, rất dễ hấp thu sau khi tiêm bắp với liều khuyến cáo 1 g. Sinh khả dụng trung bình khoảng 92%. Sau khi tiêm bắp liều 1 g/ngày, nồng độ đỉnh trung bình trong huyết tương (Cmax) đạt sau khoảng 2 giờ (Tmax).
• Phân phối: Ertapenem gắn kết nhiều với protein huyết tương. Ở người lớn trẻ tuổi khỏe mạnh, mức độ gắn kết protein của ertapenem sẽ giảm khi nồng độ trong huyết tương tăng. Khi nồng độ huyết tương < 100mcg/mL, thì gắn khoảng 95% nhưng khi nồng độ huyết tương khoảng 300mcg/mL thì chỉ gắn khoảng 85%.
Bảng 3 sau đây trình bày nồng độ trung bình trong huyết tương (mcg/mL) của ertapenem sau khi truyền tĩnh mạch một lần liều 1 g hoặc 2 g kéo dài 30 phút và tiêm bắp liều duy nhất 1 g cho người lớn trẻ tuổi khỏe mạnh.
- xem Bảng 3.

Diện tích dưới đường cong (AUC) của ertapenem tăng gần như tỷ lệ thuận với liều lượng trong khoảng 0,5-2 g.
Không có tích lũy ertapenem ở người lớn sau khi truyền tĩnh mạch nhiều liều, mỗi ngày 0,5-2 g hoặc tiêm bắp mỗi ngày 1 g.
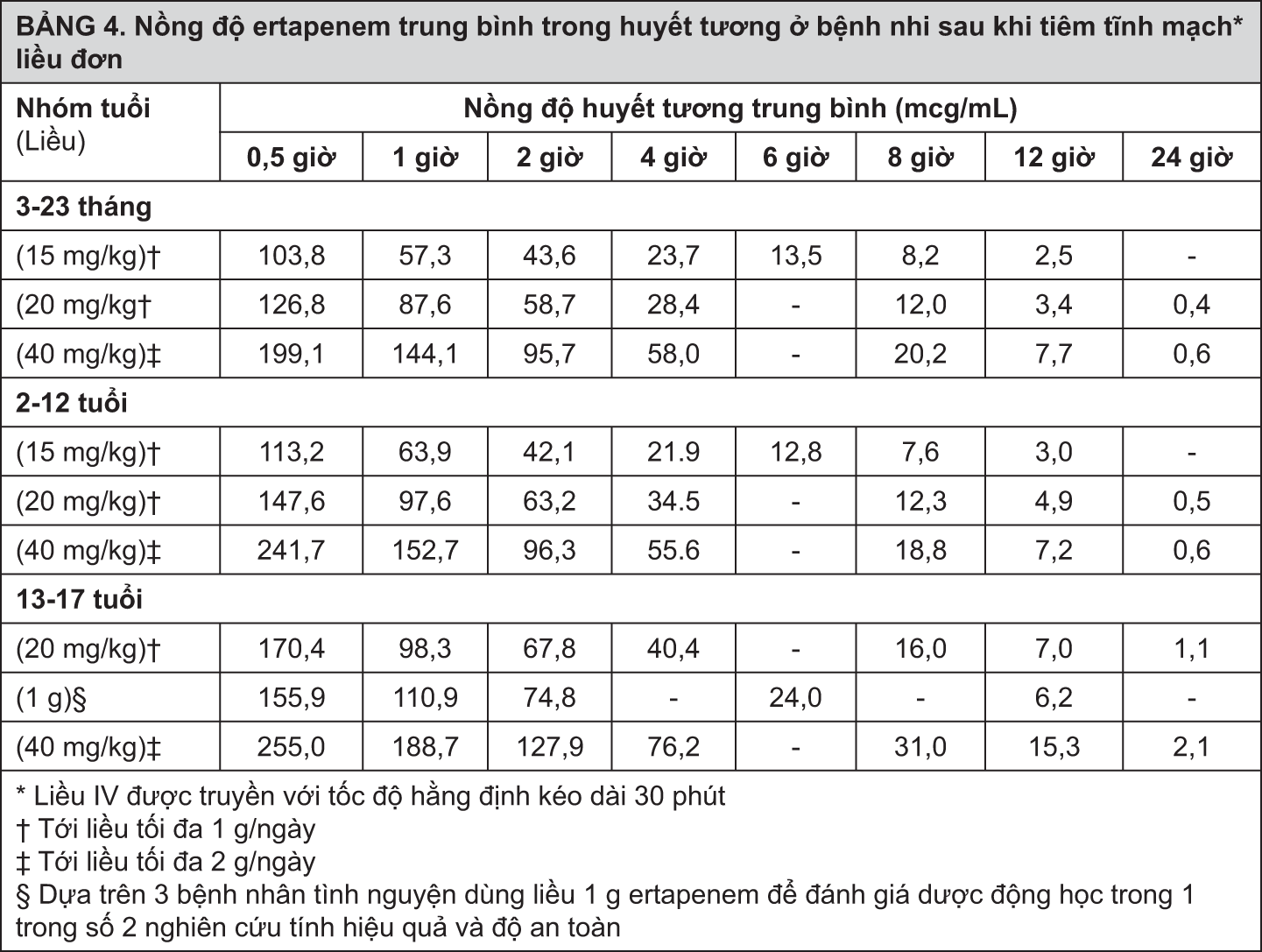
Nồng độ ertapenem trung bình trong huyết tương (mcg/mL) ở bệnh nhi được trình bày trong Bảng 4.
- xem Bảng 4.
Thể tích phân phối (Vdss) của ertapenem ở người lớn khoảng 8 lít (0,11 lít/kg) và xấp xỉ 0,2 lít/kg ở bệnh nhi từ 3 tháng đến 12 tuổi và xấp xỉ 0,16 lít/kg ở bệnh nhi từ 13-17 tuổi.
Ertapenem thấm được vào vết rộp da do áp lực hút tạo nên. Nồng độ của ertapenem trong dịch của vết rộp da ở mỗi thời điểm lấy bệnh phẩm trong ngày điều trị thứ ba với liều 1 g truyền tĩnh mạch ngày 1 lần được trình bày ở Bảng 5. Tỷ số AUC ở dịch vết rộp da so với AUC trong huyết tương là 0,61.
- xem Bảng 5.

Hàm lượng ertapenem trong sữa mẹ, thu thập ở 5 bà mẹ cho con bú được đo ở các thời điểm chọn ngẫu nhiên trong ngày, xét nghiệm liên tục 5 ngày sau khi truyền tĩnh mạch liều ertapenem cuối cùng. Nồng độ của ertapenem trong sữa của cả 5 bà mẹ vào ngày điều trị cuối cùng (5-14 ngày sau khi sinh) là < 0,38mcg/mL; không đánh giá nồng độ đỉnh. Đến ngày thứ 5 sau khi ngừng điều trị, không còn tìm thấy ertapenem trong sữa của 4 bà mẹ và chỉ còn vết trong sữa của một bà mẹ (< 0,13mcg/mL).
Nghiên cứu in vitro cho thấy enapenem không ức chế sự vận chuyển digoxin hoặc vinblastin qua trung gian P-glycoprotein và ertapenem không phải là chất nền trong sự chuyển hóa qua trung gian P-glycoprotein (xem Tương tác thuốc).
• Chuyển hóa: Nghiên cứu in vitro trên microsome tế bào gan người cho thấy ertapenem không ức chế sự chuyển hóa của những thuốc qua xúc tác của 6 đồng dạng cytochrom P450 (CYP) chủ yếu là 1A2, 2C9, 2C19, 2D6, 2E1 và 3A4 (xem Tương tác thuốc).
• Đào thải: Ertapenem đào thải chủ yếu qua thận. Ở người lớn trẻ tuổi, khỏe mạnh và người bệnh từ 13-17 tuổi, thời gian bán thải trong huyết tương khoảng 4 giờ và khoảng 2,5 giờ ở bệnh nhi từ 3 tháng đến 12 tuổi.
Sau khi truyền tĩnh mạch 1 g ertapenem được đánh dấu phóng xạ, khoảng 80% thải qua nước tiểu, 10% theo phân. Trong 80% liều thuốc tìm thấy trong nước tiểu, thì khoảng 38% thuốc ở dạng không đổi và khoảng 37% là chất chuyển hóa có vòng β-lactam mở.
Ở người lớn trẻ tuổi khỏe mạnh truyền tĩnh mạch 1 g, nồng độ trung bình ertapenem trong nước tiểu vượt quá 984mcg/mL trong 0-2 giờ sau khi tiêm và vượt quá 52mcg/mL trong 12-24 giờ sau khi tiêm.
Đặc điểm của người bệnh
+ Giới: Nồng độ ertapenem/huyết tương không phụ thuộc giới.
+ Người cao tuổi: Nồng độ ertapenem trong huyết tương sau khi truyền tĩnh mạch 1 g và 2 g ertapenem cho người cao tuổi ≥ 65 tuổi là khoảng 39% và 22%, cao hơn một chút so với người lớn trẻ tuổi (< 65 tuổi). Không cần điều chỉnh liều lượng ở người cao tuổi.
+ Bệnh nhi: Nồng độ huyết tương của ertapenem ở bệnh nhi 13-17 tuổi tương đương với người lớn dùng liều 1 g tiêm truyền tĩnh mạch ngày 1 lần.
Giá trị các thông số động học ở bệnh nhi từ 13-17 tuổi khi dùng liều 20 mg/kg (tối đa 1 g) nhìn chung tương tự ở người lớn trẻ khỏe mạnh. Ba trong số sáu bệnh nhân từ 13-17 tuổi dùng liều ít hơn 1 g. Để ước tính các dữ liệu dược động học khi tất cả các bệnh nhân trong nhóm tuổi này đều dùng liều 1 g, dữ liệu dược động học được điều chỉnh theo liều 1 g, với giả định tuyến tính theo liều dùng. So sánh các kết quả cho thấy các bệnh nhân từ 13-17 tuổi dùng liều 1 g ertapenem ngày 1 lần đạt được các đặc tính dược động tương đương ở người lớn. Tỷ số (nhóm 13-17 tuổi/người lớn) của các giá trị AUC là 0,99, nồng độ ngay khi kết thúc tiêm truyền là 1,20 và nồng độ tại điểm giữa của khoảng cách các liều là 0,84.
Nồng độ huyết tương tại điểm giữa của khoảng cách các liều khi tiêm tĩnh mạch ertapenem liều đơn 15 mg/kg cho bệnh nhi từ 3 tháng đến 12 tuổi thì tương đương với nồng độ huyết tương tại điểm giữa của khoảng cách các liều khi tiêm tĩnh mạch liều 1 g ngày 1 lần ở người lớn (xem Phân phối). Độ thanh thải ertapenem tại huyết tương (mL/phút/kg) ở bệnh nhi từ 3 tháng đến 12 tuổi cao hơn xấp xỉ 2 lần ở người lớn. Khi dùng liều 15 mg/kg, giá trị AUC (gấp đôi đối với chế độ điều trị 2 lần/ngày, nghĩa là 30 mg/kg/ngày) ở bệnh nhi từ 3 tháng đến 12 tuổi thì tương tự giá trị AUC ở người lớn trẻ tuổi khỏe mạnh được truyền tĩnh mạch liều đơn 1 g ertapenem.
+ Suy gan: Chưa xác định dược động học của ertapenem ở người suy gan. Do thuốc này ít chuyển hóa qua gan, nên dược động học của thuốc không bị ảnh hưởng khi suy gan. Vì vậy, không cần chỉnh liều khi suy gan.
+ Suy thận: Sau khi truyền tĩnh mạch ertapenem một liều đơn 1 g ở người lớn, AUC ở người suy thận nhẹ (độ thanh lọc creatinin từ 60-90mL/phút/1,73m2) tương đương với AUC ở người khỏe mạnh (25-82 tuổi). Nhưng ở người suy thận vừa (độ thanh lọc creatinin từ 31-59mL/phút/1,73m2), AUC tăng khoảng 1,5 lần so với ở người khỏe mạnh. Ở người suy thận tiến triển (độ thanh lọc creatinin từ 5-30mL/phút/1,73m2), AUC tăng khoảng 2,6 lần so với người khỏe mạnh. Ở người suy thận giai đoạn cuối (độ thanh lọc creatinin < 10mL/phút/1,73m2), AUC tăng khoảng 2,9 lần so với ở người khỏe mạnh. Sau khi truyền tĩnh mạch một liều 1 g ngay trước khi thẩm phân máu, khoảng 30% liều dùng được tìm thấy trong dịch thẩm phân. Không có dữ liệu ở bệnh nhi bị suy thận.
Cần chỉnh liều ertapenem ở người lớn bị suy thận tiến triển hoặc ở giai đoạn cuối (xem Liều lượng và Cách dùng).
Chỉ định/Công dụng
Điều trị: INVANZ được chỉ định để điều trị các bệnh nhiễm khuẩn từ trung bình tới nặng do các vi khuẩn nhạy cảm với kháng sinh này, cũng như điều trị khởi đầu theo kinh nghiệm trước khi xác định được vi khuẩn gây bệnh trong các bệnh nhiễm khuẩn sau:
- Nhiễm khuẩn ổ bụng có biến chứng
- Nhiễm khuẩn da và mô mềm phức tạp, bao gồm nhiễm khuẩn bàn chân đái tháo đường
- Viêm phổi mắc phải tại cộng đồng
- Nhiễm khuẩn đường tiết niệu có biến chứng bao gồm viêm thận-bể thận
- Nhiễm khuẩn vùng chậu cấp, bao gồm viêm nội mạc-cơ tử cung sau sinh, nạo thai nhiễm khuẩn, nhiễm khuẩn phụ khoa sau mổ
- Nhiễm khuẩn huyết
Dự phòng: INVANZ được chỉ định để dự phòng nhiễm trùng tại chỗ phẫu thuật ở người lớn trong phẫu thuật đại trực tràng theo chương trình mổ phiên.
Liều lượng & Cách dùng
Liều thường dùng của INVANZ ở bệnh nhân từ 13 tuổi trở lên là 1 g, ngày 1 lần. Liều thường dùng của INVANZ ở bệnh nhi từ 3 tháng đến 12 tuổi là 15 mg/kg, ngày 2 lần (không quá 1 g/ngày).
Có thể truyền tĩnh mạch hoặc tiêm bắp. Nếu dùng đường tĩnh mạch, thời gian truyền tĩnh mạch phải hơn 30 phút.
Có thể tiêm bắp thay vì truyền tĩnh mạch INVANZ, để điều trị các nhiễm khuẩn chỉ cần tiêm bắp.
Thời gian điều trị với INVANZ thông thường là 3-14 ngày, nhưng thay đổi tùy theo loại bệnh nhiễm khuẩn, và vi khuẩn gây bệnh (xem Chỉ định). Nếu có chỉ định lâm sàng, có thể chuyển sang kháng sinh đường uống khi thấy có cải thiện về lâm sàng.
Trong các nghiên cứu lâm sàng có đối chứng, người bệnh được điều trị từ 3 tới 14 ngày. Thời gian điều trị kéo dài bao lâu là do bác sĩ điều trị quyết định dựa vào vị trí và mức độ nghiêm trọng của nhiễm khuẩn, và vào đáp ứng lâm sàng của người bệnh. Trong một số nghiên cứu, bác sĩ quyết định chuyển điều trị sang kháng sinh đường uống sau khi thấy có cải thiện về lâm sàng.
Dự phòng nhiễm trùng tại chỗ ở người lớn sau phẫu thuật đại trực tràng theo chương trình mổ phiên: Để ngăn ngừa nhiễm trùng tại chỗ sau phẫu thuật đại trực tràng theo chương trình, liều khuyến cáo là 1 g truyền tĩnh mạch, dùng liều duy nhất 1 giờ trước khi phẫu thuật.
Với người suy thận: Có thể dùng INVANZ điều trị bệnh nhiễm khuẩn cho người suy thận. Với người bệnh có độ thanh lọc creatinin > 30mL/phút/1,73m2, thì không cần điều chỉnh liều. Nhưng với người lớn suy thận đang tiến triển (độ thanh lọc creatinin ≤ 30mL/phút/1,73m2) bao gồm người đang được thẩm phân máu, thì liều mỗi ngày cần là 500 mg. Không có dữ liệu về sử dụng thuốc ở bệnh nhi bị suy thận.
Với người đang được thẩm phân máu: trong một nghiên cứu lâm sàng, sau khi truyền tĩnh mạch một liều duy nhất 1 g ertapenem trước khi thẩm phân, có khoảng 30% liều được tìm thấy trong dịch thẩm phân. Khi dùng INVANZ liều 500 mg/ngày trong vòng 6 giờ trước thẩm phân ở bệnh nhân người lớn, nên bổ sung thêm liều 150 mg sau khi thẩm phân xong. Nhưng nếu đã dùng INVANZ ít nhất 6 giờ trước khi thẩm phân, thì không cần liều bổ sung. Chưa có dữ liệu ở người bệnh lọc máu hoặc thẩm phân màng bụng. Chưa có dữ liệu ở bệnh nhi được thẩm phân máu.
Nếu chỉ có nồng độ creatinin-máu, thì dùng công thức Cockcroft và Gault** để xác định độ thanh lọc creatinin. Khi đó, nồng độ creatinin-máu có thể tương ứng với trạng thái ổn định của chức năng thận:
Nam = [thể trọng (kg) x (140 - tuổi theo năm)] / [(72) x creatinin huyết thanh (mg/100mL)]
Nữ = 0,85 x giá trị của nam (tính theo công thức trên)
Không cần chỉnh liều với người suy gan (Xem Dược động học, Đặc điểm của người bệnh, Suy gan)
Liều dùng INVANZ không phụ thuộc tuổi (13 tuổi hoặc lớn hơn) hoặc giới tính.
HƯỚNG DẪN CÁCH DÙNG
Bệnh nhân 13 tuổi hoặc lớn hơn
Chuẩn bị dung dịch truyền tĩnh mạch
ĐỪNG TRỘN LẪN HAY CÙNG TRUYỀN INVANZ VỚI CÁC THUỐC KHÁC
ĐỪNG HOÀN NGUYÊN VỚI CÁC DUNG DỊCH CÓ CHỨA DEXTROSE (α-D-GLUCOSE)
CẦN HOÀN NGUYÊN VÀ PHA LOÃNG INVANZ TRƯỚC KHI TIÊM
1. Dùng 10 mL của một trong các dung môi sau, bơm vào lọ INVANZ 1 g để hoàn nguyên: nước pha tiêm, dung dịch tiêm NaCl 0,9%, hoặc nước pha tiêm có chất kiềm khuẩn.
2. Lắc kỹ để hòa tan hết, sau đó chuyển ngay sang lọ chứa 50 mL dung dịch tiêm NaCl 0,9%.
3. Hoàn tất truyền tĩnh mạch trong vòng 6 giờ sau khi đã hoàn nguyên.
Chuẩn bị dung dịch tiêm bắp
CẦN HOÀN NGUYÊN INVANZ TRƯỚC KHI TIÊM
1. Hoàn nguyên lọ 1 g INVANZ với 3,2 mL dung dịch tiêm lidocain HCl 1% hoặc 2%*** (không chứa epinephrine). Lắc kỹ lọ để hòa tan hết thuốc.
2. Rút ngay dung dịch vừa pha và tiêm bắp sâu vào nơi có khối cơ lớn (như cơ mông, hoặc phần bên đùi)
3. Dung dịch đã pha để tiêm bắp cần dùng trong vòng 1 giờ sau khi đã hoàn nguyên.
Chú ý: Tuyệt đối không được truyền tĩnh mạch dung dịch này.
Bệnh nhi từ 3 tháng đến 12 tuổi
Chuẩn bị dung dịch truyền tĩnh mạch
ĐỪNG TRỘN LẪN HAY CÙNG TRUYỀN INVANZ VỚI CÁC THUỐC KHÁC
ĐỪNG HOÀN NGUYÊN VỚI CÁC DUNG DỊCH CÓ CHỨA DEXTROSE (α-D-GLUCOSE)
CẦN HOÀN NGUYÊN VÀ PHA LOÃNG INVANZ TRƯỚC KHI TIÊM
1. Dùng 10 mL của một trong các dung môi sau, bơm vào lọ INVANZ 1 g để hoàn nguyên: nước pha tiêm, dung dịch tiêm NaCl 0,9% hoặc nước pha tiêm có chất kiềm khuẩn.
2. Lắc kỹ để hòa tan hết, sau đó rút một thể tích tương đương với 15 mg/kg thể trọng (không quá 1 g/ngày) hòa vào dung dịch tiêm NaCl 0,9% để đạt được nồng độ cuối cùng là 20 mg/mL hoặc thấp hơn.
3. Hoàn tất truyền tĩnh mạch trong vòng 6 giờ dung dịch sau khi đã hoàn nguyên.
Chuẩn bị dung dịch tiêm bắp
CẦN HOÀN NGUYÊN INVANZ TRƯỚC KHI TIÊM
1. Hoàn nguyên lọ 1 g INVANZ với 3,2 mL của dung dịch tiêm lidocain HCl 1% hoặc 2% (không chứa epinephrine). Lắc kỹ lọ để hòa tan hết thuốc.
2. Rút ngay dung dịch vừa pha một thể tích tương đương 15 mg/kg thể trọng (không quá 1 g/ngày) và tiêm bắp sâu vào nơi có khối cơ lớn (như cơ mông hoặc phần bên đùi).
3. Nên dùng dung dịch đã pha để tiêm bắp trong vòng 1 giờ sau khi đã hoàn nguyên.
Chú ý: Tuyệt đối không được tiêm truyền tĩnh mạch dung dịch này.
Thuốc tiêm cần được kiểm tra kỹ bằng mắt xem có vật lạ hoặc đổi màu trước khi sử dụng. Dung dịch INVANZ là từ không màu tới vàng nhạt. Nếu thay đổi màu trong phạm vi này thì không có ảnh hưởng tới hiệu lực của thuốc.
Thận trọng lúc dùng
Đã có những báo cáo phản ứng quá mẫn nghiêm trọng, có khi tử vong (phản vệ) ở người bệnh dùng kháng sinh β-lactam. Những phản ứng này dễ gặp hơn ở người đã có tiền sử mẫn cảm với nhiều loại dị nguyên. Đã có những báo cáo về người bệnh có tiền sử quá mẫn với penicillin thì cũng có những phản ứng quá mẫn nghiêm trọng khi dùng các β-lactam khác. Vì vậy, trước khi dùng INVANZ, cần điều tra kỹ tiền sử người bệnh về các phản ứng quá mẫn trước đây với các penicillin, cephalosporin, các β-lactam khác và với những dị nguyên khác. Nếu gặp phản ứng dị ứng với INVANZ, phải ngừng thuốc ngay. Cần điều trị cấp cứu kịp thời các phản ứng phản vệ nghiêm trọng.
Những báo cáo trên y văn về các trường hợp riêng lẻ cho thấy rằng sử dụng carbapenems, bao gồm ertapenem, đồng thời với acid valproic hoặc divalproex sodium sẽ làm giảm nồng độ acid valproic. Nồng độ acid valproic có thể bị giảm thấp hơn nồng độ trị liệu do tương tác này, do đó có thể làm tăng nguy cơ co giật. Tăng liều acid valproic hoặc divalproex sodium có thể không đủ khắc phục được tương tác này. Nhìn chung, không khuyến cáo dùng acid valproic/divalproex sodium chung với ertapenem. Có thể dùng các kháng sinh khác ngoài carbapenems để trị các bệnh nhiễm khuẩn ở các bệnh nhân đang được kiểm soát tốt cơn co giật với acid valproic hoặc divalproex sodium. Nếu cần thiết phải dùng INVANZ, nên xem xét dùng thêm một liệu pháp chống co giật khác (xem Tương tác).
Cũng như các kháng sinh khác, dùng INVANZ kéo dài sẽ làm tăng sinh các chủng vi khuẩn không nhạy cảm với kháng sinh này. Cần phải đánh giá liên tục tình trạng bệnh. Nếu bội nhiễm xảy ra trong khi điều trị, cần có biện pháp điều trị thích hợp.
Đã có các báo cáo về viêm ruột kết màng giả, từ nhẹ tới ảnh hưởng tới tính mạng với hầu hết các thuốc kháng sinh kể cả ertapenem. Vì vậy, cần nghĩ đến biến chứng này khi chẩn đoán người bệnh bị tiêu chảy sau khi dùng thuốc kháng khuẩn. Các nghiên cứu cho thấy một độc tố tiết ra từ Clostridium difficile là nguyên nhân hàng đầu của "viêm ruột kết do kháng sinh".
Cần thận trọng khi tiêm bắp INVANZ, để tránh vô tình tiêm vào mạch máu (xem Liều lượng và Cách dùng).
Lidocaine HCl là dung môi dùng để tiêm bắp INVANZ (xin tham khảo thông tin kê đơn lidocaine HCl).
Trẻ em: Tính an toàn và hiệu lực của INVANZ ở bệnh nhi từ 3 tháng đến 17 tuổi đã được chứng minh qua tài liệu từ các nghiên cứu đầy đủ và có đối chứng tốt ở người lớn, các dữ liệu Dược động học ở bệnh nhi, và các dữ liệu bổ sung từ các nghiên cứu dùng các thuốc khác đối chứng ở bệnh nhi từ 3 tháng đến 17 tuổi có các nhiễm trùng sau đây (xem Chỉ định và Dược động học, Đặc điểm của người bệnh, Bệnh nhi).
- Nhiễm khuẩn ổ bụng có biến chứng
- Nhiễm khuẩn da và các tổ chức da có biến chứng
- Viêm phổi mắc phải tại cộng đồng
- Nhiễm khuẩn đường tiết niệu có biến chứng
- Nhiễm khuẩn vùng chậu cấp
- Nhiễm khuẩn huyết
Không khuyến cáo sử dụng INVANZ ở trẻ em dưới 3 tháng tuổi vì không có dữ liệu nghiên cứu trên đối tượng này.
Người cao tuổi: Trong nghiên cứu lâm sàng, tính an toàn và hiệu lực của INVANZ ở người cao tuổi (≥ 65 tuổi) cũng tương đương như ở người trẻ tuổi hơn (< 65 tuổi).
Quá Liều
Không có thông tin đặc biệt về ảnh hưởng do điều trị quá liều INVANZ. Không thấy có độc tính đáng kể trên người tình nguyện trưởng thành khỏe mạnh tiêm tĩnh mạch mỗi ngày 3 g INVANZ, dùng trong 8 ngày. Trong nghiên cứu lâm sàng ở người lớn, vô tình dùng mỗi ngày tới 3 g không gây ra phản ứng quan trọng trong lâm sàng. Trong các nghiên cứu lâm sàng ở trẻ em, tiêm tĩnh mạch một liều đơn 40 mg/kg đến liều tối đa là 2 g cũng không gây độc tính.
Nếu sử dụng quá liều, cần ngừng INVANZ và điều trị hỗ trợ chung tới khi thuốc đào thải được qua thận.
Có thể thải INVANZ nhờ thẩm phân máu; tuy nhiên, chưa có thông tin báo cáo về sử dụng thẩm phân máu để điều trị quá liều INVANZ.
Chống chỉ định
Người quá mẫn với các thành phần của INVANZ hoặc với các kháng sinh cùng nhóm, hoặc ở người bệnh đã có phản ứng phản vệ với β-lactam.
Do sử dụng dung môi lidocain HCl pha dung dịch tiêm bắp, nên chống chỉ định tiêm bắp INVANZ cho người được biết quá mẫn với thuốc tê nhóm amid và ở người bệnh bị sốc phản vệ hoặc blốc tim (xin tham khảo thông tin kê đơn với lidocain HCl).
Sử dụng ở phụ nữ có thai và cho con bú
Thời kỳ mang thai: Chưa có những nghiên cứu đầy đủ và có đối chứng tốt trên phụ nữ mang thai. Chỉ dùng INVANZ trong thai kỳ nếu lợi ích điều trị hơn hẳn nguy cơ có thể xảy ra cho mẹ và cho thai.
Thời kỳ cho con bú: Ertapenem bài tiết qua sữa mẹ (xem Dược động học, Phân phối). Thận trọng khi dùng INVANZ cho bà mẹ đang cho con bú.
Tương tác
Khi phối hợp ertapenem với probenecid, probenecid cạnh tranh dẫn đến ức chế sự đào thải chủ động ertapenem qua ống thận, nên làm tăng tuy ít nhưng có ý nghĩa thống kê về thời gian bán thải (tăng 19%) và nồng độ của ertapenem trong cơ thể (25%). Không cần điều chỉnh liều ertapenem khi phối hợp với probenecid. Vì tác dụng không đáng kể tới thời gian bán thải của ertapenem, nên không khuyến cáo dùng phối hợp probenecid để kéo dài thời gian bán thải của ertapenem.
Nghiên cứu in vitro cho thấy ertapenem không ức chế sự vận chuyển digoxin hoặc vinblastin qua trung gian P-glycoprotein và ertapenem không phải là chất nền dùng trong sự vận chuyển qua trung gian P-glycoprotein. Nghiên cứu in vitro trên microsome gan người, thấy ertapenem không ức chế chuyển hóa của thuốc khác qua xúc tác của 6 đồng dạng cytochrom p450 (CYP) chủ yếu là: 1A2, 2C9, 2C19, 2D6, 2E1 và 3A4. Chưa chắc có tương tác thuốc với ertapenem qua cơ chế ức chế thanh thải thuốc qua trung gian của P-glycoprotein hoặc qua xúc tác của cytochrom p450 (xem Dược động học, Phân phối và Chuyển hóa).
Ngoài probenecid, chưa thực hiện các nghiên cứu chuyên biệt khác về tương tác trên lâm sàng.
Những báo cáo trên y văn về các trường hợp riêng lẻ cho thấy sử dụng carbapenem, bao gồm ertapenem, đồng thời với acid valproic hoặc divalproex sodium sẽ làm giảm nồng độ acid valproic. Nồng độ acid valproic có thể bị giảm thấp hơn nồng độ trị liệu do tương tác này, do đó có thể làm tăng nguy cơ co giật. Mặc dù cơ chế của tương tác này chưa được biết rõ, dữ liệu từ các nghiên cứu trên động vật và in vitro cho thấy carbapenems có thể ức chế sự thủy phân chất chuyển hóa glucuronide của acid valproic (VPA-g) thành acid valproic, do đó làm giảm nồng độ huyết thanh của acid valproic (xem Thận trọng).
Tác dụng ngoại ý
Người lớn: Trong các nghiên cứu lâm sàng, tổng số người bệnh dùng ertapenem là hơn 1900, trong đó hơn 1850 người dùng INVANZ liều 1 g. Phần lớn những tác dụng bất lợi được báo cáo trong nghiên cứu lâm sàng có mức độ nhẹ tới trung bình. Những tác dụng ngoại ý có liên quan đến ertapenem chiếm khoảng 20% số người bệnh được điều trị bằng ertapenem. Ngừng thuốc do tác dụng ngoại ý liên quan đến thuốc thường gặp ở 1,3% số người bệnh.
Những tác dụng ngoại ý liên quan đến thuốc hay gặp nhất khi dùng ertapenem là tiêu chảy (4,3%), tác dụng ngoại ý liên quan vị trí tiêm truyền (3,9%), buồn nôn (2,9%), nhức đầu (2,1%).
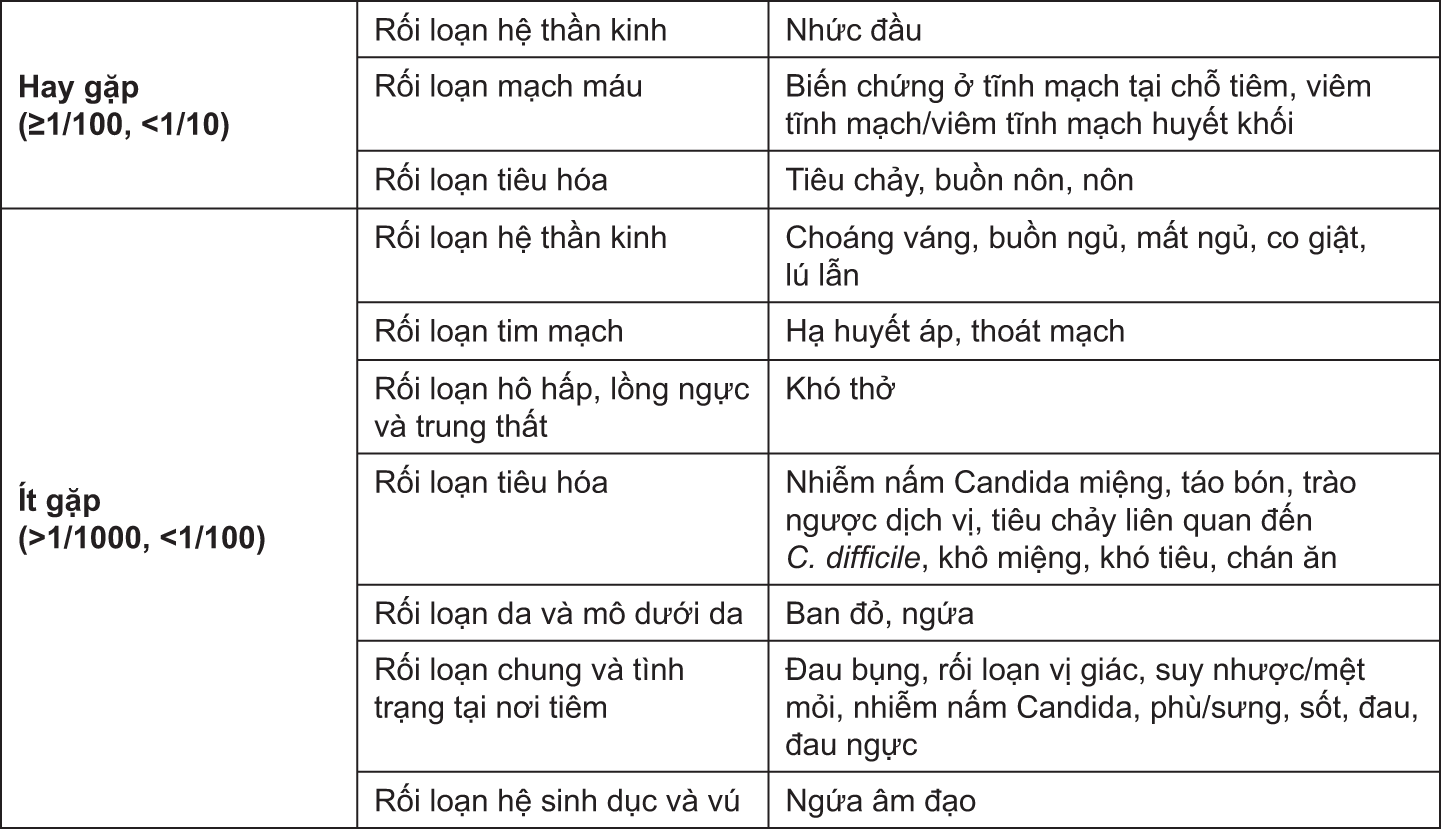
Sau khi truyền ertapenem, đã gặp ở người bệnh những phản ứng sau đây có liên quan tới dùng thuốc:
- xem Bảng.
Trong các nghiên cứu lâm sàng, tác dụng phụ co giật có thể gặp sau khi tiêm truyền là 0,2% người dùng ertapenem, ở 0,3% người dùng piperacillin/tazobactam và ở 0% người dùng ceftriaxione.
Trong phần lớn các nghiên cứu lâm sàng, kháng sinh dạng tiêm được tiếp nối bằng kháng sinh dạng uống (xem Dược lực học, Các nghiên cứu lâm sàng). Trong suốt thời kỳ điều trị và thời kỳ 14 ngày theo dõi sau điều trị, những tác dụng ngoại ý liên quan đến thuốc INVANZ bao gồm những tác dụng phụ đã nêu ở trên, cũng như phát ban và viêm âm đạo có tỷ lệ 1,0% (hay gặp) và các phản ứng dị ứng, khó chịu và nhiễm nấm có tỷ lệ > 0,1% nhưng < 1,0% (ít gặp).
Trong một nghiên cứu lâm sàng về điều trị nhiễm trùng bàn chân do đái tháo đường ở 289 bệnh nhân người lớn bị đái tháo đường được điều trị với ertapenem, tác dụng phụ bất lợi liên quan đến thuốc nhìn chung tương tự như các tác dụng ngoại ý đã quan sát trong các thử nghiệm lâm sàng trước đó.
Trong một nghiên cứu lâm sàng về sử dụng INVANZ trong dự phòng nhiễm trùng sau phẫu thuật đại trực tràng theo chương trình trên 476 bệnh nhân người lớn dùng 1 g ertapenem trước khi phẫu thuật, chỉ có chậm nhịp xoang là tác dụng bất lợi liên quan đến thuốc duy nhất không thấy trong các thử nghiệm lâm sàng trước đó đã được báo cáo với tỷ lệ > 0,1% nhưng < 1,0% (ít gặp).
Bệnh nhi: Có tổng cộng 384 bệnh nhi được điều trị với ertapenem trong các thử nghiệm lâm sàng. Đặc tính an toàn chung của thuốc ở trẻ em thì tương tự như người lớn. Trong các thử nghiệm lâm sàng, tác dụng phụ bất lợi trên lâm sàng liên quan đến thuốc phổ biến nhất trong suốt trị liệu được báo cáo là tiêu chảy (5,5%), đau tại nơi tiêm (5,5%), mẩn đỏ tại nơi tiêm (2,6%).
Các phản ứng bất lợi liên quan đến thuốc sau đây được báo cáo trong thời gian bệnh nhi điều trị với ertapenem: Hay gặp (≥ 1/100, < 1/10):
+ Rối loạn tiêu hóa: Tiêu chảy, nôn
+ Các rối loạn chung và tình trạng tại nơi tiêm: Mẩn đỏ tại nơi tiêm, đau tại nơi tiêm, viêm tĩnh mạch tại nơi tiêm, sưng tại nơi tiêm.
+ Các rối loạn da và mô dưới da: Phát ban
Các phản ứng bất lợi liên quan đến thuốc đã được báo cáo trong lúc điều trị trên > 0,5% nhưng < 1,0% số bệnh nhân dùng INVANZ trong các thử nghiệm lâm sàng thì bao gồm: Chai cứng tại nơi tiêm, ngứa tại nơi tiêm, viêm tĩnh mạch và nóng tại nơi tiêm.
Trong các nghiên cứu lâm sàng trên bệnh nhi, phần lớn các bệnh nhân được điều trị với kháng sinh đường tiêm sau đó chuyển sang kháng sinh đường uống thích hợp. Trong suốt thời gian điều trị và thời gian theo dõi 14 ngày sau trị liệu, các phản ứng bất lợi liên quan đến thuốc ở các bệnh nhân dùng INVANZ cũng tương tự như các phản ứng được liệt kê phía trên.
Báo cáo sau khi sử dụng: Những phản ứng bất lợi sau đây đã được báo cáo khi thuốc dùng trên thị trường:
+ Hệ miễn dịch: Phản vệ bao gồm cả các phản ứng dạng phản vệ
+ Rối loạn tâm thần: Thay đổi trạng thái tâm thần (bao gồm kích động, hung hăng, mê sảng, mất phương hướng, các thay đổi trạng thái tâm thần)
+ Rối loạn hệ thần kinh: Loạn vận động, ảo giác, giật rung cơ, run
+ Rối loạn da và mô dưới da: Ngứa, phát ban do thuốc với tăng bạch cầu ưa acid và những triệu chứng toàn thân (hội chứng DRESS).
Thay đổi cận lâm sàng
Người lớn: Những bất thường hay xảy ra nhất có liên quan tới thuốc khi dùng INVANZ là tăng enzym gan (ALT, AST), phosphatase kiềm và số lượng tiểu cầu.
Trong phần lớn các nghiên cứu lâm sàng, truyền INVANZ được tiếp nối bằng kháng sinh đường uống thích hợp (xem Dược lực học, Các nghiên cứu lâm sàng). Trong suốt thời kỳ điều trị và 14 ngày theo dõi sau điều trị, những thay đổi về cận lâm sàng có liên quan tới thuốc ở người dùng INVANZ không khác với những thay đổi đã nêu ở trên.
Những thay đổi khác về cận lâm sàng có liên quan tới thuốc bao gồm: tăng bilirubin trực tiếp trong huyết thanh, tăng bilirubin toàn phần huyết thanh, tăng bạch cầu ái toan, bilirubin gián tiếp huyết thanh, thời gian co cục máu đông, vi khuẩn niệu, nitơ u-rê máu, creatinin huyết thanh, glucose huyết thanh, bạch cầu đơn nhân, tế bào biểu mô trong nước tiểu, hồng cầu niệu; làm giảm bạch cầu ái kiềm, bạch cầu đa nhân trung tính, hemoglobin, hematocrit và số lượng tiểu cầu.
Trong một nghiên cứu lâm sàng trên 289 bệnh nhân điều trị nhiễm trùng bàn chân do đái tháo đường với ertapenem, nhìn chung, các thay đổi về cận lâm sàng liên quan đến thuốc tương tự như các bất thường đã quan sát thấy trong các thử nghiệm lâm sàng trước đó.
Trong một nghiên cứu lâm sàng trên 476 bệnh nhân điều trị dự phòng nhiễm trùng sau phẫu thuật đại trực tràng theo chương trình với 1 g ertapenem trước phẫu thuật, không có thêm các bất thường khác về cận lâm sàng trong quá trình điều trị được báo cáo.
Bệnh nhi: Các thay đổi về cận lâm sàng liên quan đến thuốc phổ biến nhất được quan sát thấy ở bệnh nhân sử dụng INVANZ là giảm bạch cầu trung tính.
Các thay đổi cận lâm sàng khác liên quan đến thuốc trong suốt quá trình điều trị và 14 ngày theo dõi gồm có: tăng ALT, AST, giảm bạch cầu, tăng bạch cầu eosin.
Bảo quản
Trước khi hoàn nguyên: Bảo quản ở nhiệt độ dưới 25oC.
Dung dịch đã hoàn nguyên để truyền
Sau khi hoàn nguyên, pha loãng ngay dung dịch thuốc với dung dịch tiêm NaCl 0,9% (xem Liều lượng và Cách dùng, Hướng dẫn sử dụng), và có thể sử dụng trong vòng 6 giờ khi bảo quản ở nhiệt độ phòng (25oC) hoặc bảo quản 24 giờ trong tủ lạnh ở nhiệt độ 5oC và dùng trong vòng 4 giờ sau khi lấy ra khỏi tủ lạnh. Không được làm đông đá dung dịch INVANZ.
-*-*-*-*-*-*-*-*-*-*-*-*-
† Viện tiêu chuẩn về xét nghiệm và lâm sàng (CLSI) (Trước đây là Ủy ban quốc gia về các tiêu chuẩn phòng xét nghiệm lâm sàng (NCCLS)). Các phương pháp pha loãng để thử nghiệm độ nhạy cảm với kháng sinh của các vi khuẩn hiếu khí. Xuất bản lần thứ 7. Tư liệu tiêu chuẩn của CLSI đã được duyệt số M7-A7, CLSI, Wayne, PA, Tháng 1/ 2006.
†† Viện tiêu chuẩn về xét nghiệm và lâm sàng (CLSI) (Trước đây là Ủy ban quốc gia về các tiêu chuẩn phòng xét nghiệm lâm sàng (NCCLS)). Tiêu chuẩn thử nghiệm độ nhạy bằng các đĩa kháng sinh. Xuất bản lần thứ 9. Tài liệu tiêu chuẩn của CLSI đã được duyệt số M2-A9, CLSI, Wayne, PA, Tháng 1/2006.
††† Viện tiêu chuẩn về các phòng xét nghiệm lâm sàng (CLSI) (Trước đây là Ủy ban quốc gia về các tiêu chuẩn phòng xét nghiệm lâm sàng (NCCLS)). Các phương pháp thử nghiệm độ nhạy với kháng sinh của các vi khuẩn yếm khí. Xuất bản lần thứ 6. Tài liệu tiêu chuẩn của CLSI số M11-A6, CLSI, Wayne, PA, Tháng 1/2004.
§ Viện tiêu chuẩn về các phòng xét nghiệm lâm sàng (CLSI) (Trước đây là Ủy ban quốc gia về các tiêu chuẩn phòng xét nghiệm lâm sàng (NCCLS)). Tiêu chuẩn thử nghiệm độ nhạy của vi khuẩn kỵ khí bằng các đĩa kháng sinh. Tài liệu tiêu chuẩn của CLSI số M100-S16, CLSI, Wayne, PA, Tháng 1/2006.
Phân loại ATC
J01DH03
Trình bày/Đóng gói
Bột đông khô vô khuẩn: hộp 1 lọ.
- Abacavir
- Abernil
- Abiiogran
- Acarbose
- ACC
- Acebutolol
- Acenocoumarol
- Acetate Ringer's
- Acetazolamide
- Acetylcystein
- Acetylsalicylic acid
- Aciclovir
- Acid acetylsalicylic
- Acid aminocaproic
- Acid ascorbic
- Acid boric
- Acid chenodeoxycholic
- Acid ethacrynic
- Acid folic
- Acid fusidic
- Acid iopanoic
- Acid ioxaglic
- Acid nalidixic
- Acid pantothenic
- Acid para-aminobenzoic
- Acid salicylic
- Acid tranexamic
- Acid valproic
- Acid zoledronic
- Acitretin
- Aclasta
- Aclon
- Actapulgite
- Actelsar
- Actelsar HCT
- Actemra
- Actilyse
- Acular
- Acupan
- Acuvail
- Acyclovir STADA
- Acyclovir STADA Cream
- Adalat
- Adenosin
- Adenosin Ebewe
- Adipiodon
- Advagraf
- Aerius
- Afinitor
- Agicarvir
- Agifovir-E
- Agilosart
- Agilosart-H
- Agimepzol
- Agimosarid
- Agimstan
- Agimstan-H
- Agiremid
- Agivastar
- Aibezym
- Air-X
- Alaxan
- Albendazol
- Albiomin
- Albumin
- Albumin người Grifols 20%
- Albuminar
- AlbuRx
- Albutein
- Alcuronium chloride
- Aldesleukin
- Alendronat
- Alertin
- Alfa-Lipogamma 600 Oral
- Alfuzosin hydrochlorid
- Algotra
- Alimemazin
- Alimta
- Allipem
- Allopurinol
- Allopurinol STADA
- Aloxi
- Alprazolam
- Alpha Chymotrypsin
- Alpha tocopherol
- Alphachymotrypsin Glomed
- Alphagan-P
- Aluvia
- Alzental
- Amaryl
- Ambroco
- Ambroxol
- Amcinol-Paste
- Amigold
- Amikacin
- Aminocaproic acid
- Aminoleban
- Aminoleban Oral
- Aminosteril N-Hepa
- Amiparen
- Amitriptyline
- Amiyu
- Amlodipine
- Amlor
- Amoxicillin
- Amoxicillin & clavulanate
- Ampicillin
- Amquitaz
- Anaferon for children
- Anargil
- Anaropin
- Andriol Testocaps
- Anepzil
- Anyfen
- Apaisac
- Apidra SoloStar
- Apitim 5
- Aprovel
- Aquaphil
- Arcalion
- Arcoxia
- Aricept Evess
- Arimidex
- Arnetine
- Artrodar
- A-Scabs
- Ascorbic acid
- Asperlican/Candinazol
- Aspilets EC
- Aspirin
- Asthmatin
- Atelec
- Atocib 120
- Atocib 90
- Atosiban PharmIdea
- Atozet
- Attapulgite
- Atussin
- Atropin
- Augbactam
- Augmentin Sachet
- Augmentin SR
- Augmentin Tablets
- Augmex
- Avamys
- Avastin
- Avelox Dịch truyền
- Avelox Viên nén
- Avodart
- Axcel Cefaclor-125 Suspension
- Axcel Cetirizine Syrup
- Axcel Chlorpheniramine
- Axcel Dexchlorpheniramine
- Axcel Dicyclomine-S Syrup
- Axcel Diphenhydramine Paediatric Syrup
- Axcel Erythromycin ES
- Axcel Eviline
- Axcel Fungicort Cream
- Axcel Fusidic acid Cream
- Axcel Fusidic acid-B Cream
- Axcel Hydrocortisone Cream
- Axcel Lignocaine 2% Sterile Gel
- Axcel Loratadine
- Axcel Miconazole Cream
- Axcel Paracetamol
- Axcel Urea Cream
- Axitan
- Azenmarol
- Azicine
- Aziphar
- Azithromycin





