Nhà sản xuất
Ebewe Pharma
Nhà phân phối
Zuellig Pharma
Nhà tiếp thị
Sandoz
Thành phần
Mỗi mL: Docetaxel 10mg.
Dược lực học
Nhóm tác dụng dược lý: Taxan, mã ATC: L01CD02.
Cơ chế tác dụng
Docetaxel là một thuốc chống tân sinh có tác dụng thúc đẩy sự trùng hợp tubulin để tạo thành các vi ống bền vững và ức chế sự phân rã của chúng điều này dẫn đến làm giảm đáng kể các tubulin tự do. Việc gắn docetaxel vào cấu trúc vi ống không làm thay đổi số lượng tiền tơ.
In vitro, docetaxel cho thấy có tác dụng phá vỡ mạng lưới vi ống của tế bào vốn là cấu trúc cần thiết cho chức năng tế bào sống trong kỳ trung gian và kỳ phân bào.
Tác dụng dược lực
In vitro, docetaxel cho thấy tác dụng gây độc tế bào chống lại một số dòng tế bào khối u trên người và chuột, và chống lại các tế bào khối u người vừa được ly trích trong các nghiên cứu trên tế bào sống và tăng sinh. Docetaxel đạt nồng độ cao trong tế bào với thời gian lưu lại trong tế bào kéo dài. Hơn nữa, docetaxel cho thấy có hoạt tính trên một số - nhưng không phải là tất cả - các dòng tế bào có biểu hiện quá mức p-glycoprotein là protein được mã hóa bởi gen kháng đa thuốc.
In vivo, docetaxel tác động độc lập và có hoạt tính chống ung phổ rộng trong thực nghiệm trên khối u tiến triển được ghép trên người và chuột.
Tính an toàn và hiệu quả trên lâm sàng
Ung thư vú
Docetaxel phối hợp với doxorubicin và cyclophosphamid: liệu pháp bổ trợ
* Bệnh nhân bị ung thư vú có hạch dương tính, có thể phẫu thuật được (TAX 316)
Dữ liệu từ một thử nghiệm ngẫu nhiên, nhãn mở, đa trung tâm hỗ trợ cho việc sử dụng docetaxel trong điều trị bổ trợ cho bệnh nhân ung thư vú có hạch dương tính, có thể phẫu thuật được và chỉ số tổng trạng Karnofsky (KPS) ≥ 80%, độ tuổi từ 18 đến 70. Sau khi phân tầng theo số lượng hạch bạch huyết dương tính (1-3, 4+), Có 1.491 bệnh nhân được chọn ngẫu nhiên để điều trị bằng docetaxel 75 mg/m2 dùng thuốc trong 1 giờ sau khi dùng doxorubicin 50 mg/m2 và cyclophosphamid 500 mg/m2 (nhóm TAC), hoặc doxorubicin 50 mg/m2 theo sau là fluorouracil 500 mg/m2 và cyclophosphamid 500 mg/m2 (nhóm FAC). Cả 2 phác đồ đều được sử dụng mỗi 3 tuần trong 6 chu kỳ điều trị. Docetaxel được sử dụng qua tiêm truyền trong 1 giờ, tất cả các thuốc khác được tiêm tĩnh mạch liếu nạp vào ngày thứ nhất. G-CSF được sử dụng để dự phòng thứ phát trên bệnh nhân có tiền sử giảm bạch cầu trung tính có biến chứng (giảm bạch cầu trung tính có sốt, giảm bạch cầu trung tính kéo dài, hoặc nhiễm khuẩn). Bệnh nhân trong nhóm TAC được sử dụng kháng sinh dự phòng là ciprofloxacin 500 mg đường uống 2 lần/ngày trong 10 ngày bắt đầu từ ngày thứ 5 của mỗi chu kỳ điều trị, hoặc tương đương. Trong cả 2 nhóm điều trị, sau chu kỳ hóa trị cuối cùng, bệnh nhân có các thụ thể estrogen và/hoặc progesteron dương tính được điều trị bằng tamoxifen 20 mg mỗi ngày cho đến 5 năm. Xạ trị bổ trợ được áp dụng theo như hướng dẫn điều trị của bệnh viện tham gia nghiên cứu và đã thực hiện cho 69% bệnh nhân trong nhóm điều trị TAC và 72% bệnh nhân trong nhóm điều trị FAC. Hai phân tích tạm thời và một phân tích cuối cùng đã được thực hiện. Phân tích tạm thời thứ nhất đã được lên kế hoạch thực hiện vào thời điểm 3 năm sau ngày mà một nửa số bệnh nhân tham gia nghiên cứu được tuyển chọn. Phân tích tạm thời thứ hai đã được thực hiện sau khi có tổng cộng 400 trường hợp DFS được ghi nhận, điều này dẫn đến thời gian theo dõi trung vị là 55 tháng.
Phân tích cuối cùng được thực hiện khi tất cả các bệnh nhân đã đạt được thời gian theo dõi 10 năm (trừ khi họ đã có DFS hoặc bị mất liên lạc trước đó). Sống còn không bệnh (DFS) là mục tiêu hiệu quả chính và sống còn toàn bộ (OS) là mục tiêu hiệu quả phụ.
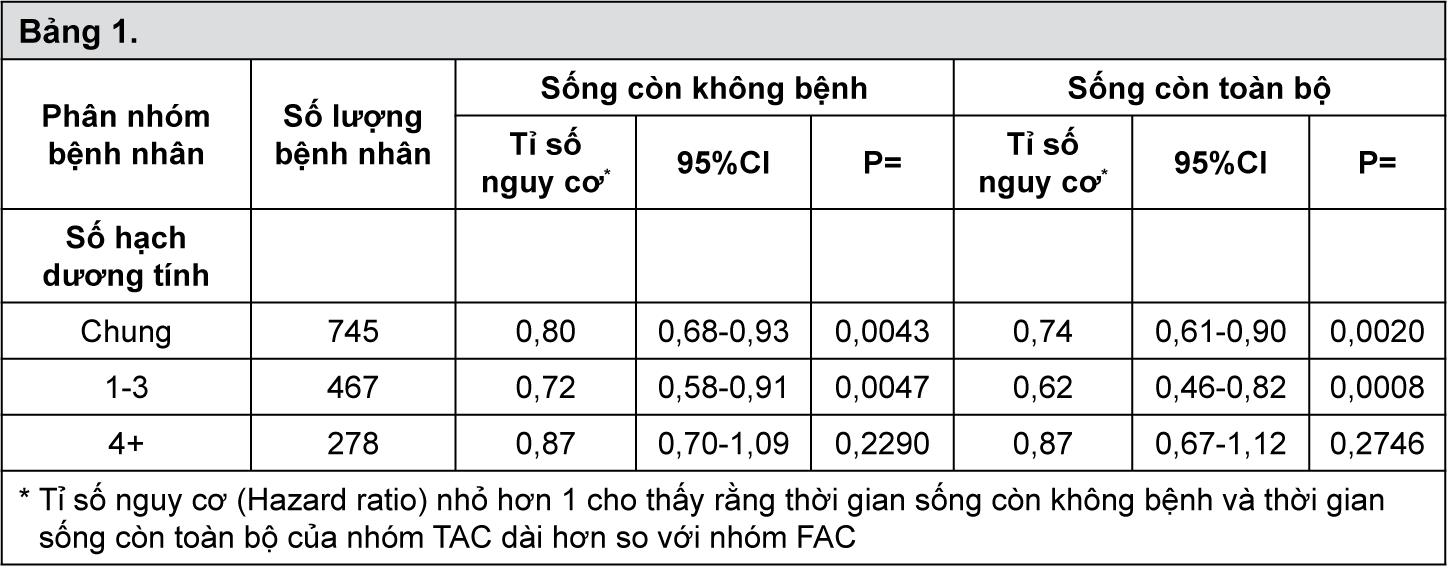
Phân tích cuối cùng đã được thực hiện với khoảng thời gian theo dõi trung vị thực tế là 96 tháng. Thời gian sống còn không bệnh của nhóm TAC dài hơn có ý nghĩa so với nhóm FAC đã được chứng minh. Tỷ lệ tái phát tại thời điểm 10 năm giảm trong nhóm TAC so với nhóm FAC (39% so với 45%, tương ứng), tức là nguy cơ tuyệt đối giảm 6% (p = 0,0043). Tỷ lệ sống còn toàn bộ tại thời điểm 10 năm cũng tăng đáng kể trong nhóm TAC so với nhóm FAC (76% so với 69 %, tương ứng), tức là độ giảm tuyệt đối của nguy cơ tử vong là 7% (p = 0,002). Do lợi ích đã được ghi nhận trên những bệnh nhân có hạch 4+ không có ý nghĩa thống kê trên DFS và OS, tỷ số lợi ích/nguy cơ ủng hộ cho việc sử dụng phác đồ TAC trên bệnh nhân có hạch 4+ chưa được chứng minh đầy đủ trong phân tích cuối cùng.
Nhìn chung, kết quả nghiên cứu chứng minh tỷ số lợi ích/nguy cơ của TAC vượt trội so với FAC.
Phân nhóm bệnh nhân điều trị bằng TAC theo các yếu tố tiên lượng chính được xác định trước đã được phân tích:
- xem Bảng 1.
Bệnh nhân bị ung thư vú hạch âm tính có thể phẫu thuật được được dùng hóa trị (GEICAM 9805)
Dữ liệu từ một thử nghiệm ngẫu nhiên, nhãn mở, đa trung tâm hỗ trợ cho việc sử dụng docetaxel để điều trị bổ trợ cho những bệnh nhân bị ung thư vú hạch âm tính có thể phẫu thuật được được dùng hóa trị. Có 1.060 bệnh nhân được phân ngẫu nhiên để dùng docetaxel 75 mg/m2 được dùng trong 1 giờ sau khi dùng doxorubicin 50 mg/m2 và cyclophosphamid 500 mg/m2 (539 bệnh nhân trong nhóm TAC), hoặc doxorubicin 50 mg/m2 tiếp theo là dùng flourouracil 500 mg/m2 và cyclophosphamid 500 mg/m2 (521 bệnh nhân trong nhóm FAC), để điều trị bổ trợ ung thư vú hạch âm tính có thể phẫu thuật được với nguy cơ tái phát cao theo tiêu chuẩn St. Gallen 1998 (kích thước khối u > 2 cm và/hoặc ER và PR âm tính và/hoặc mức độ biệt hóa nhân/mô học cao (độ 2 đến 3) và/hoặc tuổi dưới 35). Cả hai phác đồ được dùng mỗi 3 tuần trong 6 chu kỳ. Docetaxel được tiêm truyền trong 1 giờ, tất cả các thuốc còn lại được dùng đường tĩnh mạch vào ngày đầu của chu kỳ mỗi ba tuần. Dự phòng nguyên phát bằng G-CSF được thực hiện bắt buộc với nhóm TAC sau khi 230 bệnh nhân được phân nhóm ngẫu nhiên. Tỷ lệ giảm bạch cầu trung tính độ 4, giảm bạch cầu có sốt và nhiễm trùng do giảm bạch cầu giảm trên những bệnh nhân được dự phòng nguyên phát bằng G-CSF (xem mục Tác dụng ngoại ý). Trên cả hai nhóm, sau khi kết thúc đợt hóa trị cuối cùng, những bệnh nhân bị ung thư có ER+ và/hoặc PgR+ được dùng tamoxifen 20 mg một lần/ngày trong 5 năm. Phác đồ xạ trị hỗ trợ được sử dụng theo hướng dẫn tại cơ sở tham gia nghiên cứu và đã được sử dụng cho 57,3% số bệnh nhân được điều trị bằng TAC và 51,2% số bệnh nhân được điều trị bằng FAC.
Một phân tích sơ bộ và một phân tích cập nhật đã được tiến hành. Phân tích sơ bộ được tiến hành khi tất cả bệnh nhân có thời gian theo dõi trên 5 năm (thời gian theo dõi trung vị 77 tháng). Phân tích cập nhật được tiến hành khi tất cả bệnh nhân đạt thời gian theo dõi 10 năm (thời gian theo dõi trung vị 10 năm và 5 tháng) (trừ khi bệnh nhân đã có DFS hoặc bị mất liên lạc trước đó). Sống còn không bệnh (DFS) là mục tiêu hiệu quả chính và sống còn toàn bộ (OS) là mục tiêu hiệu quả phụ.
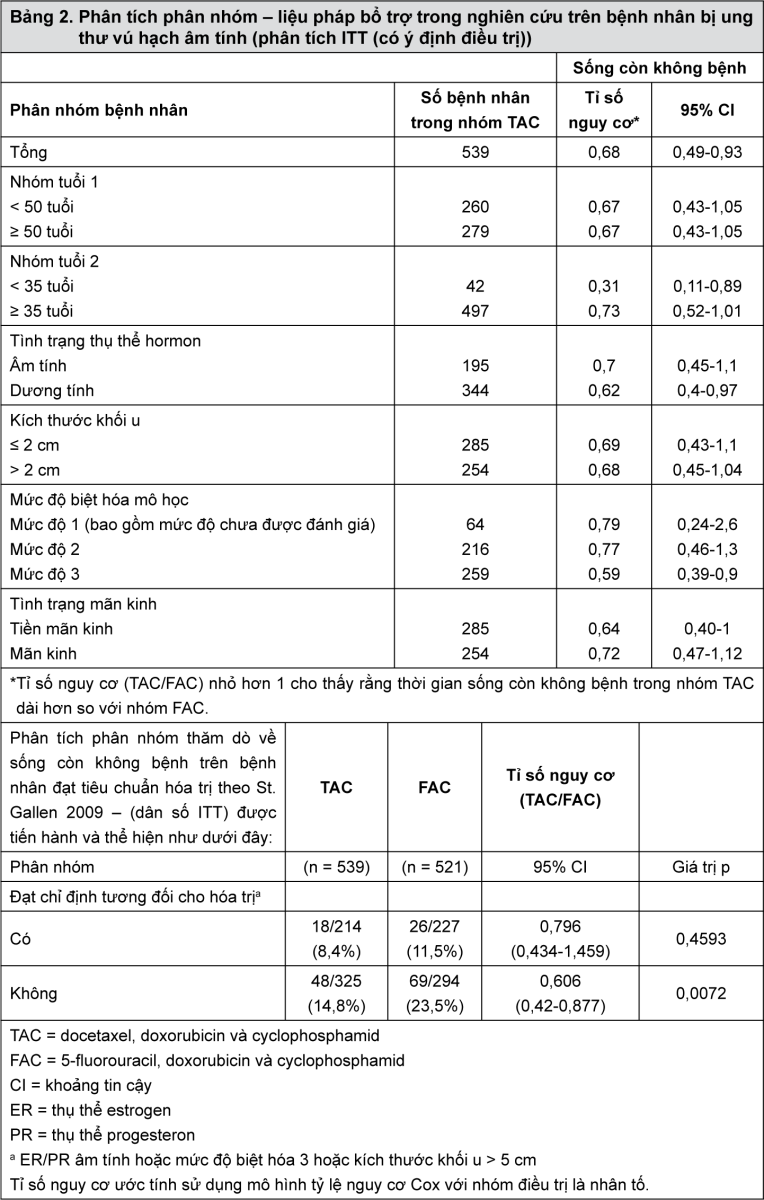
Trong khoảng thời gian theo dõi trung vị 77 tháng, thời gian sống còn không bệnh dài hơn có ý nghĩa trong nhóm TAC so với nhóm FAC đã được chứng minh. Những bệnh nhân được điều trị bằng TAC đã giảm nguy cơ tái phát 32% so với nhóm FAC (tỷ số nguy cơ = 0,68, 95% CI (0,49-0,93), p = 0,01). Trong khoảng thời gian theo dõi trung vị 10 năm và 5 tháng, những bệnh nhân được điều trị bằng TAC đã giảm nguy cơ tái phát 16,5% so với nhóm FAC (tỉ số nguy cơ = 0,84, 95% CI (0,65-1,08), p=0,1646). Dữ liệu DFS không có ý nghĩa thống kê nhưng vẫn có khuynh hướng ưu thế trong nhóm TAC.
Trong khoảng thời gian theo dõi trung vị 77 tháng, thời gian sống còn toàn bộ (OS) dài hơn trong nhóm TAC, các bệnh nhân được điều trị bằng TAC giảm nguy cơ tử vong 24% so với nhóm FAC (tỷ số nguy cơ = 0,76, 95% CI (0,46-1,26, p=0,29). Tuy nhiên, sự phân bố của thời gian sống còn toàn bộ không có sự khác biệt có ý nghĩa giữa 2 nhóm.
Trong khoảng thời gian theo dõi trung vị 10 năm và 5 tháng, những bệnh nhân được điều trị bằng TAC đã giảm nguy cơ tử vong 9% so với nhóm FAC (tỉ số nguy cơ = 0,91, 95% CI (0,63-1,32)).
Tỉ lệ sống còn là 93,7% trong nhóm TAC và 91,4% trong nhóm FAC tại thời điểm theo dõi 8 năm, và 91,3% trong nhóm TAC và 89% trong nhóm FAC tại thời điểm 10 năm.
Tỉ số lợi ích nguy cơ ủng hộ cho nhóm TAC so với nhóm FAC vẫn không đổi.
Phân nhóm bệnh nhân được điều trị bằng TAC theo các yếu tố tiên lượng chính được xác định trước đã được phân tích trong phân tích sơ bộ (thời gian theo dõi trung vị 77 tháng)
- xem Bảng 2.
DOCETAXEL đơn trị
Hai nghiên cứu so sánh, pha III, ngẫu nhiên, bao gồm tổng số 326 bệnh nhân bị ung thư vú di căn điều trị thất bại với các tác nhân alkyl hóa và 392 bệnh nhân thất bại với anthracyclin, tiến hành với docetaxel tại mức liều khuyến cáo và phác đồ 100 mg/m2 mỗi 3 tuần.
Đối với bệnh nhân thất bại với tác nhân alkyl hóa, docetaxel được so sánh với doxorubicin (75 mg/m2 mỗi 3 tuần). Không ảnh hưởng đến thời gian sống còn toàn bộ (docetaxel 15 tháng so với doxorubicin 14 tháng, p=0,38) hoặc thời gian đến khi bệnh tiến triển (docetaxel 27 tuần so với doxorubicin 23 tuần p=0,54), docetaxel làm tăng tỉ lệ đáp ứng (52% so với 37%, p=0,01) và rút ngắn thời gian đến khi có đáp ứng (12 tuần so với 23 tuần, p=0,007). Có 3 bệnh nhân điều trị docetaxel (2%) bị ngừng điều trị do ứ dịch, trong khi 15 bệnh nhân điều trị doxorubicin (9%) ngừng điều trị do độc tính trên tim (trong đó 3 trường hợp bị suy tim xung huyết dẫn đến tử vong).
Đối với các bệnh nhân thất bại điều trị với anthracyclin, docetaxel được so sánh với mitomycin C phối hợp với vinblastin (12 mg/m2 mỗi 6 tuần và 6 mg/m2 mỗi 3 tuần). Docetaxel làm tăng tỉ lệ đáp ứng (33% so với 12%, p<0,0001), kéo dài thời gian đến khi bệnh tiến triển (19 tuần so với 11 tuần, p=0,0004) và kéo dài thời gian sống còn toàn bộ (11 tháng so với 9 tháng, p=0,01).
Trong 2 nghiên cứu pha III này, đặc tính an toàn của docetaxel phù hợp với đặc tính an toàn quan sát được trong nghiên cứu pha II (xem mục Tác dụng ngoại ý).
Một nghiên cứu pha III, ngẫu nhiên, đa trung tâm, nhãn mở đã được tiến hành để so sánh docetaxel đơn trị và paclitaxel trong điều trị ung thư vú tiến triển trên bệnh nhân đã được điều trị từ trước với anthracyclin. Tổng số 449 bệnh nhân được chọn ngẫu nhiên để điều trị hoặc docetaxel đơn trị 100 mg/m2 tiêm truyền trong 1 giờ hoặc paclitaxel 175 mg/m2 tiêm truyền trong 3 giờ. Cả 2 phác đồ được dùng mỗi 3 tuần.
Không ảnh hưởng đến mục tiêu nghiên cứu chính, tỉ lệ đáp ứng toàn bộ (32% so với 25%, p=0,10), docetaxel kéo dài trung vị thời gian đến khi bệnh tiến triển (24,6 tuần so với 15,6 tuần; p<0,01) và thời gian sống còn trung vị (15,3 tháng so với 12,7 tháng; p=0,03).
Các biến cố bất lợi mức độ 3/4 được nhận thấy trong nhóm đơn trị docetaxel (55,4%) so với nhóm paclitaxel (23,0%).
DOCETAXEL phối hợp với doxorubicin
Một nghiên cứu pha III, ngẫu nhiên, qui mô lớn bao gồm 429 bệnh nhân bị ung thư vú di căn chưa được điều trị trước đó, đã được tiến hành với doxorubicin (50 mg/m2) phối hợp với docetaxel (75 mg/m2) (nhóm AT) so với doxorubicin (60 mg/m2) phối hợp với cyclophosphamid (600 mg/m2 (nhóm AC). Cả 2 phác đồ được dùng vào ngày đầu tiên của chu kỳ mỗi 3 tuần.
Thời gian đến khi bệnh tiến triển (TTP) gia tăng có ý nghĩa trong nhóm AT so với nhóm AC, p=0,0138. TTP trung vị của nhóm AT là 37,3 tuần (95%CI: 33,4-42,l) và 31,9 tuần (95% CI: 27,4-36,0) trong nhóm AC.
Tỉ lệ đáp ứng toàn bộ (ORR) trong nhóm AT cao hơn có ý nghĩa so với nhóm AC, p=0,009. ORR trong nhóm AT là 59,3% (95% CI: 52,8-65,9) so với 46,5% trong nhóm AC (95% CI: 39,8-53,2).
Trong thử nghiệm này, nhóm AT có tỉ lệ mắc cao hơn về giảm bạch cầu trung tính nặng (90% so với 68,6%), giảm bạch cầu trung tính có sốt (33,3% so với 10%), nhiễm khuẩn (8% so với 2,4%), tiêu chảy (7,5% so với 1,4%), suy nhược (8,5% so với 2,4%) và đau (2,8% so với 0%) so với nhóm AC. Mặt khác, nhóm AC có tỉ lệ bị thiếu máu nặng cao hơn so với nhóm AT (15,8% so với 8,5%), hơn nữa tỉ lệ độc tính trên tim nặng cũng cao hơn như suy tim xung huyết (3,8% so với 2,8%), giảm LVEF tuyệt đối ≥ 20% (13,l% so với 6,1%), giảm LVEF tuyệt đối ≥ 30% (6,2% so với 1,1%). Tử vong do nhiễm độc xảy ra trên 1 bệnh nhân trong nhóm AT (suy tim xung huyết) và 4 bệnh nhân trong nhóm AC (1 người do sốc nhiễm khuẩn huyết và 3 người do suy tim xung huyết).
Trong cả 2 nhóm, chất lượng cuộc sống xác định bằng bản câu hỏi EORTC là tương tự nhau và ổn định trong suốt thời gian điều trị và theo dõi.
DOCETAXEL phối hợp với trastuzumab
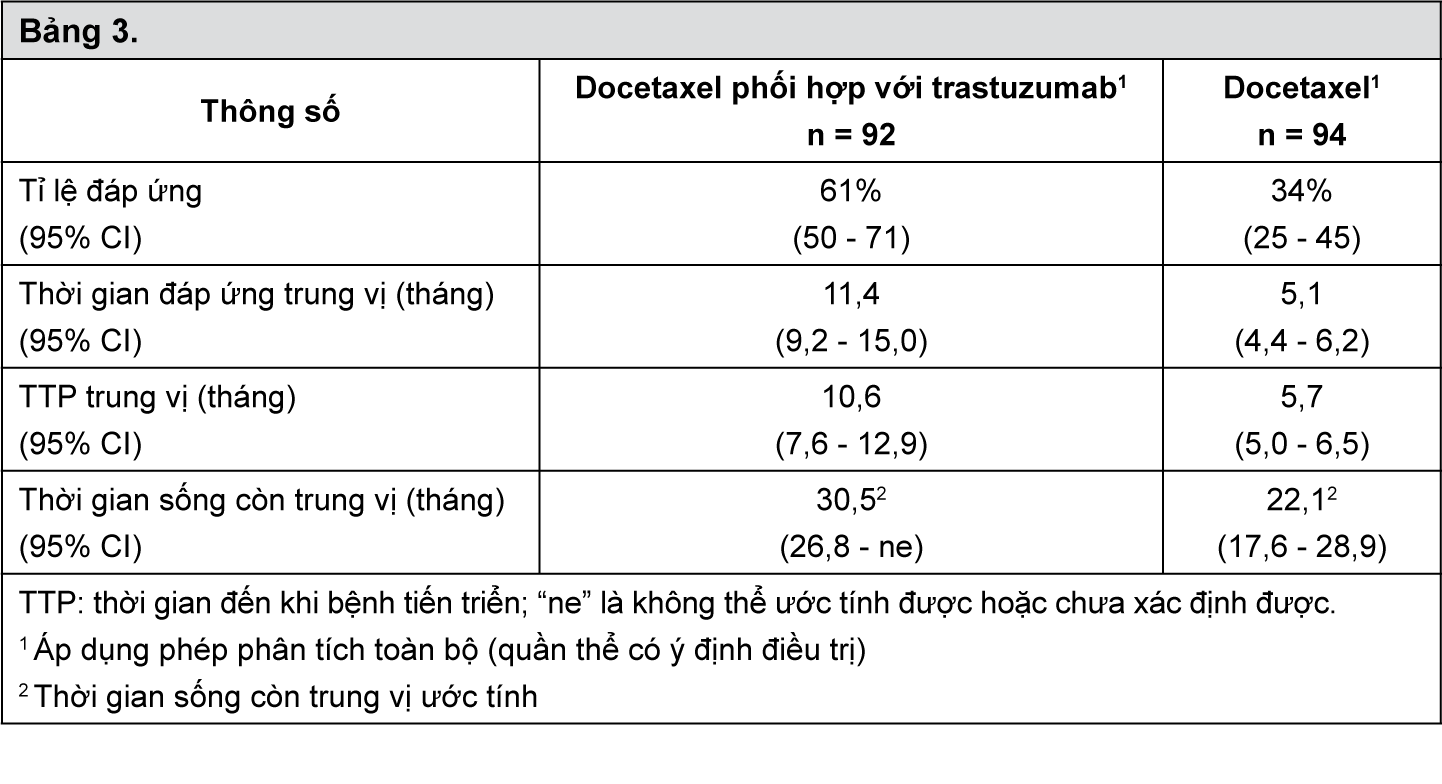
Docetaxel trong phối hợp với trastuzumab được nghiên cứu để điều trị cho bệnh nhân bị ung thư vú di căn với khối u có biểu hiện quá mức HER2, và trên bệnh nhân trước đó không dùng hóa trị cho ung thư di căn. Có 186 bệnh nhân được chọn ngẫu nhiên để điều trị bằng docetaxel (100 mg/m2) kèm hoặc không kèm với trastuzumab; 60% bệnh nhân đã dùng hóa trị bổ trợ chứa anthracyclin trước đó. Docetaxel phối hợp với trastuzumab có hiệu quả trên bệnh nhân có hay không dùng anthracyclin bổ trợ trước đó. Phương pháp xét nghiệm chính được dùng để xác định HER2 dương tính trong thử nghiệm đăng ký thuốc này là hóa mô miễn dịch (IHC: immunohistochemistry). Một số ít bệnh nhân được kiểm tra bằng kĩ thuật lai tại chỗ phát huỳnh quang (FISH: fluorescence in-situ hybridization). Trong thử nghiệm này, 87% bệnh nhân mắc bệnh có IHC 3+, và 95% bệnh nhân tham gia mắc bệnh có IHC 3+ và/hoặc FISH dương tính. Các kết quả về hiệu quả được tóm tắt trong bảng 3.
- xem Bảng 3.
DOCETAXEL phối hợp với capecitabin
Các dữ liệu từ một thử nghiệm lâm sàng pha III có đối chứng, ngẫu nhiên và đa trung tâm đã hỗ trợ cho việc sử dụng docetaxel phối hợp với capecitabin trong điều trị cho bệnh nhân bị ung thư vú di căn hoặc tiến triển tại chỗ sau khi thất bại với hóa trị độc tế bào, bao gồm một anthracyclin. Trong thử nghiệm này, 255 bệnh nhân được chọn ngẫu nhiên để điều trị bằng docetaxel (75 mg/m2 tiêm truyền tĩnh mạch trong 1 giờ, mỗi 3 tuần) và capecitabin 1.250 mg/m2 2 lần/ngày trong 2 tuần sau đó nghỉ 1 tuần). Có 256 bệnh nhân được chọn ngẫu nhiên dùng docetaxel đơn trị (100 mg/m2 tiêm truyền tĩnh mạch trong 1 giờ, mỗi 3 tuần). Thời gian sống còn cao hơn trong nhóm điều trị bằng docetaxel phối hợp capecitabin (p=0,0126). Thời gian sống còn trung vị là 442 ngày (docetaxel + capecitabin) so với 352 ngày (docetaxel đơn trị). Tỉ lệ đáp ứng toàn bộ của khối u trên tất cả các đối tượng được chọn ngẫu nhiên (đánh giá của nghiên cứu viên) là 41,6% (docetaxel + capecitabin) so với 29,7% (docetaxel đơn trị); p=0,0058. Thời gian đến khi bệnh tiến triển cao hơn hơn trong nhóm phối hợp docetaxel và capecitabin (p<0,0001). Trung vị thời gian đến khi bệnh tiến triển là 186 ngày (docetaxel + capecitabin) so với 128 ngày (docetaxel đơn trị).
Ung thư phổi không tế bào nhỏ
Bệnh nhân đã được hóa trị trước, có kèm hoặc không kèm xạ trị
Trong một nghiên cứu pha III, trên bệnh nhân đã được điều trị trước đó, thời gian đến khi bệnh tiến triển (12,3 tuần so với 7 tuần) và thời gian sống còn toàn bộ kéo dài đáng kể khi điều trị docetaxel 75 mg/m2 so với Chăm sóc tích cực (Best Supportive Care - BSC). Tỉ lệ sống còn 1 năm cũng cao hơn đáng kể trong nhóm docetaxel (40%) so với nhóm BSC (16%).
Tỉ lệ sử dụng thuốc giảm đau morphin (p<0,01), thuốc giảm đau không phải morphin (p<0,01), các thuốc khác liên quan đến bệnh (p=0,06), và xạ trị (p<0,01) thấp hơn trong nhóm bệnh nhân điều trị bằng docetaxel 75 mg/m2 so với nhóm BSC.
Tỉ lệ đáp ứng toàn bộ là 6,8% trên các bệnh nhân có thể đánh giá được, và khoảng thời gian đáp ứng trung vị là 26,1 tuần.
DOCETAXEL phối hợp với các thuốc platin trên các bệnh nhân chưa dùng hóa trị
Trong một nghiên cứu pha III, có 1.218 bệnh nhân bị ung thư phổi không tế bào nhỏ ở giai đoạn IIIB hoặc IV không thể cắt bỏ được, với KPS 70% hoặc hơn, và những bệnh nhân không dùng hóa trị trước đó cho bệnh trạng này, được chọn ngẫu nhiên để điều trị hoặc docetaxel (T) 75 mg/m2 tiêm truyền trong 1 giờ, tiếp theo tiêm truyền ngay cisplatin (Cis) 75 mg/m2 trong 30-60 phút, mỗi 3 tuần; hoặc docetaxel 75 mg/m2 tiêm truyền trong 1 giờ phối hợp với carboplatin (AUC 6 mg/mL.phút) tiêm truyền trong 30-60 phút, mỗi 3 tuần; hoặc vinorelbin (V) 25 mg/m2 tiêm truyền trong 6-10 phút vào các ngày 1, 8, 15, 22 tiếp theo là tiêm truyền cisplatin 100 mg/m2 được dùng vào ngày 1 của các chu kỳ được lặp lại mỗi 4 tuần.
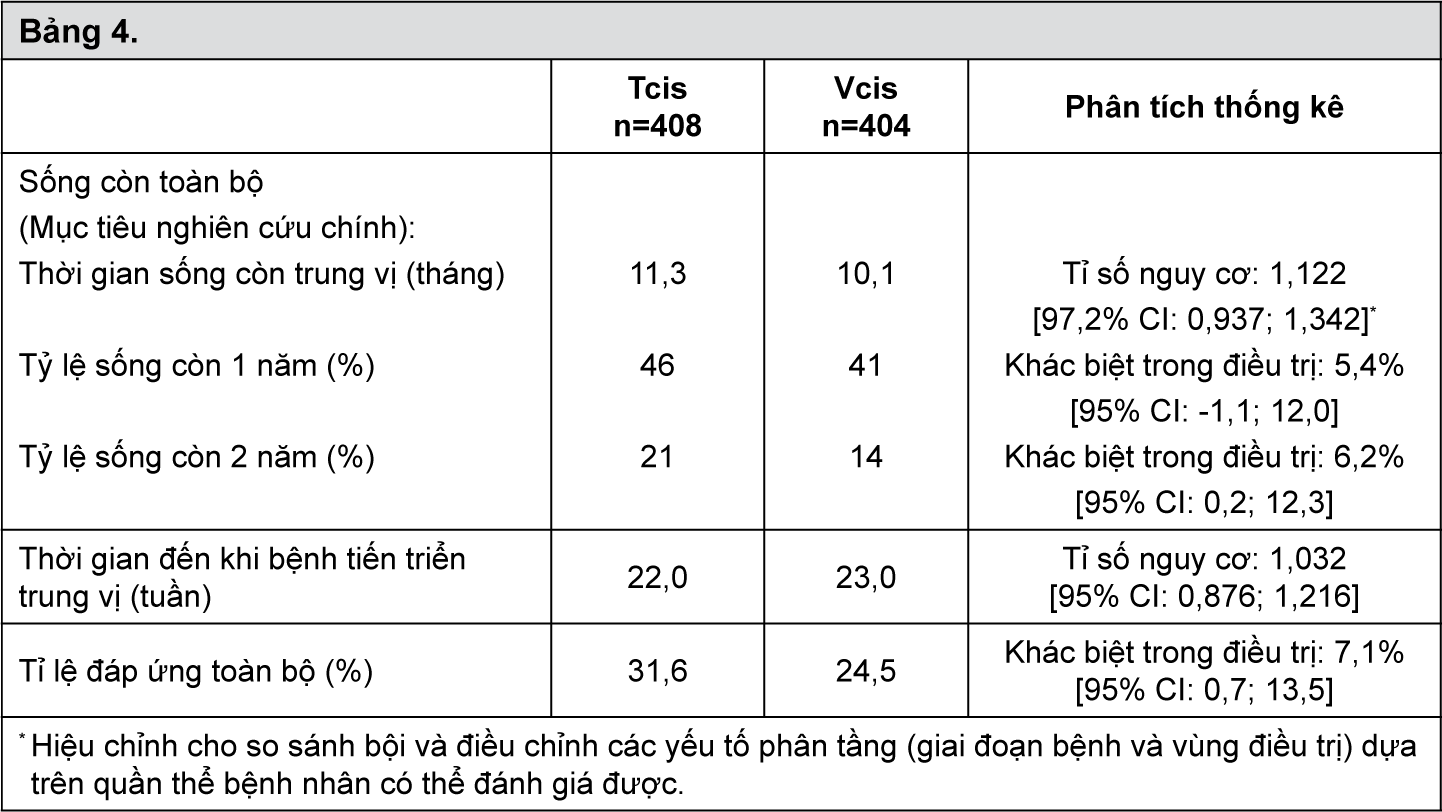
Các dữ liệu về thời gian sống còn, thời gian đến khi bệnh tiến triển trung vị và tỉ lệ đáp ứng của 2 nhóm trong nghiên cứu này được thể hiện trong bảng 4.
- xem Bảng 4.
Các mục tiêu nghiên cứu phụ bao gồm sự thay đổi của đau, đánh giá chất lượng sống toàn bộ bằng EuroQoL-5D, Thang điểm Triệu chứng của Ung thư Phổi, và những thay đổi về chỉ số tổng trạng Karnosfky (KPS). Các kết quả trên những mục tiêu nghiên cứu phụ này được hỗ trợ của kết quả mục tiêu nghiên cứu chính.
Trong phối hợp docetaxel/carboplatin, không chứng minh được có hiệu quả tương đương hay thấp hơn khi so sánh với điều trị phối hợp VCis.
Ung thư tuyến tiền liệt
Hiệu quả và tính an toàn của docetaxel khi phối hợp với prednison hoặc prednisolon trên bệnh nhân bị ung thư tuyến tiền liệt di căn kháng hormon được đánh giá trong một thử nghiệm pha III, ngẫu nhiên, đa trung tâm. Tổng số 1.006 bệnh nhân có KPS ≥ 60% được chọn ngẫu nhiên vào các nhóm điều trị sau đây:
• Docetaxel 75 mg/m2 mỗi 3 tuần trong 10 chu kỳ điều trị.
• Docetaxel 30 mg/m2 dùng mỗi tuần trong 5 tuần đầu tiên của chu kỳ 6 tuần, trong 5 chu kỳ điều trị.
• Mitoxantron 12 mg/m2 mỗi 3 tuần, trong 10 chu kỳ điều trị.
Cả 3 phác đồ điều trị này được dùng phối hợp với prednison hoặc prednisolon 5 mg 2 lần 1 ngày, dùng liên tục.
Bệnh nhân được điều trị docetaxel mỗi 3 tuần đã chứng minh được thời gian sống còn toàn bộ gia tăng đáng kể so với bệnh nhân được điều trị bằng mitoxantron. Gia tăng thời gian sống còn được ghi nhận trong nhóm docetaxel dùng mỗi tuần không khác biệt có ý nghĩa thống kê so với nhóm chứng điều trị bằng mitoxantron. Mục tiêu về hiệu quả của nhóm điều trị docetaxel so với nhóm chứng được tóm tắt trong bảng 5.
- xem Bảng 5.
Thực tế cho thấy docetaxel điều trị mỗi tuần có tính an toàn cao hơn đôi chút so với docetaxel điều trị mỗi 3 tuần, một số bệnh nhân nhất định có thể có lợi ích từ việc điều trị docetaxel mỗi tuần.
Không có sự khác biệt có ý nghĩa thống kê quan sát được giữa các nhóm điều trị cho chỉ số Chất lượng Sống Toàn bộ (Global Quality of Life).
Ung thư dạ dày
Một thử nghiệm ngẫu nhiên, nhãn mở, đa trung tâm được tiến hành để đánh giá tính an toàn và hiệu quả của docetaxel trong điều trị cho bệnh nhân bị ung thư dạ dày di căn, kể cả ung thư biểu mô tuyến đoạn nối dạ dày-thực quản, bệnh nhân chưa dùng hóa trị trước đó cho bệnh di căn. Tổng số 445 bệnh nhân có KPS > 70% được điều trị hoặc bằng docetaxel (T) (75 mg/m2 vào ngày 1) phối hợp với cisplatin (C) (75 mg/m2 vào ngày 1) và 5-fluorouracil (F) (750 mg/m2 mỗi ngày trong 5 ngày), hoặc cisplatin (100 mg/m2 vào ngày 1) và 5-fluorouracil (1.000 mg/m2 mỗi ngày trong 5 ngày). Thời gian mỗi chu kỳ điều trị là 3 tuần cho nhóm TCF và 4 tuần cho nhóm CF. Số chu kỳ điều trị trung vị cho mỗi bệnh nhân là 6 (dao động 1-16) trong nhóm TCF so với 4 (dao động 1 - 12) trong nhóm CF. Thời gian đến khi bệnh tiến triển (TTP) là mục tiêu nghiên cứu chính. Tỉ lệ giảm nguy cơ tiến triển của bệnh là 32,1% và có liên quan với TTP gia tăng đáng kể (p=0,0004) thiên về nhóm TCF. Thời gian sống còn toàn bộ cũng gia tăng đáng kể trong nhóm TCF (p=0,0201) với tỉ lệ giảm nguy cơ tử vong là 22,7%. Kết quả về hiệu quả được tóm tắt trong bảng 6.
- xem Bảng 6.

Các phân tích phân nhóm theo tuổi, giới tính và chủng tộc ưu thế nhất quán cho nhóm TCF so với nhóm CF.
Một phân tích cập nhật về thời gian sống còn được tiến hành với khoảng thời gian theo dõi trung vị 41,6 tháng đã không cho thấy sự khác biệt có ý nghĩa thống kê mặc dù kết quả luôn ưu thế trong nhóm TCF và cho thấy lợi ích của nhóm TCF cao hơn rõ rệt so với nhóm CF trong khoảng thời gian theo dõi 18 đến 30 tháng.
Nhìn chung, chất lượng sống (QoL) và các kết quả lợi ích trên lâm sàng cho thấy ưu thế cải thiện của nhóm TCF một cách nhất quán. Bệnh nhân được điều trị trong nhóm TCF có thời gian để giảm 5% tình trạng sức khỏe toàn bộ dựa trên bảng câu hỏi QLQ-C30 gia tăng (p=0,0121) và thời gian để chỉ số tổng trạng Karnofsky xấu đi rõ rệt cũng gia tăng (p=0,0088) so với các bệnh nhân điều trị trong nhóm CF.
Ung thư vùng đầu-cổ
Hóa trị gây đáp ứng tiếp theo là xạ trị (TAX323)
Tính an toàn và hiệu quả của docetaxel trong điều trị gây đáp ứng cho bệnh nhân bị ung thư biểu mô tế bào vảy vùng đầu-cổ (SCCHN) được đánh giá trong một thử nghiệm pha III, ngẫu nhiên, nhãn mở, đa trung tâm (TAX323). Trong nghiên cứu này, 358 bệnh nhân bị ung thư biểu mô tế bào vảy vùng đầu-cổ tiến triển tại chỗ không thể phẫu thuật được và chỉ số tổng trạng WHO là 0 hoặc 1, được chọn ngẫu nhiên vào 1 trong 2 nhóm điều trị. Bệnh nhân trong nhóm docetaxel được điều trị docetaxel (T) 75 mg/m2 tiếp theo là cisplatin (P) 75 mg/m2 kế tiếp là 5 -fluorouracil (F) 750 mg/m2 mỗi ngày tiêm truyền liên tục trong 5 ngày. Phác đồ này được dùng mỗi 3 tuần, trong 4 chu kỳ điều trị nếu có ít nhất 1 đáp ứng tối thiểu (giảm ≥ 25% kích thước khối u được đo 2 chiều) được đánh giá sau 2 chu kỳ điều trị. Cuối đợt hóa trị, với khoảng thời gian tối thiểu 4 tuần và tối đa 7 tuần, bệnh nhân không tiến triển bệnh được điều trị tiếp bằng xạ trị (RT) theo hướng dẫn điều trị của cơ sở trong 7 tuần (TPF/RT). Bệnh nhân trong nhóm đối chứng được điều trị cisplatin (P) 100 mg/m2 tiếp theo là 5-flourouracil (F) 1.000 mg/m2 mỗi ngày trong 5 ngày. Phác đồ này được sử dụng mỗi 3 tuần, trong 4 chu kỳ điều trị nếu như có ít nhất 1 đáp ứng tối thiểu (giảm ≥ 25% kích thước khối u được đo 2 chiều) được đánh giá sau 2 chu kỳ điều trị. Cuối đợt hóa trị, với khoảng thời gian tối thiểu 4 tuần và tối đa 7 tuần, bệnh nhân không tiến triển bệnh được điều trị tiếp bằng xạ trị (RT) theo hướng dẫn điều trị của cơ sở trong 7 tuần (PF/RT). Điều trị tại chỗ tại vùng bằng xạ trị tiến hành theo phân liều thông thường (1,8 Gy - 2,0 Gy 1 lần/ngày, 5 ngày/tuần với tổng liều 66 đến 70 Gy), hoặc các phác đồ xạ trị gia tốc/liều cao (2 lần/ngày, khoảng cách tối thiểu giữa các phân liều là 6 giờ, 5 ngày/tuần). Tổng liều 70 Gy được khuyến cáo đối với phác đồ xạ trị gia tốc và 74 Gy đối với xạ trị liều cao. Phẫu thuật cắt bỏ được cho phép sau khi hóa trị, trước hoặc sau khi xạ trị. Bệnh nhân trong nhóm TPF được điều trị kháng sinh dự phòng bằng ciprofloxacin 500 mg đường uống 2 lần/ngày trong 10 ngày bắt đầu từ ngày thứ 5 của mỗi chu kỳ điều trị , hoặc tương đương.
Mục tiêu chính của nghiên cứu này là sống còn không tiến triển bệnh (PFS), đã gia tăng đáng kể trong nhóm TPF so với nhóm PF, p=0,0042 (PFS trung vị: 11,4 so với 8,3 tháng tương ứng) với khoảng thời gian theo dõi trung vị 33,7 tháng. Thời gian sống còn toàn bộ cũng gia tăng đáng kể trong nhóm TPF so với nhóm PF (OS trung vị: 18,6 so với 14,5 tháng tương ứng) với nguy cơ tử vong giảm 28%, p=0,0128.
Kết quả về hiệu quả được thể hiện trong bảng 7.
- xem Bảng 7.
Các thông số về chất lượng sống
Bệnh nhân trong nhóm TPF ít bị sút giảm đáng kể về chỉ số sức khỏe toàn bộ so với bệnh nhân nhóm PF (p=0,01, sử dụng thang EORTC QLQ-C30).
Các thông số về lợi ích lâm sàng
Trên thang điểm chỉ số tổng trạng, phân nhóm thang điểm về đầu và cổ (PSS-HN) được thiết kế để đánh giá khả năng hiểu được lời nói, khả năng ăn uống nơi công cộng, và tính bình thường của chế độ ăn ưu thế thuộc nhóm TPF so với nhóm PF.
Thời gian trung vị đến khi có sự giảm sút đầu tiên về chỉ số tổng trạng WHO gia tăng đáng kể trong nhóm TPF so với nhóm PF. Điểm số về cường độ đau được cải thiện trong suốt quá trình điều trị trong cả 2 nhóm cho thấy sự kiểm soát đau đầy đủ.
Hóa trị gây đáp ứng tiếp theo là hóa-xạ trị (TAX324)
Tính an toàn và hiệu quả của docetaxel trong điều trị gây đáp ứng cho bệnh nhân bị ung thư biểu mô tế bào vảy vùng đầu-cổ tiến triển tại chỗ (SCCHN) được đánh giá trong một thử nghiệm pha III, ngẫu nhiên, nhãn mở, đa trung tâm (TAX324). Trong nghiên cứu này, 501 bệnh nhân bị SCCHN tiến triển tại chỗ, và có chỉ số tổng trạng WHO 0 hoặc 1, được chọn ngẫu nhiên vào một trong 2 nhóm. Các đối tượng của nghiên cứu bao gồm bệnh nhân mắc bệnh không thể cắt bỏ được về mặt kỹ thuật, bệnh nhân có xác suất chữa lành thấp bằng phẫu thuật và bệnh nhân nhắm tới bảo tồn cơ quan. Đánh giá về hiệu quả và tính an toàn chỉ tập trung vào các mục tiêu sống còn và sự thành công trong việc bảo tồn cơ quan vẫn chưa được chính thức chú trọng. Bệnh nhân trong nhóm docetaxel được điều trị docetaxel (T) 75 mg/m2 tiêm truyền tĩnh mạch vào ngày 1, tiếp theo là cisplatin (P) 100 mg/m2 tiêm truyền tĩnh mạch trong 30 phút đến 3 giờ, kế tiếp tiêm truyền tĩnh mạch 5-fluorouracil (F) 1.000 mg/m2/ngày liên tục từ ngày 1 đến ngày 4. Các chu kỳ điều trị lặp lại mỗi 3 tuần, trong 3 chu kỳ. Tất cả bệnh nhân không tiến triển bệnh được dùng hóa-xạ trị (CRT) dựa theo đề cương nghiên cứu (TPF/CRT). Bệnh nhân nhóm đối chứng được điều trị bằng cisplatin (P) 100 mg/m2 tiêm truyền tĩnh mạch trong 30 phút đến 3 giờ trong ngày 1, tiếp theo là tiêm truyền tĩnh mạch 5-fluorouracil (F) 1.000 mg/m2/ngày liên tục từ ngày 1 đến ngày 5. Các chu kỳ điều trị lặp lại mỗi 3 tuần, trong 3 chu kỳ. Tất cả các bệnh nhân không tiến triển bệnh được điều trị CRT như đề cương nghiên cứu (PF/CRT).
Bệnh nhân trong cả 2 nhóm được điều trị 7 tuần với CRT sau khi hóa trị gây đáp ứng với khoảng cách tối thiểu là 3 tuần và không quá 8 tuần, bắt đầu sau chu kỳ điều trị cuối cùng (ngày 22 đến ngày 56 của chu kỳ điều trị cuối cùng). Trong thời gian xạ trị, carboplatin (AUC 1,5) được dùng mỗi tuần tiêm truyền tĩnh mạch trong 1 giờ cho tối đa 7 liều. Xạ trị sử dụng thiết bị điện áp cao dùng phân liều 1 lần 1 ngày (2 Gy/ngày, 5 ngày/tuần trong 7 tuần, với tổng liều từ 70-72 Gy). Phẫu thuật ở vị trí khối u nguyên phát và/hoặc cổ có thể được cân nhắc bất kì thời gian nào sau khi kết thúc hóa-xạ trị. Tất cả các bệnh nhân trong nhóm điều trị chứa docetaxel của nghiên cứu này được dùng kháng sinh dự phòng. Mục tiêu hiệu quả chính trong nghiên cứu này, thời gian sống còn toàn bộ (OS) gia tăng đáng kể (kiểm định log-rank, p=0,0058) với phác đồ chứa docetaxel so với nhóm PF (OS trung vị: 70,6 so với 30,1 tháng tương ứng), và giảm 30% nguy cơ tử vong so với nhóm PF (tỉ số nguy cơ (HR) = 0,70, 95% khoảng tin cậy (CI) = 0,54-0,90) với khoảng thời gian theo dõi trung vị là 41,9 tháng. Mục tiêu nghiên cứu phụ, PFS, đã chứng minh là giảm 29% nguy cơ tiến triển bệnh hoặc tử vong và cải thiện 22 tháng về thời gian trung vị PFS (35,5 tháng trong nhóm TPF và 13,1 tháng trong nhóm PF). Điều này cũng có ý nghĩa thống kê với HR bằng 0,71; 95% CI 0,56-0,90; kiểm định log-rank p=0,004. Các kết quả về hiệu quả điều trị thể hiện trong bảng 8.
- xem Bảng 8.
Trẻ em
Cơ quan dược phẩm châu Âu đã miễn trừ nghĩa vụ nộp kết quả nghiên cứu của docetaxel trên tất cả phân nhóm trẻ em bị ung thư vú, ung thư phổi không tế bào nhỏ, ung thư tuyến tiền liệt, ung thư dạ dày và ung thư vùng đầu-cổ, không bao gồm ung thư mũi hầu biệt hóa kém độ II và III (xem mục Liều lượng và cách dùng - phần Bệnh nhi).
Dược động học
Hấp thu
Dược động học của docetaxel được đánh giá trên bệnh nhân ưng thư sau khi điều trị docetaxel 20-115 mg/m2 trong các nghiên cứu pha I. Đặc tính dược động học của docetaxel không phụ thuộc vào liều và tuân theo mô hình dược động học ba ngăn với thời gian bán thải của pha α, β và γ lần lượt là 4 phút, 36 phút và 11,1 giờ. Pha muộn một phần là do khả năng tống thuốc tương đối chậm từ ngăn ngoại vi.
Phân bố
Sau khi dùng một liều 100 mg/m2 được tiêm truyền trong 1 giờ, nồng độ đỉnh trong huyết tương trung bình đạt được là 3,7 μg/mL, tương ứng với AUC là 4,6 giờ.μg/mL. Giá trị trung bình của độ thanh thải toàn phần và thể tích phân bố ở trạng thái ổn định tương ứng là 21 L/giờ/m2 và 113 L. Sự khác biệt về độ thanh thải toàn phần giữa các cá thể xấp xỉ 50%. Docetaxel gắn kết với protein huyết tương trên 95%.
Thải trừ
Một nghiên cứu sử dụng đồng vị phóng xạ 14C-docetaxel đã được thực hiện trên ba bệnh nhân bị ung thư. Docetaxel được thải trừ qua cả nước tiểu và phân sau khi chuyển hóa oxy-hóa qua trung gian cytochrom P450 của nhóm tert-butylester, trong 7 ngày, bài tiết qua nước tiểu và qua phân lần lượt là khoảng 6% và 75% lượng hoạt chất phóng xạ đã dùng. Khoảng 80% hoạt chất phóng xạ được bài tiết qua phân diễn ra trong khoảng 48 giờ đầu tiên bao gồm một chất chuyển hóa chính không còn hoạt tính và 3 chất chuyển hóa không còn hoạt tính khác với lượng nhỏ và một lượng rất nhỏ thuốc ở dạng không biến đổi.
Các đối tượng đặc biệt
Tuổi và giới
Phân tích dược động học quần thể đã được thực hiện với docetaxel trên 557 bệnh nhân.Các thông số dược động học đã được tính toán bằng mô hình tương tự như mô hình đã được sử dụng trong những nghiên cứu pha I. Dược động học của docetacel không thay đổi theo tuổi hoặc giới tính của bệnh nhân.
Suy gan
Trong số ít bệnh nhân (n = 23) có dữ liệu sinh hóa lâm sàng có liên quan đến suy giảm chức năng gan nhẹ đến trung bình (AST, ALT gấp 1,5 lần giới hạn trên của trị bình thường (ULN) kèm theo phosphatase kiềm gấp 2,5 lần ULN), độ thanh thải toàn phần giảm khoảng 27% so với giá trị trung bình (xem mục Liều lượng và cách dùng).
Ứ dịch
Độ thanh thải của docetacel không thay đổi trên những bệnh nhân bị ứ dịch nhẹ đến trung bình và chưa có dữ liệu về những bệnh nhân bị ứ dịch nặng.
Phác đồ kết hợp
Doxorubicin
Khi sử dụng kết hợp, docetaxel không ảnh hưởng đến độ thanh thải của doxorubicin và nồng độ trong huyết tương của doxorubicinol (một chất chuyển hóa của doxorubicin). Dược động học của docetaxel, doxorubicin và cyclophosphamid không bị ảnh hưởng bởi việc sử dụng đồng thời các thuốc này.
Capecitabin
Nghiên cứu pha I đã đánh giá ảnh hưởng của capecitabin lên dược động học của docetaxel và và ngược lại. Kết quả cho thấy dược động học của docetaxel (Cmax và AUC) không bị ảnh hưởng bởi capecitabin và docetacel không ảnh hưởng đến dược động học của một chất chuyển hóa của capecitabin là 5’-DFUR.
Cisplatin
Độ thanh thải của docetaxel trong phác đồ kết hợp với cisplatin tương tự như giá trị được ghi nhận trong đơn trị. Đặc tính dược động học của cisplatin được dùng một thời gian ngắn sau khi tiêm truyền docetaxel tương tự như giá trị được ghi nhận khi dùng cisplatin đơn thuần.
Cisplatin và 5-flourouracil
Sử dụng kết hợp docetaxel, cisplatin và 5-flourouracil trên 12 bệnh nhân có khối u đặc không ảnh hưởng đến các thông số dược động học của mỗi thuốc riêng biệt.
Prednisolon và dexamethason
Ảnh hưởng của prednisolon đến dược động học của docetaxel khi được sử dụng với thuốc dùng trước dexamethason theo tiêu chuẩn đã được nghiên cứu trên 42 bệnh nhân.
Prednisolon
Prednisolon không ảnh hưởng đến dược động học của docetaxel.
Chỉ định/Công dụng
Ung thư vú
DOCETAXEL EBEWE phối hợp với doxorubicin và cyclophosphamid được chỉ định để điều trị bổ trợ (hỗ trợ) cho bệnh nhân bị ung thư vú có hạch dương tính và âm tính, có thể phẫu thuật được. Đối với những bệnh nhân bị ung thư vú có hạch âm tính, có thể phẫu thuật được, việc điều trị bổ trợ nên được giới hạn cho bệnh nhân đủ điều kiện để dùng hóa trị theo tiêu chuẩn quốc tế đã thiết lập cho điều trị chọn lọc ung thư vú giai đoạn sớm (xem mục Dược lực học).
DOCETAXEL EBEWE phối hợp với doxorubicin được chỉ định để điều trị cho bệnh nhân bị ung thư vú di căn hoặc tiến triển (tiến xa) tại chỗ chưa dùng liệu pháp độc tế bào trước đó cho bệnh trạng này.
DOCETAXEL EBEWE đơn trị được chỉ định để điều trị cho bệnh nhân bị ung thư vú di căn hoặc tiến triển tại chỗ sau khi thất bại với liệu pháp độc tế bào. Hóa trị trước đó nên bao gồm một anthracyclin hoặc một tác nhân alkyl hóa.
DOCETAXEL EBEWE phối hợp với trastuzumab được chỉ định để điều trị cho bệnh nhân bị ung thư vú di căn có biểu hiện quá mức thụ thể HER2 và chưa được hóa trị trước đó cho bệnh di căn.
DOCETAXEL EBEWE phối hợp với capecitabin được chỉ định để điều trị cho bệnh nhân bị ung thư vú di căn hoặc tiến triển tại chỗ sau khi thất bại với liệu pháp độc tế bào. Hóa trị liệu trước đó nên bao gồm một anthracyclin.
Ung thư phổi không tế bào nhỏ
DOCETAXEL EBEWE được chỉ định để điều trị cho bệnh nhân bị ung thư phổi không tế bào nhỏ di căn hoặc tiến triển tại chỗ sau khi thất bại với hóa trị trước đó.
DOCETAXEL EBEWE phối hợp với cisplatin được chỉ định để điều trị cho bệnh nhân bị ung thư phổi không tế bào nhỏ di căn hoặc tiến triển tại chỗ không thể cắt bỏ được và chưa dùng hóa trị trước đó cho bệnh trạng này.
Ung thư tuyến tiền liệt
DOCETAXEL EBEWE phối hợp với prednison hoặc prednisolon được chỉ định để điều trị cho bệnh nhân bị ung thư tuyến tiền liệt di căn kháng hormon.
Ung thư biểu mô tuyến dạ dày (ung thư dạ dày)
DOCETAXEL EBEWE phối hợp với cisplatin và 5-fluorouracil được chỉ định để điều trị cho bệnh nhân bị ung thư dạ dày di căn, bao gồm ung thư biểu mô tuyến đoạn nối dạ dày-thực quản chưa dùng hóa trị trước đó cho bệnh di căn.
Ung thư vùng đầu-cổ
DOCETAXEL EBEWE phối hợp với cisplatin và 5-fluorouracil được chỉ định để điều trị gây đáp ứng (điều trị dẫn đầu) cho bệnh nhân bị ung thư biểu mô tế bào vảy vùng đầu-cổ tiến triển tại chỗ.
Liều lượng & Cách dùng
Việc sử dụng docetaxel nên được giới hạn trong các đơn vị có chuyên môn sử dụng hóa trị độc tế bào và nên được sử dụng dưới sự giám sát của các bác sĩ có đủ kinh nghiệm sử dụng hóa trị chống ung thư (xem mục Cảnh báo).
Liều khuyến cáo
Đối với ung thư vùng đầu-cổ, ung thư dạ dày, ung thư phổi không tế bào nhỏ và ung thư vú, trừ khi có chống chỉ định, thuốc dùng trước bao gồm corticosteroid đường uống như dexamethason 16 mg/ngày (ví dụ 8 mg/lần, 2 lần/ngày) có thể được dùng trong 3 ngày, bắt đầu 1 ngày trước khi dùng docetaxel (xem mục Cảnh báo). G-CSF dự phòng có thể được sử dụng để làm giảm nguy cơ độc tính huyết học.
Đối với ung thư tuyến tiền liệt, cho sử dụng đồng thời prednison hoặc prednisolon với thuốc dùng trước được khuyến cáo là dexamethason 8 mg, uống 12 giờ, 3 giờ và 1 giờ trước khi dùng docetaxel (xem mục Cảnh báo).
Docetaxel được dùng tiêm truyền trong 1 giờ, chu kỳ mỗi 3 tuần.
Ung thư vú
Trong điều trị bổ trợ ung thư vú có hạch dương tính và âm tính có thể phẫu thuật được, liều khuyến cáo của docetaxel là 75 mg/m2 được tiêm truyền trong 1 giờ sau khi dùng doxorubicin 50 mg/m2 và cyclophosphamid 500 mg/m2, chu kỳ mỗi 3 tuần, trong 6 chu kỳ điều trị (phác đồ TAC) (xem mục Điều chỉnh liều trong khi điều trị).
Trong điều trị cho bệnh nhân bị ung thư vú di căn hoặc tiến triển tại chỗ, liều khuyến cáo của docetaxel là 100 mg/m2 dùng đơn trị. Trong điều trị bước một, docetaxel 75 mg/m2 được dùng phối hợp với doxorubicin (50 mg/m2).
Trong phối hợp với trastuzumab, liều khuyến cáo của docetaxel là 100 mg/m2 mỗi 3 tuần, với trastuzumab dùng mỗi tuần. Trong một thử nghiệm đăng ký thuốc, khởi đầu tiêm truyền docetaxel được bắt đầu vào sau ngày dùng liều đầu tiên của trastuzumab. Các liều kế tiếp của docetaxel được sử dụng ngay sau khi hoàn tất tiêm truyền trastuzumab nếu như liều trước của trastuzumab được dung nạp tốt. Xem tóm tắt đặc tính sản phẩm của trastuzumab về liều lượng và cách dùng trastuzumab.
Trong phối hợp với capecitabin, liều khuyến cáo của docetaxel là 75 mg/m2 mỗi 3 tuần, phối hợp với capecitabin 1.250 mg/m2 2 lần/ngày (trong vòng 30 phút sau bữa ăn) trong 2 tuần sau đó nghỉ 1 tuần. Xem tóm tắt đặc tính sản phẩm của capecitabin về việc tính liều cho capecitabin dựa trên diện tích bề mặt cơ thể.
Ung thư phổi không tế bào nhỏ
Trên bệnh nhân bị ung thư phổi không tế bào nhỏ chưa dùng hóa trị, phác đồ liều dùng được khuyến cáo là docetaxel 75 mg/m2, tiếp ngay sau là cisplatin 75 mg/m2 tiêm truyền trong 30-60 phút. Đối với điều trị sau khi thất bại với hóa trị chứa platin trước đó, liều khuyến cáo của docetaxel là 75 mg/m2 dùng đơn trị.
Ung thư tuyến tiền liệt
Liều khuyến cáo của docetaxel là 75 mg/m2. Prednison hoặc prednisolon 5 mg dùng đường uống 2 lần/ngày được dùng liên tục (xem mục Dược lực học).
Ung thư dạ dày
Liều khuyến cáo của docetaxel là 75 mg/m2 tiêm truyền trong 1 giờ, tiếp theo là cisplatin 75 mg/m2 tiêm truyền trong 1 - 3 giờ (cả 2 thuốc chỉ dùng trong ngày đầu tiên), tiếp theo dùng 5-fluorouracil 750 mg/m2 mỗi ngày, trong 5 ngày, tiêm truyền liên tục trong 24 giờ, bắt đầu sau khi kết thúc tiêm truyền cisplatin. Chu kỳ điều trị được lặp lại mỗi 3 tuần. Bệnh nhân phải được điều trị trước bằng thuốc chống nôn và bù nước thích hợp khi sử dụng cisplatin. Nên dùng G-CSF dự phòng để làm giảm nguy cơ độc tính huyết học (xem mục Điều chỉnh liều trong khi điều trị).
Ung thư vùng đầu-cổ
Bệnh nhân phải được điều trị trước bằng thuốc chống nôn và bù nước thích hợp (trước và sau khi dùng cisplatin). Có thể dùng G-CSF dự phòng để giảm nguy cơ độc tính huyết học. Tất cả bệnh nhân trong các nhóm điều trị có docetaxel trong các nghiên cứu TAX 323 và TAX 324 đều được sử dụng kháng sinh dự phòng.
Hóa trị gây đáp ứng tiếp theo là xạ trị (TAX 323)
Trong điều trị gây đáp ứng của ung thư tế bào vảy vùng đầu-cổ tiến triển tại chỗ không thể phẫu thuật được (SCCHN), liều khuyến cáo của docetaxel là 75 mg/m2 tiêm truyền trong 1 giờ tiếp theo tiêm truyền cisplatin 75 mg/m2 hơn 1 giờ, vào ngày đầu tiên, sau đó tiêm truyền liên tục 5-fluorouracil 750 mg/m2 mỗi ngày trong 5 ngày. Phác đồ này được dùng mỗi 3 tuần trong 4 chu kỳ điều trị. Sau hóa trị, bệnh nhân nên được xạ trị.
Hóa trị gây đáp ứng tiếp theo là hóa-xạ trị (TAX 324)
Trong điều trị gây đáp ứng cho bệnh nhân bị ung thư tế bào vảy vùng đầu-cổ tiến triển tại chỗ (SCCHN) (không thể cắt bỏ được vì lý do kỹ thuật, ít khả năng chữa lành bằng phẫu thuật, và nhằm bảo tồn cơ quan), liều khuyến cáo của docetaxel là 75 mg/m2 tiêm truyền tĩnh mạch trong 1 giờ vào ngày đầu tiên, tiếp theo cisplatin 100 mg/m2 tiêm truyền tĩnh mạch trong 30 phút đến 3 giờ, sau đó là 5-fluorouracil 1.000 mg/m2/ngày tiêm truyền liên tục từ ngày 1 đến ngày 4, phác đồ này được dùng mỗi 3 tuần trong 3 chu kỳ điều trị. Sau hóa trị, bệnh nhân được hóa-xạ trị. Để chỉnh liều của cisplatin và 5-fluorouracil, xem tóm tắt đặc tính của các dược phẩm này.
Điều chỉnh liều trong khi điều trị
Tổng quát
Docetaxel nên được sử dụng khi số lượng bạch cầu trung tính ≥ 1.500 tế bào/mm3. Đối với bệnh nhân bị giảm bạch cầu trung tính có sốt hoặc số lượng bạch cầu trung tính < 500 tế bào/mm3 trong hơn 1 tuần, hoặc có phản ứng da tích lũy hoặc nặng hoặc có bệnh lý thần kinh ngoại biên nặng trong thời gian sử dụng docetaxel, liều dùng của Docetaxel Ebewe nên được giảm từ 100 mg/m2 xuống 75 mg/m2 và/hoặc từ 75 mg/m2 xuống 60 mg/m2. Nếu bệnh nhân tiếp tục có những phản ứng này ở liều 60 mg/m2 nên ngưng điều trị.
Điều trị bổ trợ ung thư vú
Dự phòng nguyên phát bằng G-CSF nên được cân nhắc trên bệnh nhân bị ung thư vú dùng liệu pháp bổ trợ docetaxel, doxorubicin và cyclophosphamid (phác đồ TAC). Những bệnh nhân bị giảm bạch cầu trung tính có sốt và/hoặc nhiễm trùng do giảm bạch cầu trung tính cần giảm liều docetaxel đến 60 mg/m2 trong tất cả các chu kỳ tiếp theo (xem mục Cảnh báo và Tác dụng ngoại ý). Bệnh nhân bị viêm miệng mức độ 3 hoặc 4 nên giảm liều đến 60 mg/m2.
Trong phối hợp với cisplatin
Đối với bệnh nhân khởi đầu đã dùng liều docetaxel 75 mg/m2 phối hợp với cisplatin và bệnh nhân có lượng tiểu cầu thấp nhất < 25.000 tế bào/mm3 trong chu kỳ điều trị trước đó, hoặc bệnh nhân bị giảm bạch cầu trung tính có sốt hoặc bệnh nhân bị độc tính ngoài huyết học nghiêm trọng, liều docetaxel trong các chu kỳ tiếp theo nên giảm đến 65 mg/m2. Để điều chỉnh liều của cisplatin, xem tóm tắt đặc tính sản phẩm của cisplatin.
Trong phối hợp với capecitabin
Để điều chỉnh liều của capecitabin, xem tóm tắt đặc tính sản phẩm của capecitabin.
Đối với bệnh nhân xuất hiện lần đầu độc tính độ 2 và vẫn tiếp diễn trong quá trình điều trị docetaxel/capecitabin tiếp theo, trì hoãn điều trị cho đến khi phục hồi về độ 0-1, và bắt đầu lại 100% liều dùng ban đầu.
Đối với bệnh nhân xuất hiện lần 2 độc tính độ 2 hoặc xuất hiện lần đầu độc tính độ 3 tại bất kỳ thời điểm nào trong thời gian điều trị, trì hoãn điều trị cho đến khi phục hồi về độ 0-1, và bắt đầu lại điều trị bằng docetaxel 55 mg/m2.
Bất kỳ độc tính nào xuất hiện liên tiếp, hoặc xuất hiện bất kỳ độc tính độ 4, ngừng điều trị bằng docetaxel.
Để điều chỉnh liều của trastuzumab, xem tóm tắt đặc tính sản phẩm của trastuzumab.
Trong phối hợp với cisplatin và 5-fluorouracil
Nếu xuất hiện giảm bạch cầu trung tính có sốt, giảm bạch cầu trung tính kéo dài hoặc nhiễm trùng do giảm bạch cầu trung tính mặc dù đã sử dụng G-CSF, liều docetaxel nên giảm từ 75 xuống 60 mg/m2. Nếu giảm bạch cầu trung tính có biến chứng tiếp tục xảy ra, liều của docetaxel nên giảm từ 60 xuống 45 mg/m2. Trong trường hợp giảm tiểu cầu độ 4, liều của docetaxel nên giảm từ 75 xuống 60 mg/m2. Bệnh nhân không nên được điều trị bằng docetaxel trong các chu kỳ tiếp theo cho đến khi số lượng bạch cầu trung tính khôi phục đến mức > 1.500 tế bào/mm3 và số lượng tiểu cầu khôi phục đến mức > 100.000 tế bào/mm3. Ngừng điều trị nếu các độc tính này kéo dài (xem mục Cảnh báo).
- xem Bảng 9.

Để chỉnh liều của cisplatin và 5-fluorouracil, xem tóm tắt đặc tính sản phẩm của các thuốc tương ứng.
Trong các thử nghiệm đăng ký thuốc SCCHN, bệnh nhân bị giảm bạch cầu trung tính có biến chứng (bao gồm giảm bạch cầu trung tính kéo dài, giảm bạch cầu trung tính có sốt hoặc nhiễm khuẩn) được khuyến cáo sử dụng G-CSF để dự phòng (ví dụ ngày 6-15) trong tất cả các chu kỳ điều trị tiếp theo.
Các đối tượng đặc biệt
Bệnh nhân suy gan
Dựa trên các dữ liệu dược động học với docetaxel 100 mg/m2 dùng đơn trị, bệnh nhân bị tăng cả hai transaminase (ALT và/hoặc AST) cao hơn 1,5 lần giới hạn trên của mức bình thường (ULN) và phosphatase kiềm cao hơn 2,5 lần ULN, liều khuyến cáo của docetaxel là 75 mg/m2 (xem mục Cảnh báo và Dược động học). Đối với bệnh nhân có bilirubin huyết thanh > ULN và/hoặc ALT và AST > 3,5 lần ULN kết hợp với phosphatase kiềm > 6 lần ULN, không thể đưa ra khuyến cáo giảm liều và không nên sử dụng docetaxel trừ khi có chỉ định nghiêm ngặt.
Trong phối hợp với cisplatin và 5-fluorouracil để điều trị bệnh nhân bị ung thư dạ dày, thử nghiệm lâm sàng đăng ký thuốc đã loại trừ các bệnh nhân có ALT và/hoặc AST > 1,5 lần ULN kết hợp với phosphatase kiềm > 2,5 lần ULN, và bilirubin > ULN; đối với những bệnh nhân này, không thể đưa ra khuyến cáo giảm liều và không nên sử dụng docetaxel trừ khi có chỉ định nghiêm ngặt. Hiện không có dữ liệu về bệnh nhân bị suy chức năng gan được điều trị bằng docetaxel trong liệu pháp phối hợp trong các chỉ định khác.
Bệnh nhi
Tính an toàn và hiệu quả của DOCETAXEL EBEWE trong điều trị ung thư vùng mũi-hầu trên trẻ em từ 1 tháng tuổi đến dưới 18 tuổi chưa được thiết lập. Không có thông tin liên quan sử dụng DOCETAXEL EBEWE trên trẻ em trong chỉ định để điều trị ung thư vú, ung thư phổi không tế bào nhỏ, ung thư tuyến tiền liệt, ung thư dạ dày và ung thư vùng đầu-cổ, không bao gồm ung thư vùng mũi-hầu kém biệt hóa typ II và III.
Người cao tuổi
Dựa trên các phân tích dược động học quần thể, không có chỉ dẫn đặc biệt về sử dụng thuốc này trên người cao tuổi. Khi phối hợp với capecitabin cho bệnh nhân 60 tuổi hoặc hơn, khuyến cáo giảm liều ban đầu của capecitabin xuống 75% (xem Tóm tắt đặc tính sản phẩm của capecitabin).
Một số lưu ý đặc biệt về xử lý thuốc trước và sau khi sử dụng thuốc
Dung dịch đậm đặc để pha dung dịch tiêm truyền docetaxel là một dung dịch siêu bão hòa và do đó có thể kết tinh/kết tủa theo thời gian. Dung dịch tiêm truyền chuẩn bị từ dung dịch đậm đặc để pha dung dịch tiêm truyền docetaxel nên được kiểm tra bằng mắt cẩn thận để phát hiện sự kết tủa trước khi sử dụng. Nếu dung dịch tiêm truyền không trong suốt hoặc xuất hiện sự kết tủa phải bị loại bỏ.
Theo quan điểm vi sinh học, sản phẩm này nên được sử dụng ngay sau khi pha.
Kiểm tra trước khi sử dụng
Dung dịch đậm đặc để pha dung dịch tiêm truyền DOCETAXEL EBEWE nên được kiểm tra bằng mắt để phát hiện các tiểu phân và sự đổi màu trước khi sử dụng. Nếu dung dịch đậm đặc không trong suốt hoặc xuất hiện sự kết tủa phải bị loại bỏ.
Chuẩn bị dung dịch tiêm truyền
Dung dịch đậm đặc phải được pha loãng trước khi sử dụng.
Dung dịch tiêm truyền cần được chuẩn bị với natri chlorid 0,9% hoặc glucose 5% và dùng theo đường tiêm truyền tĩnh mạch.
Nếu các lọ được bảo quản trong tủ lạnh, lấy ra một lượng cần dùng các lọ dung dịch đậm đặc để pha dung dịch tiêm truyền docetaxel đặt ở nơi dưới 25°C cho đến khi dung dịch đạt đến nhiệt độ phòng.
Lượng thuốc cần dùng có thể được rút trực tiếp từ lọ thuốc.
Có thể cần hơn 1 lọ để có được một liều cần dùng cho bệnh nhân. Dựa trên liều cần dùng cho bệnh nhận được tính bằng mg, rút một lượng dịch tương ứng chứa docetaxel 10 mg/mL từ một số lọ thuốc thích hợp trong điều kiện vô trùng, bằng cách sử dụng bơm tiêm chia độ có gắn kim tiêm. Ví dụ, liều 140 mg docetaxel yêu cầu 14 mL dung dịch docetaxel đậm đặc để pha dung dịch tiêm truyền.
Tiêm lượng dung dịch docetaxel đậm đặc để pha dung dịch tiêm truyền cần dùng qua một lần tiêm vào túi hoặc chai dịch truyền 250 mL có chứa dung dịch glucose 5% hoặc natri chlorid 0,9% để tiêm truyền.
Nếu một mức liều lớn hơn 200 mg docetaxel được yêu cầu, hãy sử dụng một dụng cụ truyền có thể tích lớn hơn sao cho nồng độ docetaxel không bị vượt quá 0,74 mg/mL.
Trộn đều túi hoặc chai dịch truyền bằng tay bằng cách đảo ngược và xoay nhẹ nhàng một cách có kiểm soát và tránh tạo bọt. Cần tránh lắc hoặc tác động mạnh trong khi chuẩn bị và vận chuyển để dùng cho bệnh nhân.
Dung dịch tiêm truyền docetaxel đã chuẩn bị có độ ổn định lên đến 4 giờ và nên được sử dụng trong vòng 4 giờ, bao gồm thời gian bảo quản và một giờ tiêm truyền cho bệnh nhân. Nên tiêm truyền trong điều kiện vô trùng ở nhiệt độ phòng (dưới 25°C) và trong điều kiện ánh sáng bình thường.
Dung dịch tiêm truyền chuẩn bị từ dung dịch docetaxel đậm đặc để pha dung dịch tiêm truyền nên được kiểm tra bằng mắt cẩn thận để phát hiện sự kết tủa trước khi sử dụng. Nếu dung dịch tiêm truyền không trong suốt hoặc xuất hiện sự kết tủa phải bị loại bỏ. Theo quan điểm vi sinh học, sản phẩm này nên được sử dụng ngay sau khi pha loãng.
Sự tiếp xúc của dung dịch docetaxel đậm đặc với các thiết bị hoặc dụng cụ làm bằng chất dẻo PVC dùng để chuẩn bị dung dịch tiêm truyền không được khuyến cáo. Nhằm mục đích hạn chế bệnh nhân tiếp xúc với chất dẻo DEHP (di-2-ethylhexyl phthalat) có thể được tiết ra từ các túi hoặc thiết bị tiêm truyền PVC, dung dịch docetaxel pha loãng cuối cùng dùng để tiêm truyền nên được lưu trữ trong các chai hoặc túi chất dẻo (polypropylen, polyolefin) và tiêm truyền qua bộ dây tiêm truyền bằng polyethylen.
Để hạn chế nguy cơ kết tủa của dung dịch tiêm truyền, khuyến cáo sử dụng túi. Không khuyến cáo sử dụng chai thủy tinh.
pH và nồng độ thẩm thấu của dung dịch hoàn nguyên
0,3 mg/mL trong glucose 5%: pH ≈ 3,6; 517 mOsm/kg
0,74 mg/mL trong NaCl 0,9%: pH ≈ 3,3 - 3,6; 849 mOsm/kg
Hướng dẫn xử lý an toàn các thuốc chống ung thư
Công tác chuẩn bị thuốc độc tế bào không nên được thực hiện bởi nhân viên có thai. Nhân viên nên được huấn luyện để pha loãng thuốc. Công việc này nên được tiến hành trong một khu vực riêng. Bề mặt của nơi thực hiện chuẩn bị thuốc nên được phủ bằng giấy thấm, mặt dưới bằng chất dẻo, dùng một lần.
Sử dụng găng tay, khẩu trang, và quần áo bảo vệ thích hợp. Cần thận trọng để tránh thuốc vô tình tiếp xúc với da hoặc niêm mạc, vùng bị tiếp xúc nên được rửa sạch với xà phòng và nước. Nếu vấy nhiễm vô tình xảy ra với mắt thì nên rửa sạch ngay với nước.
Sử dụng dụng cụ khóa Luer lắp ráp tất cả các bơm tiêm và thiết bị. Kim tiêm loại lớn được khuyến cáo sử dụng để giảm thiểu áp lực và khả năng hình thành các bọt khí. Bọt khí có thể được giảm thiểu bằng cách dùng kim có lỗ thông khí.
Bất kì lượng thuốc nào không được sử dụng đều nên được loại bỏ. Lưu ý thận trọng trong việc loại bỏ các vật dụng dùng pha loãng DOCETAXEL EBEWE. Bất kì một sản phẩm nào không được sử dụng hoặc vật dụng đã vấy nhiễm thuốc đều nên cho vào túi chứa rác thải loại nguy cơ cao. Các vật sắc nhọn (như kim tiêm, bơm tiêm, lọ thuốc...) nên cho vào một hộp cứng thích hợp. Cá nhân có liên quan đến việc thu nhặt và loại bỏ các vật phẩm thải này nên có nhận thức về các rủi ro có thể gặp phải. Bất kì sản phẩm nào không được sử dụng hoặc vật liệu thải nên được loại bỏ theo quy trình chuẩn áp dụng cho các thuốc độc tế bào. Bất kì lượng dung dịch thuốc thừa nào nên được xả sạch trực tiếp qua ống dẫn lưu với nhiều nước.
Thuốc có thể dùng nhiều lần, xin xem mục Bảo quản.
Đường dùng
DOCETAXEL EBEWE chỉ dùng tiêm truyền tĩnh mạch.
Cảnh báo
Đối với ung thư vú và ung thư phổi không tế bào nhỏ, thuốc điều trị trước, trừ khi có chống chỉ định, bao gồm corticosteroid đường uống như dexamethason 16 mg mỗi ngày (chia 2 lần, mỗi lần 8 mg) trong 3 ngày, bắt đầu 1 ngày trước khi điều trị bằng docetaxel, có thể làm giảm tỉ lệ và độ nặng của ứ dịch cũng như độ nặng của các phản ứng quá mẫn. Đối với ung thư tuyến tiền liệt, thuốc điều trị trước là dexamethason đường uống 8 mg, 12 giờ, 3 giờ và 1 giờ trước khi tiêm truyền docetaxel (xem mục Liều lượng và cách dùng).
Về huyết học
Giảm bạch cầu trung tính là phản ứng bất lợi phổ biến nhất của docetaxel. Số lượng bạch cầu trung tính giảm xuống ở mức thấp nhất trong khoảng thời gian trung bình 7 ngày nhưng khoảng thời gian này có thể ngắn hơn trên những bệnh nhân đã được điều trị mạnh tay trước đó. Tất cả các bệnh nhân điều trị bằng docetaxel nên được kiểm tra công thức máu toàn phần thường xuyên. Bệnh nhân nên được tiếp tục điều trị bằng docetaxel khi số lượng bạch cầu trung tính hồi phục ≥ 1.500 tế bào/mm3 (xem mục Liều lượng và cách dùng).
Trường hợp giảm bạch cầu trung tính nặng (< 500 tế bào/mm3 trong 7 ngày hoặc hơn) trong một đợt điều trị bằng docetaxel, cần cân nhắc giảm liều cho các đợt điều trị tiếp theo hoặc sử dụng các biện pháp điều trị triệu chứng thích hợp (xem mục Liều lượng và cách dùng).
Trên những bệnh nhân điều trị docetaxel phối hợp với cisplatin và 5-fluorouracil (TCF), hiện tượng giảm bạch cầu trung tính có sốt và nhiễm trùng do giảm bạch cầu trung tính xảy ra với tỉ lệ thấp hơn khi bệnh nhân được điều trị dự phòng G-CSF. Bệnh nhân điều trị TCF nên được điều trị dự phòng G-CSF để làm giảm nguy cơ giảm bạch cầu trung tính có biến chứng (giảm bạch cầu trung tính có sốt, giảm bạch cầu trung tính kéo dài và nhiễm trùng do giảm bạch cầu trung tính). Bệnh nhân được điều trị TCF nên được theo dõi chặt chẽ (xem mục Liều lượng và cách dùng và Tác dụng ngoại ý).
Trên những bệnh nhân được điều trị bằng docetaxel kết hợp với doxorubicin và cyclophosphamid (TAC), giảm bạch cầu trung tính có sốt và/hoặc nhiễm trùng do giảm bạch cầu trung tính xuất hiện với tỷ lệ thấp hơn nếu bệnh nhân đã được điều trị dự phòng nguyên phát bằng G-CSF. Dự phòng nguyên phát bằng G-CSF cần được cân nhắc với những bệnh nhân bị ung thư vú được điều trị bổ trợ bằng phác đồ TAC để giảm thiểu nguy cơ giảm bạch cầu trung tính có biến chứng (giảm bạch cầu trung tính có sốt, giảm bạch cầu trung tính kéo dài hoặc nhiễm trùng do giảm bạch cầu trung tính). Những bệnh nhân được điều trị bằng phác đồ TAC cần được theo dõi chặt chẽ (xem mục Liều lượng và cách dùng và Tác dụng ngoại ý).
Các phản ứng quá mẫn
Bệnh nhân nên được giám sát chặt chẽ về các phản ứng quá mẫn đặc biệt là trong suốt lần tiêm truyền đầu tiên và thứ 2. Các phản ứng quá mẫn có thể xảy ra chỉ trong vòng một vài phút sau khi bắt đầu tiêm truyền docetaxel, vì thế các phương tiện điều trị hạ huyết áp và co thắt phế quản phải luôn luôn có sẵn. Nếu các phản ứng quá mẫn xảy ra, triệu chứng nhẹ như phản ứng đỏ bửng da hoặc phản ứng da tại chỗ thì không cần dừng điều trị. Tuy nhiên, các phản ứng nặng như hạ huyết áp nặng, co thắt phế quản hoặc ban da/hồng ban toàn thân yêu cầu dừng ngay việc điều trị bằng docetaxel và có liệu pháp điều trị thích hợp. Bệnh nhân đã có các phản ứng quá mẫn nặng với docetaxel thì không nên tái điều trị với thuốc này.
Bệnh nhân từng bị phản ứng quá mẫn với paclitaxel có thể có nguy cơ bị phản ứng quá mẫn với docetaxel, bao gồm phản ứng quá mẫn nặng hơn. Những bệnh nhân này nên được theo dõi chặt chẽ khi bắt đầu điều trị bằng docetaxel.
Các phản ứng da
Đã quan sát thấy hồng ban khu trú ở các chi (lòng bàn tay và lòng bàn chân) với phù nề và kế tiếp là tróc vảy. Các triệu chứng nặng như bóng nước tiếp theo là tróc vảy làm gián đoạn hoặc ngừng điều trị bằng docetaxel đã được báo cáo (xem mục Liều lượng và cách dùng).
Ứ dịch
Bệnh nhân bị ứ dịch nặng như tràn dịch màng phổi, tràn dịch màng ngoài tim và cổ trướng nên được theo dõi chặt chẽ.
Rối loạn hô hấp
Hội chứng suy hô hấp cấp, viêm phổi kẽ/viêm phổi, bệnh phổi mô kẽ, xơ phổi và suy hô hấp đã được báo cáo và có thể có liên quan đến kết cục tử vong của bệnh nhân. Các trường hợp viêm phổi do phóng xạ đã được báo cáo trên những bệnh nhân được điều trị đồng thời bằng xạ trị.
Nếu những triệu chứng của bệnh phổi bắt đầu xuất hiện hoặc nặng hơn, bệnh nhân cần được theo dõi chặt chẽ, chẩn đoán kịp thời và điều trị thích hợp. Tạm dừng điều trị bằng docetaxel được khuyến cáo cho đến khi có chẩn đoán xác định. Sử dụng sớm các biện pháp chăm sóc hỗ trợ có thể giúp cải thiện tình trạng bệnh. Lợi ích của việc tiếp tục điều trị bằng docetaxel phải được xem xét thận trọng.
Bệnh nhân suy gan
Bệnh nhân dùng đơn trị với docetaxel 100 mg/m2 có nồng độ transaminase huyết thanh (ALT và/hoặc AST) lớn hơn 1,5 lần ULN đồng thời nồng độ phosphatase kiềm huyết thanh lớn hơn 2,5 lần ULN, có nguy cơ cao mắc các phản ứng bất lợi nặng như các trường hợp chết do nhiễm độc bao gồm nhiễm khuẩn huyết và xuất huyết tiêu hóa có thể dẫn đến tử vong, giảm bạch cầu trung tính có sốt, nhiễm trùng, giảm tiểu cầu, viêm miệng và suy nhược. Vì thế, mức liều khuyến cáo của docetaxel trên bệnh nhân có xét nghiệm chức năng gan (LFTs) tăng là 75 mg/m2 và LTFs nên được thực hiện lúc khởi trị và trước mỗi chu kỳ điều trị (xem mục Liều lượng và cách dùng).
Đối với bệnh nhân có nồng độ bilirubin huyết thanh > ULN và/hoặc ALT và AST > 3,5 lần ULN đồng thời nồng độ phosphatase kiềm huyết thanh > 6 lần ULN, không thể đưa ra khuyến cáo giảm liều và không nên sử dụng docetaxel trừ khi có chỉ định nghiêm ngặt.
Trong phối hợp với cisplatin và 5-fluorouracil để điều trị cho bệnh nhân bị ung thư dạ dày, thử nghiệm lâm sàng đăng ký thuốc đã loại trừ các bệnh nhân có ALT và/hoặc AST > 1,5 lần ULN kèm với phosphatase kiềm > 2,5 lần ULN, và bilirubin > ULN; đối với những bệnh nhân này, không thể đưa ra khuyến cáo giảm liều và không sử dụng docetaxel trừ khi có chỉ định nghiêm ngặt. Hiện không có dữ liệu trên bệnh nhân bị suy gan dùng docetaxel trong điều trị phối hợp cho các chỉ định khác.
Bệnh nhân suy thận
Hiện không có dữ liệu trên bệnh nhân bị suy thận nặng điều trị bằng docetaxel.
Hệ thần kinh
Cần giảm liều docetaxel khi có biểu hiện độc tính thần kinh ngoại biên thể nặng (xem mục Liều lượng và cách dùng).
Độc tính trên tim
Đã quan sát thấy suy tim trên những bệnh nhân điều trị bằng docetaxel phối hợp với trastuzumab, đặc biệt là sau hóa trị chứa anthracyclin (doxorubicin hoặc epirubicin). Độc tính này có thể từ trung bình đến nặng và có thể dẫn đến tử vong (xem mục Tác dụng ngoại ý).
Nên đánh giá chức năng tim ngay từ ban đầu nếu dự định điều trị cho bệnh nhân bằng docetaxel phối hợp với trastuzumab. Chức năng tim nên được theo dõi thêm trong suốt quá trình điều trị (ví dụ 3 tháng 1 lần) để giúp phát hiện các bệnh nhân có thể xảy ra rối loạn chức năng tim. Xem tóm tắt đặc tính thuốc của trastuzumab để biết thêm chi tiết.
Rối loạn nhịp thất bao gồm nhịp nhanh thất (đôi khi gây tử vong) đã được báo cáo trên những bệnh nhân điều trị bằng docetaxel trong phác đồ phối hợp bao gồm doxorubicin, 5-fluorouracil và/hoặc cyclophosphamid (xem mục Tác dụng ngoại ý).
Khuyến cáo đánh giá chức năng tim ngay từ ban đầu.
Rối loạn thị giác
Phù hoàng điểm dạng nang (CMO) đã được báo cáo trên những bệnh nhân điều trị bằng docetaxel. Những bệnh nhân bị suy giảm thị lực cần được kiểm tra nhãn khoa kịp thời và đầy đủ. Nếu CMO được chẩn đoán, cần dừng điều trị bằng docetaxel và có phương pháp điều trị thích hợp (xem mục Tác dụng ngoại ý).
Cảnh báo và thận trọng khác
Các biện pháp tránh thai phải được áp dụng cho cả nam và nữ trong suốt quá trình điều trị và ít nhất 6 tháng sau khi ngừng điều trị đối với nam (xem mục Sử dụng cho phụ nữ có thai và cho con bú).
Nên tránh sử dụng đồng thời docetaxel với các chất ức chế mạnh CYP3A4 (ví dụ ketoconazol, itraconazol, clarithromycin, indinavir, nefazodon, nelfinavir, ritonavir, saquinavir, telithromycin và voriconazol (xem mục Tương tác).
Các thận trọng thêm về sử dụng thuốc trong điều trị bổ trợ ung thư vú
Giảm bạch cầu trung tính có biến chứng
Đối với bệnh nhân bị giảm bạch cầu trung tính có biến chứng (giảm bạch cầu trung tính kéo dài, giảm bạch cầu trung tính có sốt hoặc nhiễm khuẩn), nên cân nhắc sử dụng G-CSF và giảm liều docetaxel (xem mục Liều lượng và cách dùng).
Các phản ứng đường tiêu hóa
Các triệu chứng như đau bụng sớm và nhạy cảm đau, sốt, tiêu chảy, kèm hoặc không kèm giảm bạch cầu trung tính, có thể là những biểu hiện sớm của các độc tính nghiêm trọng trên đường tiêu hóa vì thế nên được đánh giá và điều trị nhanh chóng.
Suy tim xung huyết (CHF)
Bệnh nhân nên được theo dõi các triệu chứng của suy tim xung huyết trong quá trình điều trị và trong giai đoạn theo dõi. Trên những bệnh nhân điều trị ung thư vú có hạch dương tính bằng phác đồ TAC, nguy cơ mắc CHF tăng lên trong năm đầu tiên sau điều trị (xem mục Tác dụng ngoại ý và Dược lực học).
Bệnh bạch cầu
Bệnh nhân được điều trị bằng docetaxel, doxorubicin và cyclophosphamid (phác đồ TAC) cần được theo dõi về huyết học do có nguy cơ bị loạn sản tủy xương hoặc ung thư bạch cầu dòng tủy muộn.
Bệnh nhân có ≥ 4 hạch dương tính
Do lợi ích ghi nhận trên những bệnh nhân có ≥ 4 hạch dương tính không khác biệt có ý nghĩa thống kê trên tiêu chí sống còn không bệnh (DFS) và sống còn toàn bộ (OS), tỷ số lợi ích/nguy cơ ủng hộ cho việc sử dụng TAC cho những bệnh nhân có ≥ 4 hạch dương tính không được chứng minh đầy đủ trong phân tích cuối cùng (xem mục Dược lực học).
Người cao tuổi
Dữ liệu trên bệnh nhân trên 70 tuổi điều trị docetaxel phối hợp với doxorubicin và cyclophosphamid còn hạn chế.
Trong số 333 bệnh nhân điều trị bằng docetaxel mỗi 3 tuần trong một nghiên cứu về ung thư tuyến tiền liệt, có 209 bệnh nhân 65 tuổi hoặc hơn và 68 bệnh nhân trên 75 tuổi. Trong các bệnh nhân được điều trị docetaxel mỗi 3 tuần, bệnh nhân ≥ 65 tuổi bị biến đổi về móng với tỉ lệ ≥ 10% cao hơn so với nhóm đối tượng trẻ hơn. Bệnh nhân ≥ 75 tuổi bị sốt, tiêu chảy, chán ăn, và bị phù ngoại vi với tỉ lệ ≥ 10% cao hơn so với nhóm < 65 tuổi.Trong 300 bệnh nhân (221 bệnh nhân trong pha III và 79 bệnh nhân trong pha II của nghiên cứu) được điều trị bằng docetaxel phối hợp với cisplatin và 5-fluorouracil trong nghiên cứu ung thư dạ dày, có 74 người ≥ 65 tuổi và 4 người ≥ 75 tuổi. Tỉ lệ mắc các biến cố bất lợi nghiêm trọng trên nhóm các bệnh nhân lớn tuổi cao hơn so với nhóm trẻ tuổi hơn. Tỉ lệ mắc các biến cố bất lợi (ở tất cả các mức độ) như: hôn mê, viêm miệng, giảm bạch cầu trung tính nhiễm khuẩn xảy ra với tỉ lệ ≥ 10% cao hơn trên nhóm bệnh nhân ≥ 65 tuổi so với nhóm trẻ tuổi. Người cao tuổi được điều trị bằng TCF nên được theo dõi chặt chẽ.
Cảnh báo đặc biệt
Dược phẩm này chứa 27% ethanol 96%, chẳng hạn trong 1 mL dung dịch đậm đặc để pha dung dịch tiêm truyền có chứa 275,9 mg ethanol 96% tương đương với 7 mL bia hoặc 3 mL rượu vang.
Thuốc có hại cho những người nghiện rượu.
Cần cân nhắc đối với phụ nữ có thai, người cho con bú, trẻ em và nhóm có nguy cơ cao như bệnh nhân bị bệnh gan hoặc động kinh.
Lượng alcol của thuốc này có thể làm thay đổi tác dụng của các thuốc khác.
Thành phần có chứa ethanol: đã ghi nhận được các báo cáo về ngộ độc liên quan đến một số chế phẩm docetaxel chứa ethanol. Lượng ethanol trong một liều docetaxel có thể gây tác động lên hệ thần kinh trung ương và cần cân nhắc khi kê đơn cho những bệnh nhân: tránh hoặc hạn chế đưa ethanol vào cơ thể. Cân nhắc tác động của ethanol trong chế phẩm docetaxel dạng tiêm tới khả năng lái xe, vận hành máy móc ngay sau khi dùng thuốc.
Ảnh hưởng của thuốc lên khả năng lái xe và vận hành máy móc
Không có nghiên cứu về ảnh hưởng của thuốc lên khả năng lái xe, vận hành máy móc.
Lượng alcol trong thuốc này có thể làm giảm khả năng lái xe hoặc vận hành máy móc (xem mục Cảnh báo).
Quá Liều
Có một vài báo cáo về quá liều. Chưa có thuốc giải độc cho quá liều docetaxel. Trong trường hợp quá liều, bệnh nhân nên được giữ lại trong các đơn vị chuyên khoa và các chức năng sinh tồn nên được giám sát chặt chẽ. Các biến cố bất lợi có thể trầm trọng hơn trong trường hợp quá liều. Các biến chứng chính của quá liều bao gồm suy tủy xương, độc tính thần kinh ngoại biên và viêm niêm mạc. Bệnh nhân nên được điều trị G-CSF sớm nhất có thể sau khi phát hiện quá liều. Các phương pháp điều trị triệu chứng thích hợp nên được áp dụng khi cần thiết.
Chống chỉ định
Mẫn cảm với hoạt chất chính hoặc bất kì thành phần nào của thuốc
DOCETAXEL EBEWE không được sử dụng cho bệnh nhân lúc bắt đầu điều trị đã có số lượng bạch cầu trung tính < 1.500 tế bào/mm3.
DOCETAXEL EBEWE không được sử dụng cho bệnh nhân suy gan nặng vì hiện không có dữ liệu (xem mục Liều lượng và cách dùng và Cảnh báo).
Các chống chỉ định của các thuốc khác cũng được áp dụng khi điều trị phối hợp với docetaxel.
Sử dụng ở phụ nữ có thai và cho con bú
Phụ nữ có thai
Không có thông tin về việc sử dụng docetaxel trên phụ nữ mang thai. Docetaxel gây độc cho cả phôi và thai trên thỏ và chuột, và làm giảm khả năng sinh sản của chuột. Giống như các thuốc gây độc tế bào khác, docetaxel có thể gây hại cho bào thai khi sử dụng cho phụ nữ có thai. Vì vậy, docetaxel không được sử dụng trong khi mang thai trừ khi được chỉ định rõ ràng.
Phụ nữ trong độ tuổi sinh con sử dụng docetaxel nên được khuyên tránh thai và phải thông báo với bác sĩ điều trị ngay lập tức nếu có thai.
Phụ nữ cho con bú
Docetaxel là một chất thân mỡ nhưng hiện vẫn chưa biết liệu nó có được bài tiết trong sữa mẹ hay không. Do có khả năng gặp phải các phản ứng có hại trên trẻ bú mẹ, cần phải ngừng cho trẻ bú sữa mẹ trong suốt thời gian mẹ điều trị bằng docetaxel.
Tránh thai trên nam và nữ
Cần sử dụng một phương pháp tránh thai hiệu quả trong suốt quá trình điều trị.
Khả năng sinh sản
Trong những nghiên cứu tiền lâm sàng, docetaxel gây độc tính trên gen và có thể thay đổi khả năng sinh sản trên nam giới.
Do đó, bệnh nhân nam không được có con trong và 6 tháng sau khi điều trị bằng docetacel và khuyến cáo lưu trữ tinh trùng trước khi bắt đầu điều trị.
Tương tác
Lượng alcol trong thuốc này có thể làm thay đổi tác động của các thuốc khác.
Các nghiên cứu in vitro cho thấy quá trình chuyển hóa của docetaxel có thể bị biến đổi khi sử dụng đồng thời với các thuốc cảm ứng, ức chế hoặc được chuyển hóa bởi cytochrom P450-3A (và vì vậy có thế ức chế cạnh tranh enzym) như cyclosporin, ketoconazol và erythromycin. Do đó, cần thận trọng khi điều trị cho bệnh nhân được chỉ định đồng thời docetaxel với các thuốc này do có khả năng gặp tương tác thuốc đáng kể.
Khi sử dụng đồng thời với các thuốc ức chế CYP3A4, khả năng xuất hiện các tác dụng không mong muốn của docetaxel có thể tăng lên do chuyển hóa thuốc bị giảm. Nếu việc sử dụng đồng thời với các thuốc ức chế mạnh CYP3A4 (như ketoconazol, itraconazol, clarithromycin, indinavir, nefazodon, nelfinavir, ritonavir, saquinavir, telithromycin và voriconazol) không thể tránh khỏi, cần theo dõi lâm sàng một cách thận trọng và điều chỉnh liều docetaxel thích hợp khi dùng đồng thời với các thuốc ức chế mạnh CYP3A4 (xem mục Cảnh báo).
Trong một nghiên cứu dược động học trên 7 bệnh nhân, dùng đồng thời docetaxel với thuốc ức chế mạnh CYP3A4 là ketoconazol làm giảm đáng kể độ thanh thải docetaxel đến 49%.
Dược động học của docetaxel khi có prednison đã được nghiên cứu trên các bệnh nhân bị ung thư tuyến tiền liệt di căn. Docetaxel được chuyển hóa bởi CYP3A4 và prednison được biết đến là thuốc cảm ứng CYP3A4. Không quan sát thấy ảnh hưởng có ý nghĩa thống kê của prednison trên dược động học của docetaxel.
Docetaxel gắn kết cao với protein (> 95%). Mặc dù khả năng tương tác in vivo của docetaxel với các thuốc sử dụng đồng thời vẫn chưa được nghiên cứu chính thức, các tương tác in vitro với các thuốc gắn kết chặt với protein như erythromycin, diphenhydramin, propranolol, propafenon, phenytoin, salicylat, sulfamethoxazon và natri valproat không ảnh hưởng đến khả năng gắn kết protein của docetaxel. Hơn nữa, dexamethason không ảnh hưởng đến gắn kết với protein của docetaxel. Docetaxel không ảnh hưởng đến gắn kết của digitoxin.
Dược động học của docetaxel, doxorubicin và cyclophosphamid không bị ảnh hưởng khi chúng được dùng phối hợp với nhau. Dữ liệu hạn chế từ một nghiên cứu đơn lẻ không đối chứng đã gợi ý về tương tác giữa docetaxel và carboplatin. Khi phối hợp với docetaxel, độ thanh thải của carboplatin cao hơn 50% so với giá trị được báo cáo trước đó trong đơn trị bằng carboplatin.
Tương kỵ
Dược phẩm này không được trộn với các dược phẩm khác ngoại trừ được đề cập trong mục Một số lưu ý đặc biệt về xử lý thuốc trước và sau khi sử dụng thuốc.
Tác dụng ngoại ý
Tóm tắt dữ liệu về độ an toàn cho tất cả các chỉ định
Các phản ứng bất lợi có thể xảy ra hoặc có thể có liên quan tới việc điều trị bằng docetaxel đã được thu thập trên:
• 1.312 và 121 bệnh nhân sử dụng tương ứng docetaxel đơn trị 100 mg/m2 và 75 mg/m2.
• 258 bệnh nhân điều trị với docetaxel phối hợp doxorubicin.
• 406 bệnh nhân điều trị với docetaxel phối hợp cisplatin.
• 92 bệnh nhân điều trị với docetaxel phối hợp trastuzumab.
• 255 bệnh nhân điều trị với docetaxel phối hợp capecitabin.
• 332 bệnh nhân điều trị với docetaxel phối hợp prednison hoặc prednisolon (các phản ứng bất lợi quan trọng liên quan đến điều trị trên lâm sàng đã được báo cáo).
• 1.276 bệnh nhân (744 và 532 tương ứng với TAX 316 và GEICAM 9805) được điều trị bằng docetaxel kết hợp với doxorubicin và cyclophosphamid (các biến cố bất lợi quan trọng liên quan điều trị trên lâm sàng đã được báo cáo).
• 300 bệnh nhân bị ung thư dạ dày (221 bệnh nhân trong pha III và 79 bệnh nhân trong pha II của nghiên cứu) được điều trị bằng docetaxel phối hợp với cisplatin và 5-fluorouracil (các biến cố bất lợi quan trọng liên quan đến điều trị trên lâm sàng đã được báo cáo).
• 174 và 251 bệnh nhân bị ung thư vùng đầu-cổ được điều trị bằng docetaxel phối hợp với cisplatin và 5-fluorouracil (các biến cố bất lợi quan trọng liên quan đến điều trị trên lâm sàng đã được báo cáo).
Các phản ứng được mô tả dựa trên các Tiêu chuẩn về Độc tính chung NCI (NCI Common Toxicity Criteria) (độ 3 = G3, độ 3-4 = G3/4, độ 4 = G4), thuật ngữ COSTART và MedDRA. Các tần suất được định nghĩa như sau: rất thường gặp (≥ 1/10), thường gặp (≥ 1/100), < 1/10), ít gặp (≥ 1/1.000, < 1/100), hiếm gặp (> 1/10.000, < 1/1.000), rất hiếm gặp (< 1/10.000), chưa biết (không thể đánh giá dựa trên dữ liệu hiện có).
Trong mỗi nhóm tần suất, các tác dụng không mong muốn được trình bày theo mức độ nặng giảm dần.
Các tác dụng không mong muốn phổ biến nhất của docatexel dùng đơn trị đã được báo cáo là: giảm bạch cầu trung tính (có thể hồi phục và không tích lũy, khoảng thời gian trung vị đến lúc lượng bạch cầu trung tính ở mức thấp nhất là 7 ngày và khoảng thời gian trung vị của giảm bạch cầu trung tính nặng (< 500 tế bào/mm3) là 7 ngày), thiếu máu, rụng tóc, buồn nôn, nôn, viêm miệng, tiêu chảy và suy nhược. Mức độ nặng các biến cố bất lợi của docetaxel có thể tăng khi docetaxel được dùng phối hợp với các thuốc hóa trị khác.
Trong phối hợp với trastuzumab, các phản ứng bất lợi (tất cả các mức độ) ≥ 10% số bệnh nhân đã được trình bày. Có sự gia tăng tỉ lệ mắc các phản ứng bất lợi nghiêm trọng (40% so với 31%) và các phản ứng bất lợi độ 4 (34% so với 23%) trong nhóm điều trị phối hợp với trastuzumab so với docetaxel đơn trị.
Trong phối hợp với capecitabin, các tác dụng không mong muốn thường gặp nhất có liên quan đến điều trị (≥ 5%) báo cáo trong thử nghiệm pha III trên bệnh nhân bị ung thư vú thất bại với điều trị bằng anthracyclin đã được báo cáo (xem tóm tắt đặc tính sản phẩm của capecitabin).
Thường thấy các phản ứng bất lợi sau đây của docetaxel:
Rối loạn hệ thống miễn dịch
Các phản ứng quá mẫn thường xảy ra trong vòng một vài phút sau khi bắt đầu tiêm truyền docetaxel và thường từ mức độ nhẹ đến trung bình. Các triệu chứng được báo cáo phổ biến nhất là cơn nóng bừng, phát ban kèm hoặc không kèm ngứa, nặng ngực, đau lưng, khó thở và sốt hoặc rét run. Các phản ứng nặng được mô tả như hạ huyết áp và/hoặc co thắt phế quản hoặc phát ban/hồng ban toàn thân (xem mục Cảnh báo).
Rối loạn hệ thần kinh
Cần phải giảm liều khi thấy xuất hiện các độc tính thần kinh ngoại biên nặng (xem mục Liều lượng và cách dùng và Cảnh báo). Các triệu chứng thần kinh cảm giác từ nhẹ đến trung bình được đặc trưng như là dị cảm, loạn cảm hoặc đau bao gồm rát bỏng. Các biến cố trên thần kinh vận động được đặc trưng là yếu cơ.
Rối loạn da và mô dưới da
Đã quan sát thấy các phản ứng da có thể phục hồi và nhìn chung mức độ từ nhẹ đến trung bình. Các phản ứng được đặc trưng như ban da bao gồm bóng nước khu trú chủ yếu ở bàn chân và bàn tay (bao gồm hội chứng bàn chân và bàn tay nặng) nhưng cũng có trên cánh tay, mặt hoặc ngực và thường kèm với ngứa. Nhìn chung, bóng nước thường xảy ra trong vòng 1 tuần sau khi tiêm truyền docetaxel. Ít gặp hơn, các triệu chứng nặng như bóng nước theo sau bởi tróc vảy hiếm khi làm gián đoạn hoặc ngừng điều trị bằng docetaxel đã được báo cáo (xem mục Liều lượng và cách dùng và Cảnh báo). Các rối loạn móng nặng được đặc trưng bởi giảm hoặc tăng sắc tố, đôi khi bị đau và bong móng.
Các rối loạn toàn thân và tại vị dùng thuốc
Các phản ứng tại vị trí tiêm truyền thường nhẹ và bao gồm tăng sắc tố, viêm, đỏ hoặc khô da, viêm tắc tĩnh mạch hoặc thoát mạch và sưng phù tĩnh mạch.
Ứ dịch bao gồm các hiện tượng như phù ngoại biên, ít phổ biến hơn là tràn dịch màng phổi, tràn dịch màng tim, cổ trướng và tăng cân. Phù ngoại biên thường bắt đầu ở chi dưới và có thể trở thành phù toàn thân với tăng cân đến 3 kg hoặc hơn. Sự ứ dịch có tích lũy về mức độ nặng và tỉ lệ mắc bệnh (xem mục Cảnh báo).
- xem Bảng 10.
Mô tả các phản ứng bất lợi được chọn lọc trong điều trị ung thư vú bằng DOCETAXEL 100 mg/m2 đơn trị
Rối loạn máu và hệ bạch huyết
Hiếm gặp: các đợt chảy máu có liên quan đến giảm tiểu cầu mức độ 3/4.
Các rối loạn hệ thống thần kinh
Các dữ liệu về khả năng hồi phục đã được ghi nhận trên 35,3% bệnh nhân có xuất hiện độc tính thần kinh sau khi điều trị bằng docetaxel liều 100mg/m2 đơn trị. Các biến cố này có thể tự hồi phục trong khoảng 3 tháng.
Các rối loạn da và mô dưới da
Rất hiếm gặp: một trường hợp bị rụng tóc không phục hồi được khi kết thúc nghiên cứu. 73% các phản ứng da có thể phục hồi trong khoảng 21 ngày.
Các rối loạn toàn thân và tại vị trí dùng thuốc
Mức liều tích lũy trung vị phải ngừng điều trị là trên 1.000mg/m2 và thời gian trung vị để phục hồi hiện tượng ứ dịch là 16,4 tuần (dao động từ 0 đến 42 tuần). Khởi phát của ứ dịch trung bình và nặng bị chậm lại (liều tích lũy trung vị là 818,9mg/m2) trên nhóm bệnh nhân được dùng thuốc chuẩn bị so với nhóm bệnh nhân không dùng thuốc chuẩn bị trước (mức liều tích lũy trung vị 489,7mg/m2); tuy nhiên trên một số bệnh nhân, hiện tượng này xuất hiện trong những đợt đầu của tiến trình điều trị.
- xem Bảng 11, Bảng 12, Bảng 13, Bảng 14.
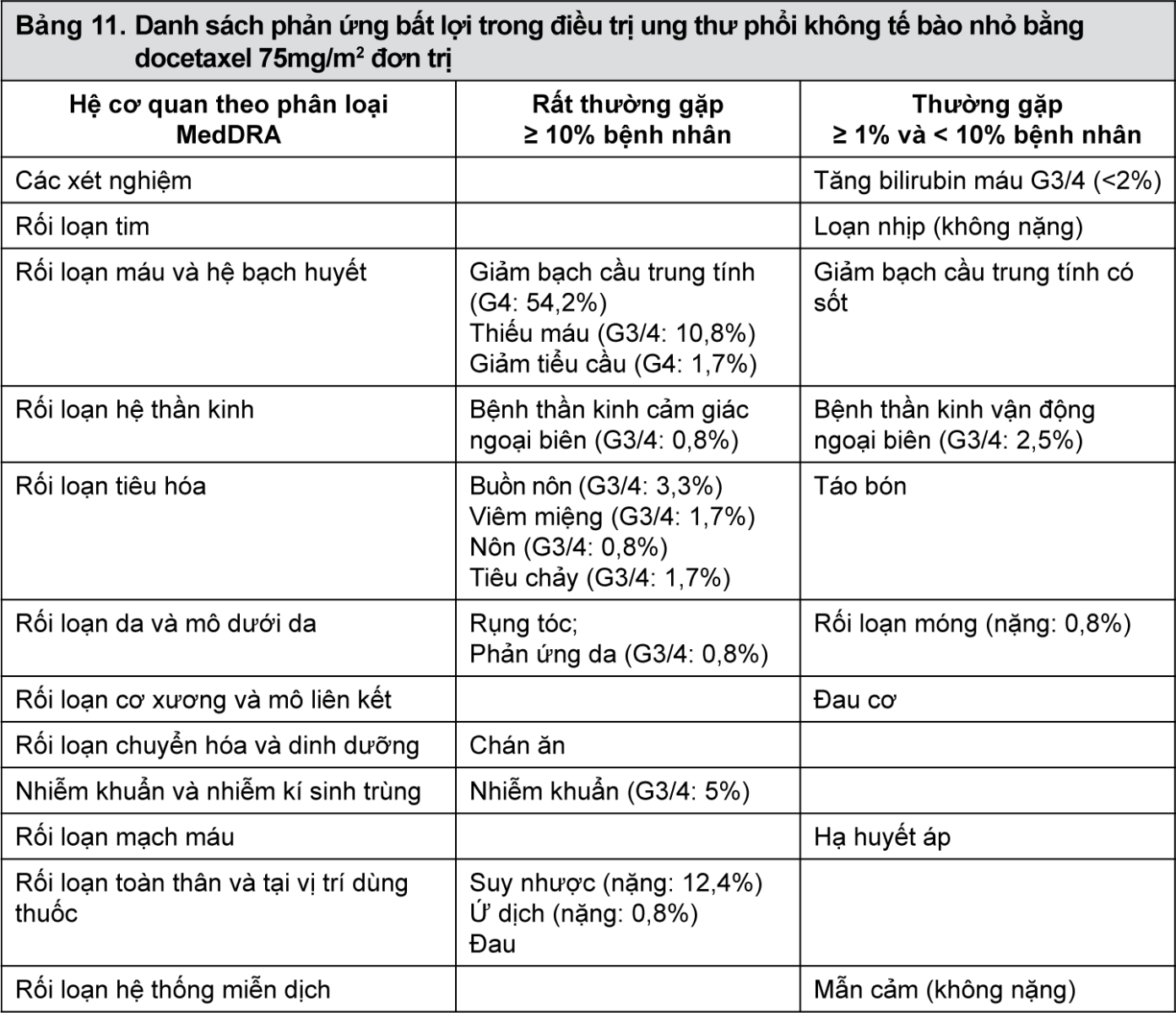
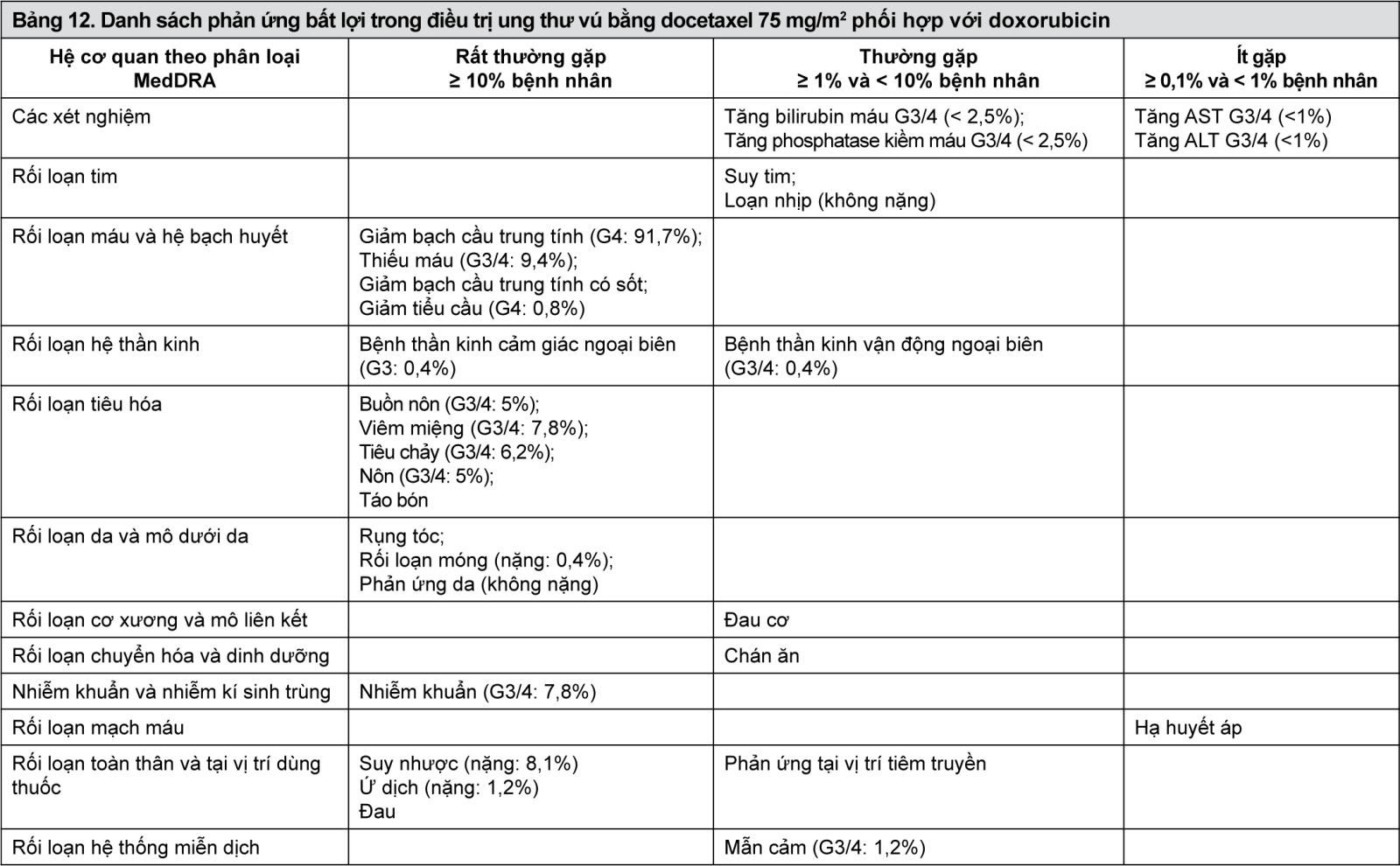
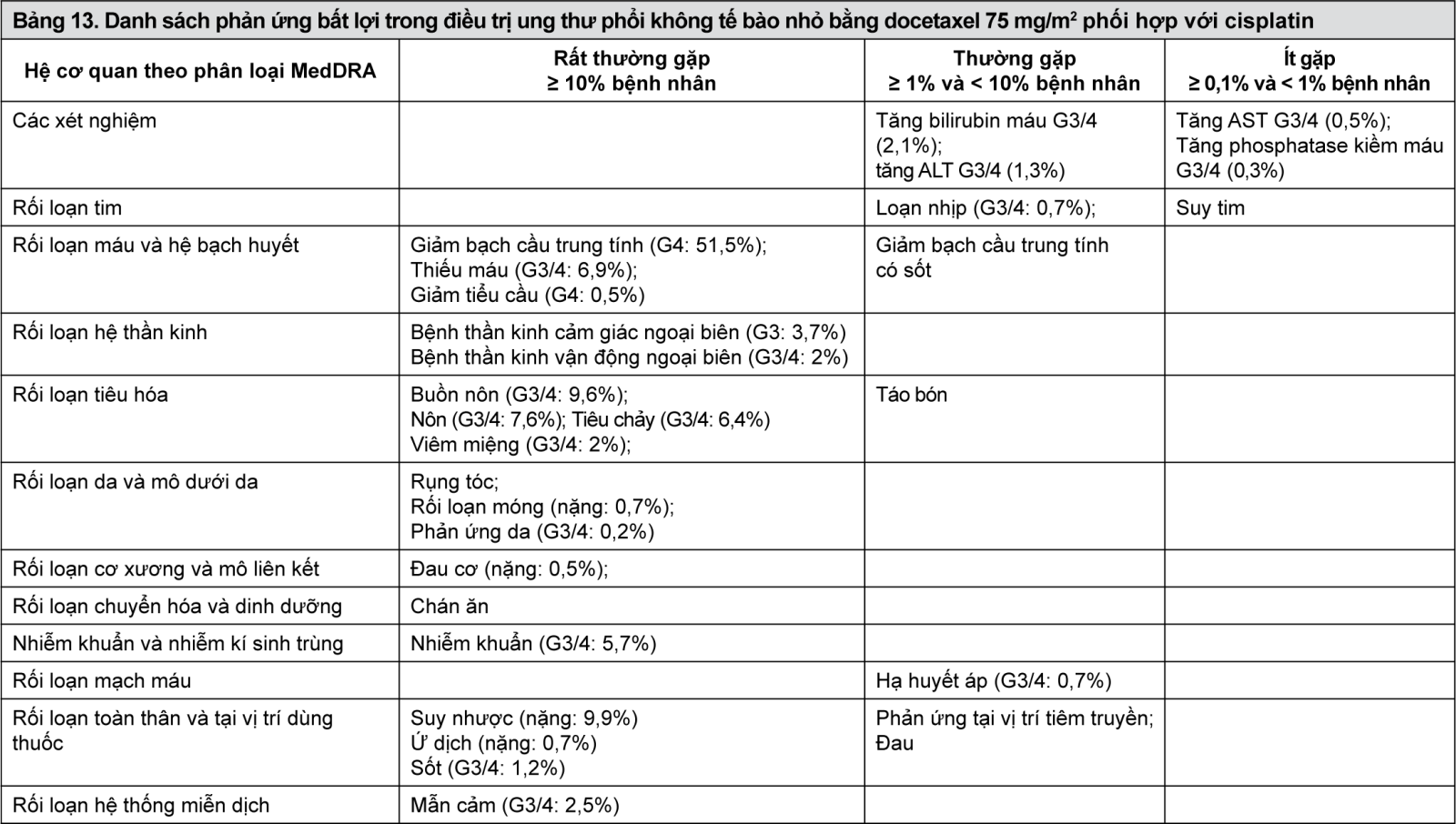
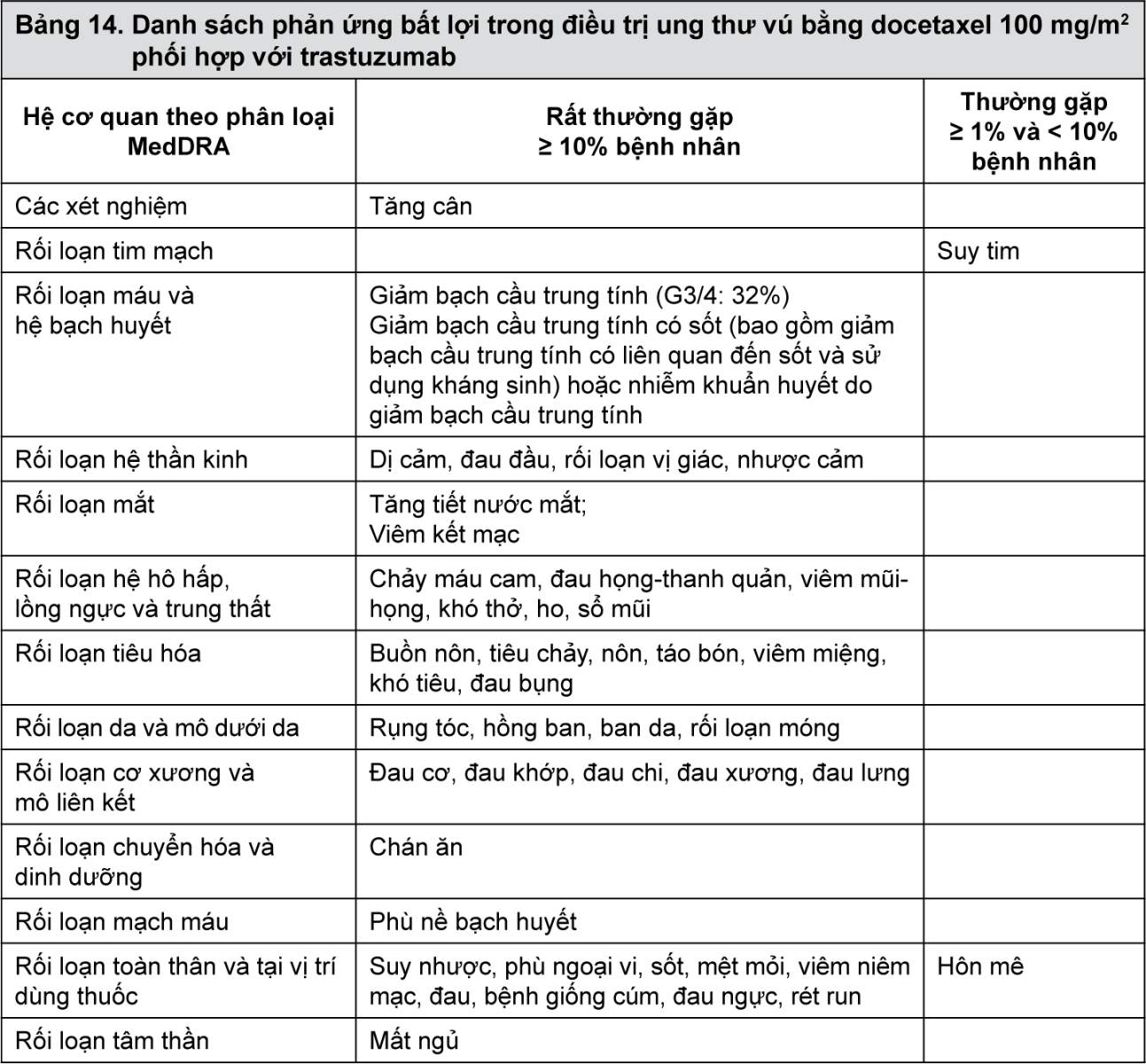
Mô tả các phản ứng bất lợi được chọn lọc trong điều trị ung thư vú bằng docetaxel 100 mg/m2 phối hợp với trastuzumab
Rối loạn máu và hệ bạch huyết
Rất thường gặp: Độc tính trên huyết học tăng trên những bệnh nhân điều trị bằng trastuzumab và docetaxel, so với docetaxel đơn trị (32% giảm bạch cầu trung tính độ 3/4 so với 22%, sử dụng tiêu chuẩn NCI-CTC). Lưu ý rằng số liệu này có thể được ước tính thấp do docetaxel đơn trị liều 100 mg/m2 được biết là gây giảm bạch cầu trung tính trên 97% bệnh nhân, 76% mức độ 4, dựa trên mức thấp nhất của số lượng tế bào máu. Tỉ lệ giảm bạch cầu trung tính có sốt/nhiễm khuẩn huyết do giảm bạch cầu trung tính cũng tăng trên nhóm bệnh nhân điều trị Herceptin và docetaxel (23% so với 17% bệnh nhân dùng docetaxel đơn trị).
Rối loạn tim
Suy tim có triệu chứng được báo cáo trên 2,2% bệnh nhân được điều trị phối hợp docetaxel và trastuzumab so với 0% bệnh nhân được điều trị bằng docetaxel đơn trị. Trong liệu trình điều trị docetaxel phối hợp với trastuzumab, 64% bệnh nhân đã được điều trị với một anthracyclin như liệu pháp bổ trợ so với 55% trong nhóm docetaxel đơn trị.
- xem Bảng 15, Bảng 16, Bảng 17.
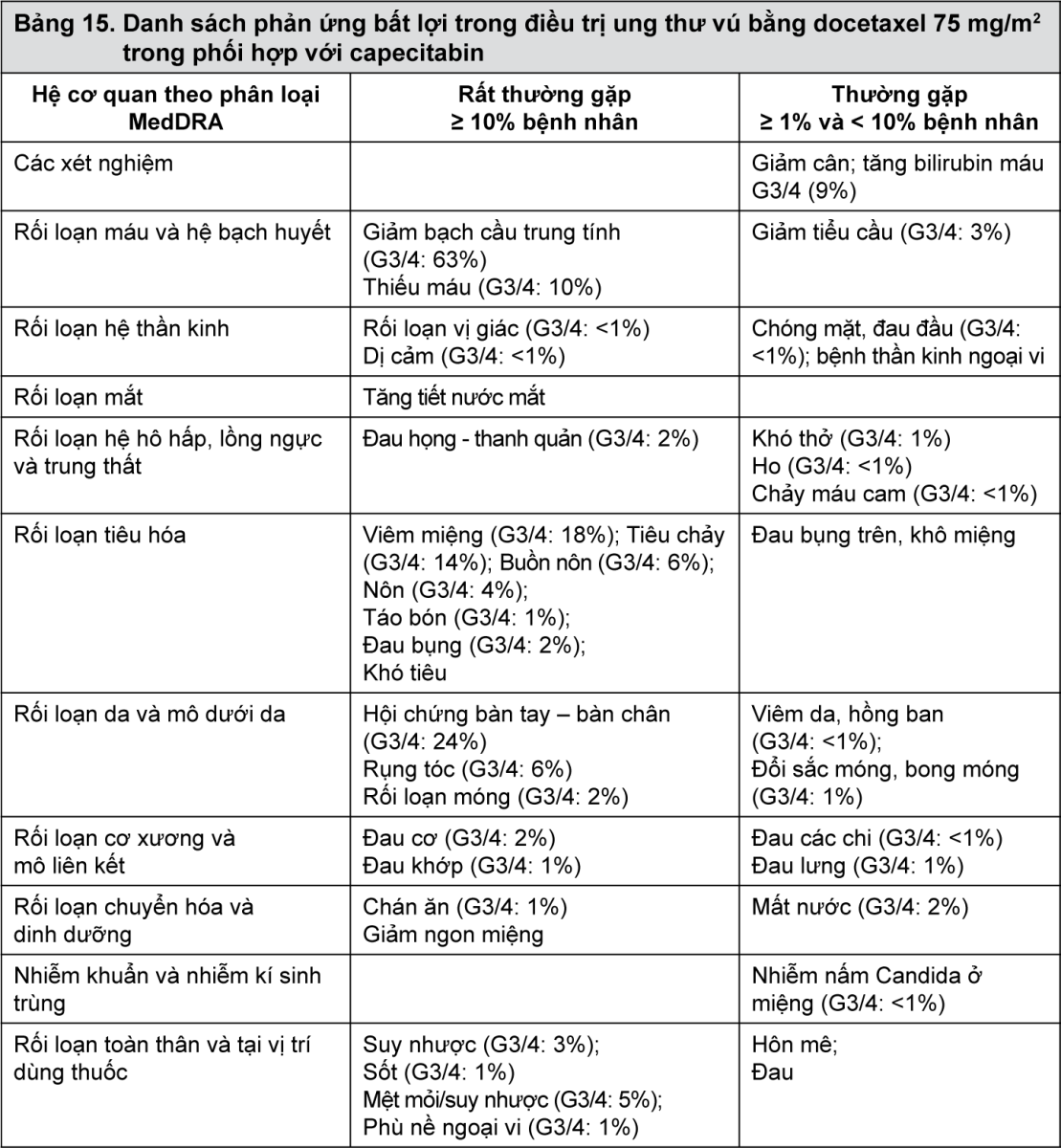
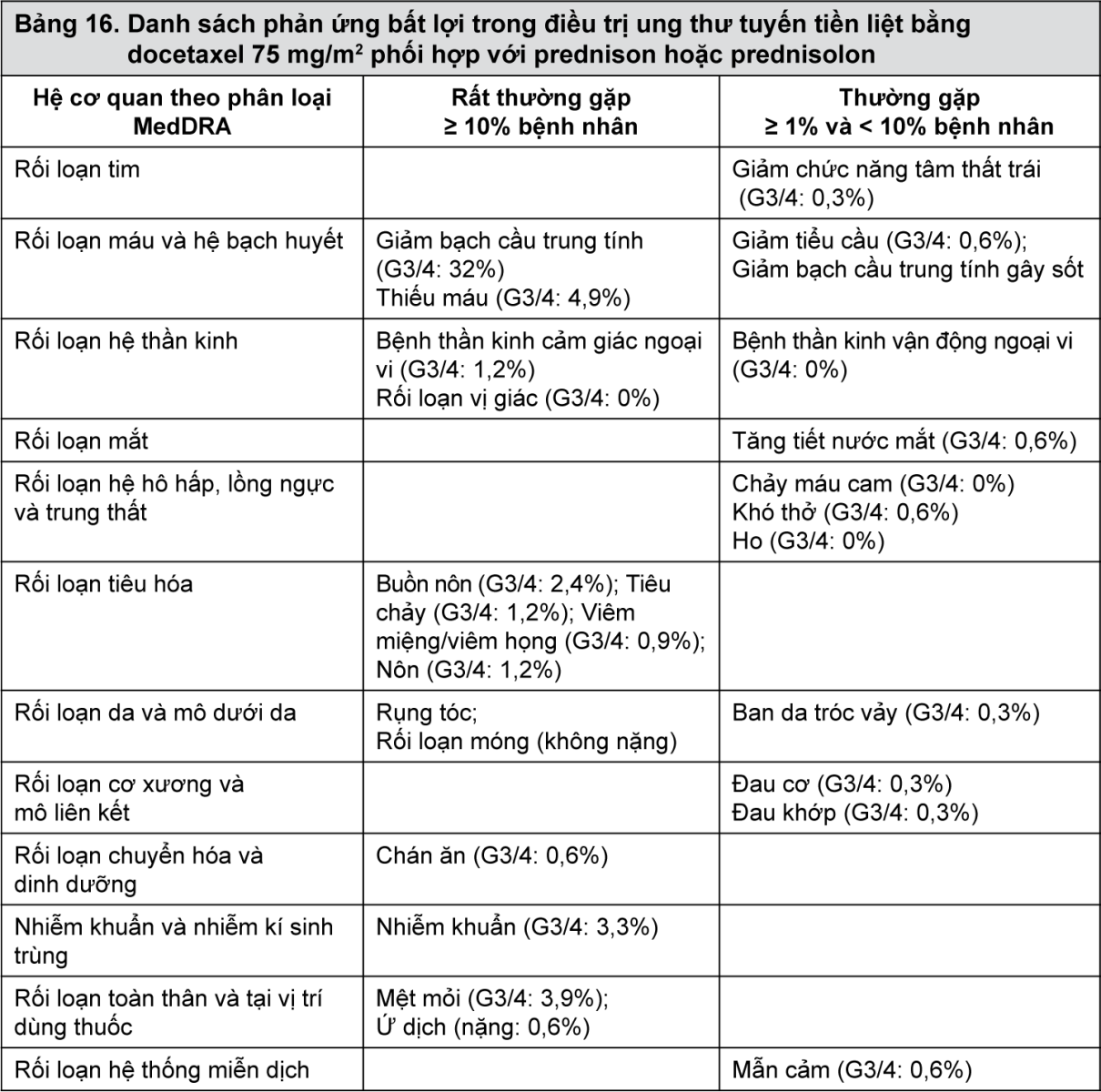
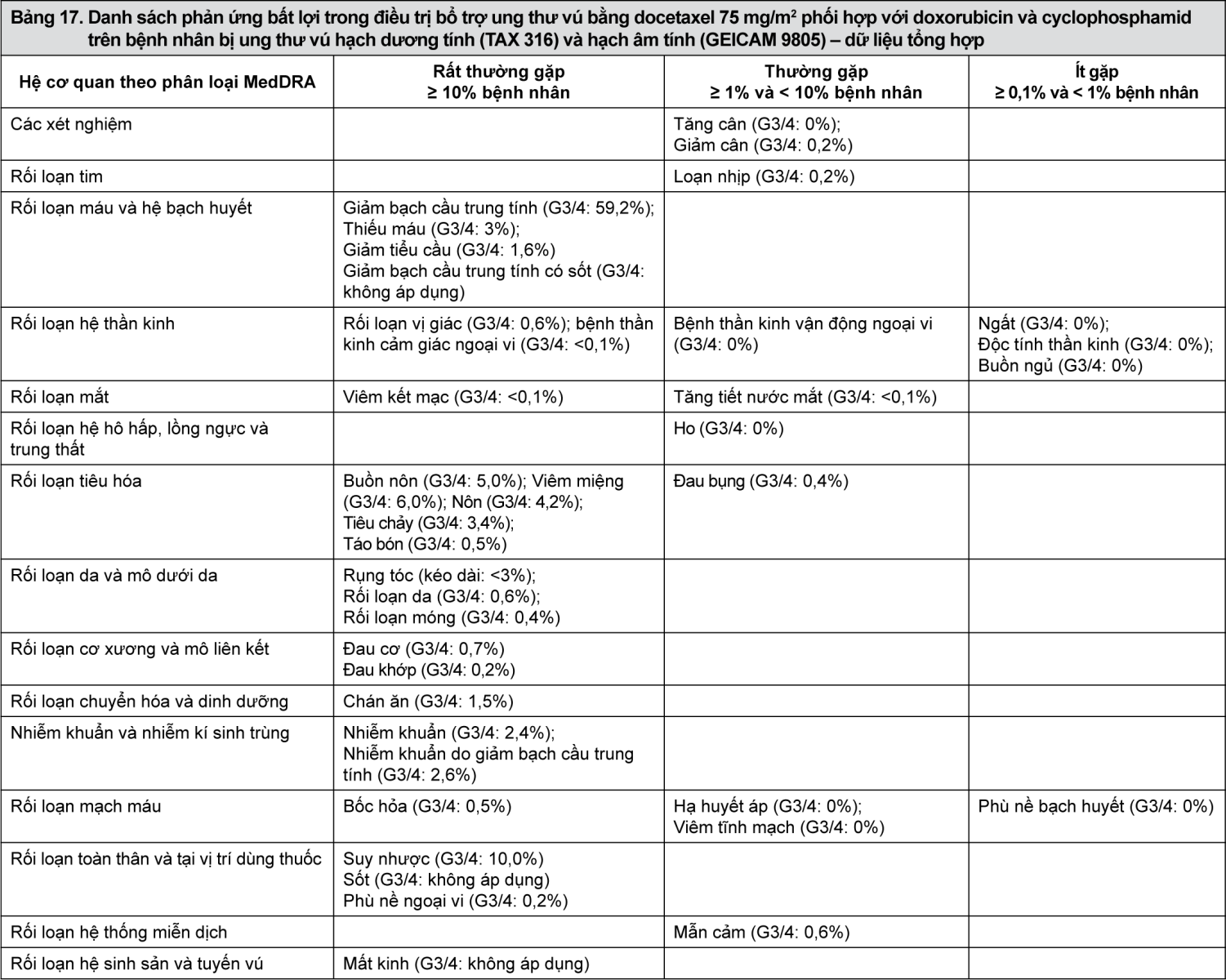
Mô tả các phản ứng bất lợi được chọn lọc trong điều trị bổ trợ bằng docetaxel 75 mg/m2 phối hợp với doxorubicin và cyclophosphamid trên bệnh nhân bị ung thư vú hạch dương tính (TAX 316) và hạch âm tính (GEICAM 9805)
Rối loạn hệ thần kinh
Trong nghiên cứu TAX316 bệnh thần kinh cảm giác ngoại vi bắt đầu trong giai đoạn điều trị và tiếp tục trong thời gian theo dõi trên 84 bệnh nhân (11,3%) dùng phác đồ TAC và 15 bệnh nhân (2%) dùng phác đồ FAC. Vào cuối giai đoạn theo dõi (thời gian theo dõi trung vị 8 năm), bệnh thần kinh cảm giác ngoại vi được quan sát thấy vẫn tiếp diễn trên 10 bệnh nhân (1,3%) dùng phác đồ TAC và 2 bệnh nhân (0,3%) dùng phác đồ FAC.
Trong nghiên cứu GEICAM 9805 bệnh thần kinh cảm giác ngoại vi bắt đầu trong giai đoạn điều trị và tiếp tục trong thời gian theo dõi trên 10 bệnh nhân (1,9%) dùng phác đồ TAC và 4 bệnh nhân (0,8%) dùng phác đồ FAC. Vào cuối giai đoạn theo dõi (thời gian theo dõi trung vị 10 năm và 5 tháng), bệnh thần kinh cảm giác ngoại vi được quan sát thấy vẫn tiếp diễn trên 3 bệnh nhân (0,6%) dùng phác đồ TAC và 1 bệnh nhân (0,2%) dùng phác đồ FAC.
Rối loạn về tim
Trong nghiên cứu TAX316, 26 bệnh nhân (3,5%) dùng phác đồ TAC và 17 bệnh nhân (2,3%) dùng phác đồ FAC bị suy tim xung huyết (CHF). Ngoại trừ 1 bệnh nhân trên mỗi nhóm, tất cả bệnh nhân được chẩn đoán bị CHF trên 30 ngày sau giai đoạn điều trị. 2 bệnh nhân trên nhóm dùng TAC và 4 bệnh nhân trên nhóm dùng FAC bị tử vong do suy tim.
Trong nghiên cứu GEICAM 9805, 3 bệnh nhân (0,6%) dùng phác đồ TAC và 3 bệnh nhân (0,6%) dùng phác đồ FAC bị tiến triển suy tim sung huyết trong giai đoạn theo dõi. Vào cuối giai đoạn theo dõi (thời gian theo dõi trung vị thực tế 10 năm và 5 tháng), không có bệnh nhân nào bị CHF trên nhóm dùng TAC và 1 bệnh nhân trên nhóm dùng FAC bị tử vong do bệnh cơ tim giãn nở, và CHF được quan sát thấy vẫn tiếp diễn trên 1 bệnh nhân (0,2%) dùng FAC.
Rối loạn da và mô dưới da
Trong nghiên cứu TAX316, chứng rụng tóc tiếp tục trong thời gian theo dõi sau khi kết thúc hóa trị đã được báo cáo trên 687 trong 744 bệnh nhân nhóm TAC (92,3%) và 645 trong 736 bệnh nhân nhóm FAC (87,6%).
Vào cuối giai đoạn theo dõi (thời gian theo dõi trung vị thực tế 8 năm), chứng rụng tóc được quan sát thấy vẫn tiếp diễn trên 29 bệnh nhân nhóm TAC (3,9%) và 16 bệnh nhân nhóm FAC (2,2%).
Trong nghiên cứu GEICAM 9805 chứng rụng tóc bắt đầu trong giai đoạn điều trị và tiếp tục trong thời gian theo dõi được quan sát thấy vẫn tiếp diễn trên 49 bệnh nhân (9,2%) trong nhóm TAC và 35 bệnh nhân (6,7%) trong nhóm FAC. Chứng rụng tóc liên quan đến thuốc nghiên cứu bắt đầu hoặc nặng hơn trong thời gian theo dõi trên 42 bệnh nhân (7,9%) trong nhóm TAC và 30 bệnh nhân (5,8%) trong nhóm FAC. Vào cuối giai đoạn theo dõi (thời gian theo dõi trung vị 10 năm và 5 tháng), chứng rụng tóc được quan sát thấy vẫn tiếp diễn trên 3 bệnh nhân (0,6%) trong nhóm TAC và 1 bệnh nhân (0,2%) trong nhóm FAC.
Rối loạn hệ sinh sản và tuyến vú
Trong nghiên cứu TAX316 hiện tượng vô kinh bắt đầu trong giai đoạn điều trị và tiếp tục trong thời gian theo dõi sau khi kết thúc hóa trị đã được báo cáo trên 202 trong 744 bệnh nhân nhóm TAC (27,2%) và 125 trong 736 bệnh nhân nhóm FAC (17,0%). Hiện tượng vô kinh được quan sát thấy vẫn tiếp diễn vào cuối thời gian theo dõi (thời gian theo dõi trung vị 8 năm) trên 121 trong 744 bệnh nhân nhóm TAC (16,3%) và 86 bệnh nhân nhóm FAC (11,7%). Trong nghiên cứu GEICAM 9805 hiện tượng vô kinh bắt đầu trong giai đoạn điều trị và tiếp tục trong thời gian theo dõi được quan sát thấy vẫn tiếp diễn trên 18 bệnh nhân (3,4%) trong nhóm TAC và 5 bệnh nhân (1,0%) trong nhóm FAC. Vào cuối giai đoạn theo dõi (thời gian theo dõi trung vị 10 năm và 5 tháng), hiện tượng vô kinh được quan sát thấy vẫn tiếp diễn trên 7 bệnh nhân (1,3%) trong nhóm TAC và 4 bệnh nhân (0,8%) trong nhóm FAC.
Rối loạn toàn thân và tại vị trí dùng thuốc
Trong nghiên cứu TAX316 phù ngoại vi bắt đầu trong giai đoạn điều trị và tiếp tục trong thời gian theo dõi sau khi kết thúc hóa trị được quan sát thấy trên 119 trong 744 bệnh nhân nhóm TAC (16,0%) và 23 trong 736 bệnh nhân nhóm FAC (3,1%). Vào cuối giai đoạn theo dõi (thời gian theo dõi trung vị thực tế 8 năm), phù ngoại vi vẫn tiếp tục trên 19 bệnh nhân nhóm TAC (2,6%) và 4 bệnh nhân nhóm FAC (0,5%).
Trong nghiên cứu TAX316 phù nề bạch huyết bắt đầu trong giai đoạn điều trị và tiếp tục trong thời gian theo dõi sau khi kết thúc hóa trị được báo cáo trên 11 trong 744 bệnh nhân nhóm TAC (1,5%) và 1 trong 736 bệnh nhân nhóm FAC (0,1%). Vào cuối giai đoạn theo dõi (thời gian theo dõi trung vị thực tế 8 năm), phù nề bạch huyết được quan sát thấy vẫn tiếp diễn trên 6 bệnh nhân nhóm TAC (0,8%) và 1 bệnh nhân nhóm FAC (0,1%). Trong nghiên cứu TAX316 suy nhược bắt đầu trong giai đoạn điều trị và tiếp tục trong thời gian theo dõi sau khi kết thúc hóa trị được báo cáo trên 236 trong 744 bệnh nhân nhóm TAC (31,7%) và 180 trong 736 bệnh nhân nhóm FAC (24,5%). Vào cuối giai đoạn theo dõi (thời gian theo dõi trung vị thực tế 8 năm), suy nhược được quan sát thấy vẫn tiếp diễn trên 29 bệnh nhân nhóm TAC (3,9%) và 16 bệnh nhân nhóm FAC (2,2%).
Trong nghiên cứu GEICAM 9805 phù ngoại vi bắt đầu trong giai đoạn điều trị vẫn tiếp tục trong thời gian theo dõi trên 4 bệnh nhân (0,8%) nhóm TAC và 2 bệnh nhân (0,4%) nhóm FAC. Vào cuối giai đoạn theo dõi (thời gian theo dõi trung vị 10 năm và 5 tháng), không có bệnh nhân nào trong nhóm TAC (0%) và 1 bệnh nhân (0,2%) trong nhóm FAC vẫn tiếp tục bị phù ngoại vi. Phù nề bạch huyết bắt đầu trong giai đoạn điều trị vẫn tiếp tục trong thời gian theo dõi trên 5 bệnh nhân (0,9%) trong nhóm TAC và 2 bệnh nhân (0,4%) trong nhóm FAC. Vào cuối giai đoạn theo dõi, phù nề bạch huyết được quan sát thấy vẫn tiếp tục trên 4 bệnh nhân (0,8%) trong nhóm TAC và 1 bệnh nhân (0,2%) trong nhóm FAC. Suy nhược bắt đầu trong giai đoạn điều trị và tiếp tục trong thời gian theo dõi được quan sát thấy trên 12 bệnh nhân (2,3%) trong nhóm TAC và 4 bệnh nhân (0,8%) trong nhóm FAC. Vào cuối giai đoạn theo dõi, suy nhược được quan sát thấy vẫn tiếp tục trên 2 bệnh nhân (0,4%) trong nhóm TAC và 2 bệnh nhân (0,4%) trong nhóm FAC.
Bệnh bạch cầu cấp/ hội chứng loạn sản tủy
Sau 10 năm theo dõi trong nghiên cứu TAX316, bệnh bạch cầu cấp được báo cáo trên 3 trong 744 bệnh nhân nhóm TAC (0,4%) và 1 trong 736 bệnh nhân nhóm FAC (0,1%). 1 bệnh nhân nhóm TAC (0,1%) và 1 bệnh nhân nhóm FAC (0,1%) bị tử vong do bệnh bạch cầu dòng tủy cấp trong thời gian theo dõi (thời gian theo dõi trung vị 8 năm). Hội chứng loạn sản tủy được báo cáo trên 2 trong 744 bệnh nhân nhóm TAC (0,3%) và 1 trong 736 bệnh nhân nhóm FAC (0,1%).
Sau 10 năm theo dõi trong nghiên cứu GEICAM 9805, bệnh bạch cầu cấp đã xuất hiện trên 1 trong 532 bệnh nhân (0,2%) trong nhóm TAC. Không có trường hợp nào được báo cáo trong nhóm FAC. Không có bệnh nhân nào bị chẩn đoán mắc hội chứng loạn sản tủy trong cả 2 nhóm điều trị.
Các biến chứng bạch cầu
Bảng 18 cho thấy tỉ lệ giảm bạch cầu trung tính độ 4, giảm bạch cầu trung tính có sốt và nhiễm khuẩn do giảm bạch cầu trung tính đã giảm trên bệnh nhân dự phòng nguyên phát bằng G-CSF sau đó dự phòng nguyên phát bằng G-CSF được yêu cầu bắt buộc khi dùng phác đồ TAC – nghiên cứu GEICAM.
- xem Bảng 18, Bảng 19.

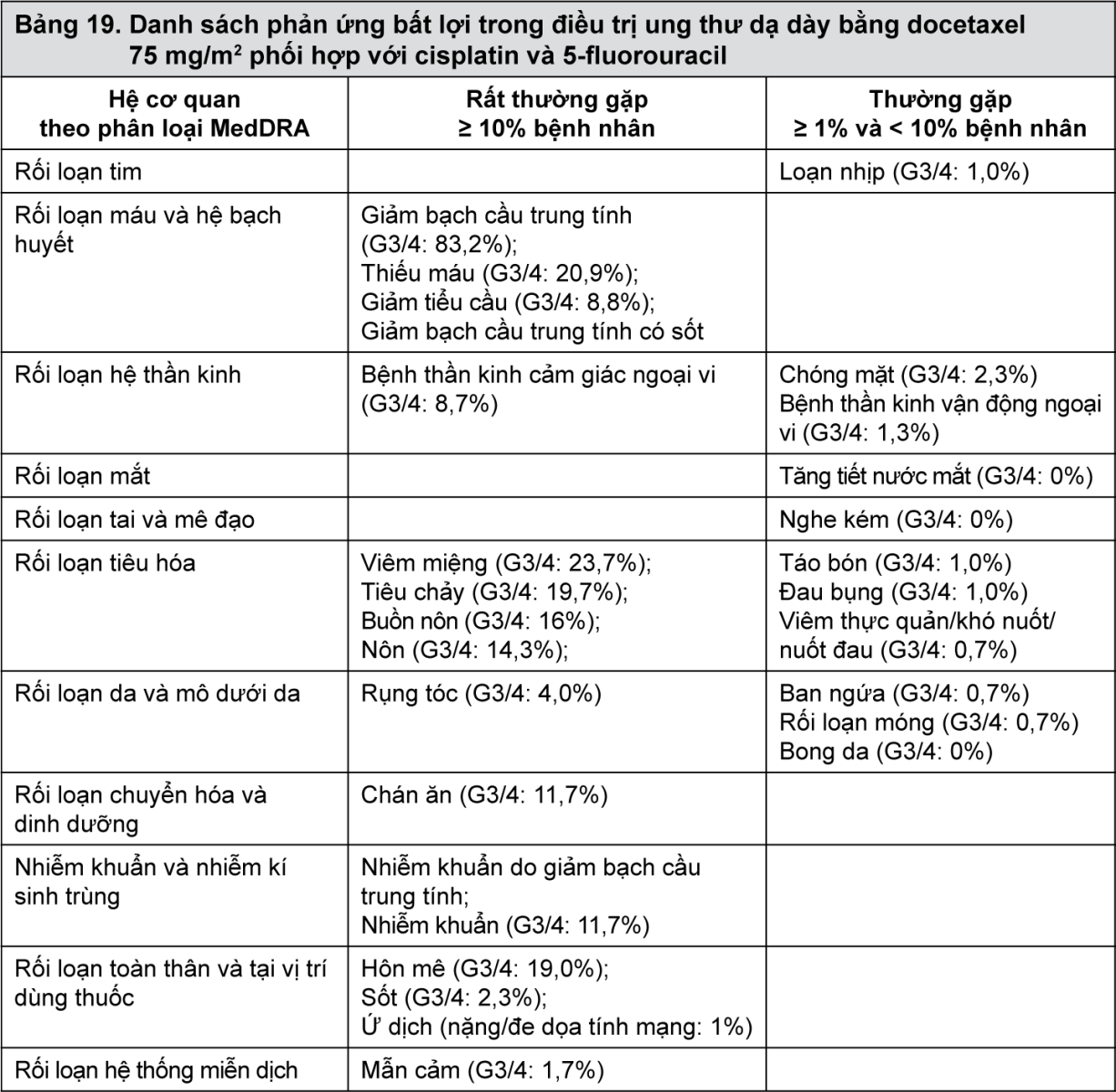
Mô tả các phản ứng bất lợi được chọn lọc trong điều trị ung thư dạ dày bằng docetaxel 75 mg/m2 phối hợp với cisplatin và 5-fluorouracil
Rối loạn máu và hệ bạch huyết
Giảm bạch cầu trung tính có sốt xảy ra trên 17,2% và nhiễm khuẩn do giảm bạch cầu trung tính xảy ra trên 13,5% bệnh nhân, bất kể có sử dụng G-CSF hay không. G-CSF được chỉ định cho dự phòng thứ phát trên 19,3% bệnh nhân (10,7% của các chu kỳ điều trị). Giảm bạch cầu trung tính có sốt và nhiễm khuẩn do giảm bạch cầu trung tính xảy ra tương ứng trên 12,1% và 3,4% bệnh nhân khi sử dụng G-CSF dự phòng, trên 15,6% và 12,9% bệnh nhân không sử dụng G-CSF dự phòng (xem mục Liều lượng và cách dùng).
- xem Bảng 20, Bảng 21.
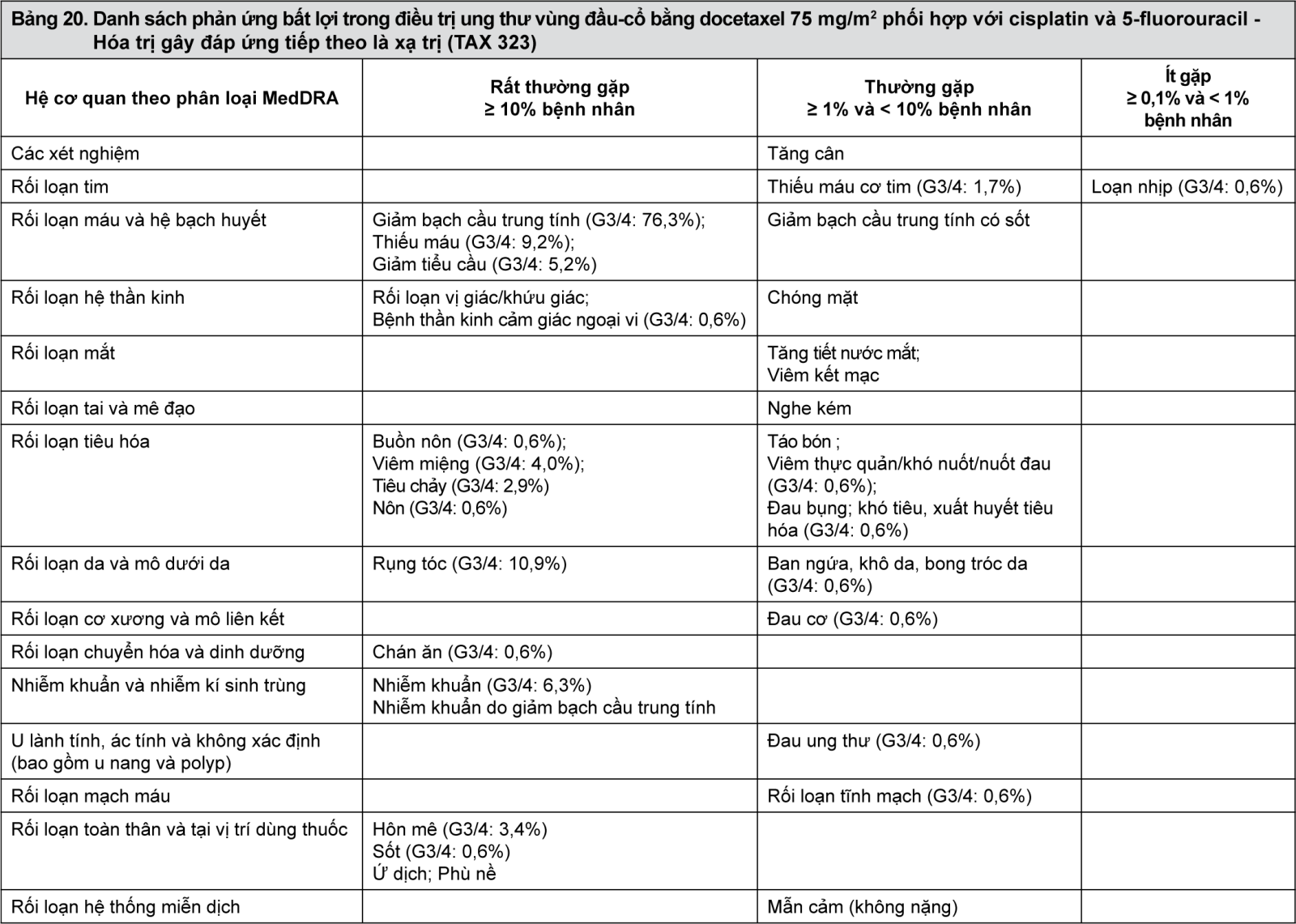

Kinh nghiệm sau khi thuốc lưu hành
U lành tính, ác tính và không xác định (bao gồm u nang và polyp)
Các trường hợp ung thư bạch cầu dòng tủy cấp tính và hội chứng loạn sản tủy đã được báo cáo liên quan tới docetaxel khi điều trị phối hợp với các thuốc hóa trị và/hoặc xạ trị.
Rối loạn máu và hệ bạch huyết
Ức chế tủy xương và các phản ứng bất lợi về máu khác đã được báo cáo. Hiện tượng đông máu nội mạch lan tỏa (DIC), thường có liên quan với nhiễm khuẩn huyết hoặc suy đa cơ quan, đã được báo cáo.
Rối loạn hệ thống miễn dịch
Một số trường hợp sốc phản vệ, đôi khi tử vong đã được báo cáo.
Phản ứng quá mẫn với docetaxel (chưa rõ tần suất) đã được báo cáo trên bệnh nhân từng bị phản ứng quá mẫn với paclitaxel.
Rối loạn hệ thần kinh
Đã quan sát thấy một số hiếm trường hợp co giật hoặc mất ý thức thoáng qua khi điều trị bằng docetaxel. Các phản ứng này đôi khi xuất hiện trong quá trình tiêm truyền thuốc.
Rối loạn mắt
Rất hiếm trường hợp bị rối loạn thị giác thoáng qua (nhìn thấy vệt sáng, nhìn thấy những ánh chớp sáng và ám điểm) điển hình xảy ra trong quá trình truyền docetaxel và có liên quan với các phản ứng quá mẫn được báo cáo. Các triệu chứng này có thể phục hồi khi ngừng tiêm truyền. Hiếm gặp các trường hợp tăng tiết nước mắt kèm hoặc không kèm viêm kết mạc cũng như các trường hợp tắc nghẽn ống lệ dẫn đến chảy nước mắt quá mức. Các trường hợp phù hoàng điểm dạng nang (CMO) đã được báo cáo trên bệnh nhân điều trị bằng docetaxel.
Rối loạn tai và mê đạo
Một số hiếm trường hợp bị nhiễm độc tai, nghe kém và/hoặc điếc đã được báo cáo.
Rối loạn tim
Đã có báo cáo một số hiếm trường hợp bị nhồi máu cơ tim.
Chứng loạn nhịp thất bao gồm nhịp thất nhanh (chưa rõ tần suất), đôi khi tử vong, đã được báo cáo trên bệnh nhân điều trị bằng docetaxel trong phác đồ phối hợp với doxorubicin, 5-fluorouracil và/hoặc cyclophosphamid.
Rối loạn mạch máu
Các trường hợp bị huyết khối thuyên tắc tĩnh mạch hiếm khi được báo cáo.
Rối loạn hô hấp, lồng ngực và trung thất
Hiếm có báo cáo về hội chứng suy hô hấp cấp tính và các trường hợp viêm phổi mô kẽ/viêm phổi, bệnh phổi kẽ, xơ phổi và suy hô hấp đôi khi gây tử vong. Hiếm trường hợp viêm phổi do tia xạ được báo cáo trên những bệnh nhân được xạ trị đồng thời.
Rối loạn tiêu hóa
Một số hiếm trường hợp bị mất nước như hậu quả của các biến cố bất lợi trên đường tiêu hóa, thủng ống tiêu hóa, viêm đại tràng thiếu máu cục bộ, viêm đại tràng và viêm ruột do giảm bạch cầu trung tính đã được báo cáo. Một số hiếm trường hợp tắc ruột đã được báo cáo.
Rối loạn gan-mật
Rất hiếm trường hợp viêm gan, đôi khi tử vong chủ yếu trên các bệnh nhân đã có rối loạn chức năng gan trước đó đã được báo cáo.
Rối loạn da và mô dưới da
Rất hiếm trường hợp bị lupus ban đỏ và phát ban dạng bọng nước trên da như hồng ban đa dạng, hội chứng Stevens-Johnson, hoại tử thượng bì nhiễm độc được báo cáo khi điều trị bằng docetaxel. Trong một số trường hợp, các yếu tố đi kèm có thể góp phần làm phát triền những tác dụng không mong muốn này. Đã có báo cáo về những thay đổi giống xơ cứng bì thường gặp phải sau khi bị phù bạch huyết ngoại vi khi dùng docetaxel. Các trường hợp rụng tóc vĩnh viễn (chưa rõ tần suất) đã được báo cáo.
Rối loạn thận và tiết niệu
Suy thận đã được báo cáo. Khoảng 20% các trường hợp này không có yếu tố nguy cơ dẫn đến suy thận cấp như dùng đồng thời các thuốc gây độc với thận và các rối loạn tiêu hóa.
Rối loạn toàn thân và tại vị trí dùng thuốc
Hiện tượng viêm cấp tại vùng da trước đây được chiếu xạ hiếm khi được báo cáo.
Phản ứng viêm tại vị trí tiêm (sự tái phát phản ứng da tại vị trí thoát mạch trước đó sau khi dùng docetaxel tại vị trí khác) được quan sát thấy tại vị trí thoát mạch trước đó (chưa rõ tần suất).
Ứ dịch không đi kèm với các đợt thiểu niệu hoặc hạ huyết áp. Mất nước và phù phổi hiếm khi được báo cáo.
Rối loạn chuyển hóa và dinh dưỡng
Các trường hợp mất cân bằng điện giải đã được báo cáo. Các trường hợp giảm natri máu được báo cáo chủ yếu liên quan tới mất nước, nôn và viêm phổi. Hạ kali, magnesi và calci máu đã được quan sát thấy, thường liên quan tới rối loạn tiêu hóa và đặc biệt là tiêu chảy.
Bảo quản
Bảo quản ở nhiệt độ phòng, không quá 25°C. Không làm lạnh hoặc đóng băng. Giữ lọ ở trong hộp để tránh ánh sáng.
Sau khi mở trước khi pha loãng
Độ ổn định về mặt vật lý và hóa học khi sử dụng được chứng minh là trong 28 ngày ở 25°C sau khi đưa kim tiêm vào và rút dịch ra.
Thời han sử dụng sau khi pha loãng
Dung dịch đậm đặc để pha dung dịch tiêm truyền docetaxel là một dung dịch siêu bão hòa và do đó có thể kết tinh/ kết tủa theo thời gian. Dung dịch tiêm truyền nên được kiểm tra bằng mắt cẩn thận để phát hiện sự kết tủa trước khi sử dụng. Nếu dung dịch tiêm truyền không trong suốt hoặc xuất hiện sự kết tủa phải bị loại bỏ.
Độ ổn định về mặt vật lý và hóa học khi sử dụng được chứng minh là 4 giờ ở nhiệt độ 2 - 8°C tránh ánh sáng và dưới 25°C không tránh ánh sáng trong dung dịch glucose 5% hoặc natri chlorid 0,9% (0,30 mg/mL và 0,74 mg/mL).
Trên quan điểm vi sinh học, sản phẩm này nên được sử dụng ngay. Nếu không sử dụng ngay, thời gian bảo quản để sử dụng và điều kiện trước khi sử dụng là thuộc trách nhiệm của người sử dụng.
Phân loại ATC
L01CD02 - docetaxel
Trình bày/Đóng gói
Dung dịch đậm đặc pha tiêm truyền: hộp 1 lọ 2mL, hộp 1 lọ 8mL.
- Abacavir
- Abernil
- Abiiogran
- Acarbose
- ACC
- Acebutolol
- Acenocoumarol
- Acetate Ringer's
- Acetazolamide
- Acetylcystein
- Acetylsalicylic acid
- Aciclovir
- Acid acetylsalicylic
- Acid aminocaproic
- Acid ascorbic
- Acid boric
- Acid chenodeoxycholic
- Acid ethacrynic
- Acid folic
- Acid fusidic
- Acid iopanoic
- Acid ioxaglic
- Acid nalidixic
- Acid pantothenic
- Acid para-aminobenzoic
- Acid salicylic
- Acid tranexamic
- Acid valproic
- Acid zoledronic
- Acitretin
- Aclasta
- Aclon
- Actapulgite
- Actelsar
- Actelsar HCT
- Actemra
- Actilyse
- Acular
- Acupan
- Acuvail
- Acyclovir STADA
- Acyclovir STADA Cream
- Adalat
- Adenosin
- Adenosin Ebewe
- Adipiodon
- Advagraf
- Aerius
- Afinitor
- Agicarvir
- Agifovir-E
- Agilosart
- Agilosart-H
- Agimepzol
- Agimosarid
- Agimstan
- Agimstan-H
- Agiremid
- Agivastar
- Aibezym
- Air-X
- Alaxan
- Albendazol
- Albiomin
- Albumin
- Albumin người Grifols 20%
- Albuminar
- AlbuRx
- Albutein
- Alcuronium chloride
- Aldesleukin
- Alendronat
- Alertin
- Alfa-Lipogamma 600 Oral
- Alfuzosin hydrochlorid
- Algotra
- Alimemazin
- Alimta
- Allipem
- Allopurinol
- Allopurinol STADA
- Aloxi
- Alprazolam
- Alpha Chymotrypsin
- Alpha tocopherol
- Alphachymotrypsin Glomed
- Alphagan-P
- Aluvia
- Alzental
- Amaryl
- Ambroco
- Ambroxol
- Amcinol-Paste
- Amigold
- Amikacin
- Aminocaproic acid
- Aminoleban
- Aminoleban Oral
- Aminosteril N-Hepa
- Amiparen
- Amitriptyline
- Amiyu
- Amlodipine
- Amlor
- Amoxicillin
- Amoxicillin & clavulanate
- Ampicillin
- Amquitaz
- Anaferon for children
- Anargil
- Anaropin
- Andriol Testocaps
- Anepzil
- Anyfen
- Apaisac
- Apidra SoloStar
- Apitim 5
- Aprovel
- Aquaphil
- Arcalion
- Arcoxia
- Aricept Evess
- Arimidex
- Arnetine
- Artrodar
- A-Scabs
- Ascorbic acid
- Asperlican/Candinazol
- Aspilets EC
- Aspirin
- Asthmatin
- Atelec
- Atocib 120
- Atocib 90
- Atosiban PharmIdea
- Atozet
- Attapulgite
- Atussin
- Atropin
- Augbactam
- Augmentin Sachet
- Augmentin SR
- Augmentin Tablets
- Augmex
- Avamys
- Avastin
- Avelox Dịch truyền
- Avelox Viên nén
- Avodart
- Axcel Cefaclor-125 Suspension
- Axcel Cetirizine Syrup
- Axcel Chlorpheniramine
- Axcel Dexchlorpheniramine
- Axcel Dicyclomine-S Syrup
- Axcel Diphenhydramine Paediatric Syrup
- Axcel Erythromycin ES
- Axcel Eviline
- Axcel Fungicort Cream
- Axcel Fusidic acid Cream
- Axcel Fusidic acid-B Cream
- Axcel Hydrocortisone Cream
- Axcel Lignocaine 2% Sterile Gel
- Axcel Loratadine
- Axcel Miconazole Cream
- Axcel Paracetamol
- Axcel Urea Cream
- Axitan
- Azenmarol
- Azicine
- Aziphar
- Azithromycin





