Nhà sản xuất
Bayer AG
Nhà tiếp thị
Bayer (South East Asia)
Thành phần
Ultravist 300 Mỗi mL: Iopromide 0,623g (tương đương iodine 300mg).
Ultravist 370 Mỗi mL: Iopromide 0,769g (tương đương iodine 370mg).
Mô tả
Dung dịch trong suốt, không màu tới màu vàng nhạt.
Dược lực học
Chất cản quang có trong công thức của Ultravist là iopromide, không ion, có thể hoà tan trong nước, một dẫn xuất của axit triiodinated isophthalic có trọng lượng phân tử là 791,12, được gắn kết bền vững với iodine để hấp thụ tia X-quang.
Tiêm iopromid có tác dụng làm cản quang mạch máu hoặc các khoang cơ thể theo đường đi của chất cản quang, cho phép quan sát hình ảnh của các cấu trúc bên trong cho tới khi thuốc giảm bớt đáng kể.
Dược động học
Thông tin chung
Iopromide tác dụng ở trong cơ thể giống như các hợp chất ưa nước cao, trơ về mặt sinh học, thải trừ qua thận (như manitol hoặc inulin).
Hấp thu và phân bố
Sau khi sử dụng qua đường tĩnh mạch, nồng độ của iopromide giảm nhanh do thuốc được phân bố vào khoang ngoại bào và sau đó thải trừ. Tổng thể tích phân bố ở trạng thái ổn định là khoảng 16 L gần tương ứng với thể tích khoang ngoại bào.
Sự gắn kết protein là không đáng kể (khoảng 1%). Không có dấu hiệu cho thấy iopromide qua được hàng rào máu não còn nguyên vẹn. Các nghiên cứu trên động vật cho thấy một lượng nhỏ thuốc qua được hàng rào nhau thai (phát hiện được ≤ 0,3 % liều dùng trong phôi thai thỏ).
Sau khi đưa thuốc vào ống mật và/hoặc ống tụy bằng phương pháp nội soi chụp mật tụy ngược dòng (ERCP), các thuốc cản quang có chứa iod được hấp thu vào tuần hoàn chung và đạt nồng độ đỉnh trong huyết tương khoảng 1 đến 4 giờ sau khi dùng. Nồng độ tối đa của iodine trong huyết thanh sau khi sử dụng liều trung bình khoảng 7,3 g iodine thấp hơn khoảng 40 lần so với nồng độ huyết thanh tối đa đạt được sau khi dùng liều tương ứng qua đường tĩnh mạch.
Chuyển hóa
Iopromide không bị chuyển hoá.
Thải trừ
Thời gian bán hủy cuối cùng của iopromide là xấp xỉ 2 giờ, bất kể liều dùng. Trong khoảng liều thử nghiệm, trung bình độ thanh thải toàn phần của iopromide là 106±12 mL/phút và tương tự với độ thanh thải qua thận là 102±15 mL/phút. Do đó, iopromide thải trừ hầu hết qua thận. Chỉ có khoảng 2% liều dùng thải trừ qua phân trong vòng 3 ngày.
Khoảng 60% liều dùng theo đường tĩnh mạch được thải trừ qua nước tiểu trong vòng 3 giờ. Trung bình ≥ 93% liều dùng được tái hấp thu trong vòng 12 giờ. Thuốc chủ yếu được thải trừ trong 24 giờ.
Sau khi đưa thuốc vào ống mật và/hoặc ống tụy bằng phương pháp ERCP, nồng độ iodine trong nước tiểu và các nồng độ trong huyết thanh trở về mức trước khi đưa liều sau 7 ngày.
Tuyến tính/không tuyến tính
Các thông số dược động học của iopromide trên người thay đổi tỷ lệ thuận với liều dùng (như Cmax, AUC) hoặc phụ thuộc liều (như Vss, t1/2).
Đặc điểm sử dụng thuốc ở các dân số bệnh nhân đặc biệt
Người già (từ 65 tuổi trở lên)
Các bệnh nhân ở độ tuổi trung niên (49-64 tuổi) và người già (65-70 tuổi), không bị suy giảm chức năng thận đáng kể, có độ thanh thải huyết tương toàn phần trong khoảng 74 và 114 mL/phút (nhóm tuổi trung niên, trung bình 102 mL/phút) và trong khoảng 72 và 110 mL/phút (nhóm người già, trung bình 89 mL/phút), chỉ thấp hơn ngưỡng ở người khỏe mạnh trẻ tuổi (88 đến 138 mL/phút, trung bình 106 mL/phút). Thời gian bán thải trên mỗi bệnh nhân lần lượt tương ứng là 1,9-2,9 giờ và 1,5-2,7 giờ. So sánh với thời gian bán thải 1,4-2,1 giờ ở người tình nguyện khỏe mạnh trẻ tuổi, thời gian bán thải ở người trung niên và người già là tương đồng. Chỉ có một sự khác biệt nhỏ tương ứng với sự suy giảm tốc độ lọc cầu thận theo tuổi về mặt sinh lý.
Bệnh nhi
Dược động học của iopromide chưa được nghiên cứu trên bệnh nhi (xem phần Liều lượng và Cách dùng).
Bệnh nhân suy giảm chức năng thận
Ở những bệnh nhân suy thận, thời gian bán thải của iopromide bị kéo dài tương ứng với giảm tốc độ lọc cầu thận.
Độ thanh thải huyết tương giảm còn 49,4 mL/phút/1,73m2 (CV = 53%) ở bệnh nhân suy thận nhẹ và trung bình (80 > CLCR > 30 mL/phút/1,73m2) và còn 18,1 mL/phút/1,73m2 (CV = 30%) ở bệnh nhân suy thận nặng không phụ thuộc vào thẩm tách (CLCR = 30-10 mL/phút/1,73m2).
Thời gian bán thải trung bình là 6,1 giờ (CV = 43%) ở bệnh nhân suy thận nhẹ và trung bình (80 ≥ CLCR > 30 mL/phút/1,73m2) và 11,6 giờ (CV = 49%) ở bệnh nhân suy thận nặng không phụ thuộc thẩm tách (CLCR = 30-10 mL/phút/1,73m2).
Lượng thuốc được tái hấp thu từ nước tiểu trong vòng 6 giờ sau khi dùng liều thuốc là 38% ở bệnh nhân suy thận nhẹ đến trung bình và 26% ở bệnh nhân suy thận nặng; so với hơn 83% ở người tình nguyện khỏe mạnh. Trong 24 giờ sau khi dùng thuốc, lượng thuốc được tái hấp thu là 60% ở bệnh nhân suy thận nhẹ đến trung bình và 51% ở bệnh nhân suy thận nặng, so với hơn 95% ở người tình nguyện khỏe mạnh.
Iopromide được thải trừ qua thẩm tách máu. Khoảng 60% liều dùng của iopromide bị thải trừ sau 3 giờ thẩm tách.
Bệnh nhân suy giảm chức năng gan
Suy giảm chức năng gan không ảnh hưởng đến sự thải trừ của thuốc do iopromide không được chuyển hóa và chỉ có khoảng 2% liều dùng thải trừ qua phân.
An toàn tiền lâm sàng
Dữ liệu tiền lâm sàng cho thấy không có bằng chứng nào về nguy cơ cho người, căn cứ trên các nghiên cứu quy ước về an toàn dược lý học, độc tính khi dùng liều lặp lại, độc tính trên gan và độc tính trên sự sinh sản.
Độc tính toàn thân
Các nghiên cứu thử nghiệm về độ dung nạp thuốc toàn thân sau khi sử dụng thuốc nhiều lần theo đường tĩnh mạch hàng ngày và nhiều lần theo đường tiêm trong bao hàng tuần, không phát hiện các kết quả chống lại việc sử dụng Ultravist với mục đích chẩn đoán trên người.
Khả năng độc trên gen và gây ung thư
Các nghiên cứu về độc tính trên gen (các thử nghiệm về đột biến gen, nhiễm sắc thể và hệ gen) trên in vivo và in vitro cho thấy không có dấu hiệu về khả năng gây đột biến của Ultravist.
Do không có độc tính trên gen và cân nhắc cẩn thận đến độ ổn định của thuốc trong chuyển hóa, dược động học và không có dấu hiệu về khả năng gây độc trên các mô đang phát triển nhanh cũng như Ultravist chỉ được sử dụng một lần, không có bằng chứng về nguy cơ gây ung thư trên người.
Khả năng dung nạp tại chỗ và khả năng nhạy cảm do tiếp xúc
Các nghiên cứu về độ dung nạp tại chỗ sau khi sử dụng liều đơn cũng như nhiều lần thuốc qua đường tĩnh mạch và liều đơn tiêm động mạch, tiêm bắp, cận tĩnh mạch, tiêm màng bụng, tiêm trong bao và sử dụng theo đường kết mạc cho thấy không có hoặc có chỉ có tác dụng có hại nhỏ tại chỗ ở các mạch máu, mô cận tĩnh mạch, khoang dưới màng nhện và trên niêm mạc ở người.
Các nghiên cứu về tác dụng nhạy cảm do tiếp xúc cho thấy không có dấu hiệu về khả năng nhạy cảm của thuốc.
Chỉ định/Công dụng
Thuốc chỉ dùng với mục đích chẩn đoán.
Ultravist 300/370
Sử dụng theo đường tĩnh mạch hoặc bơm vào các khoang của cơ thể.
Thuốc có tác dụng làm tăng tương phản trong chụp cắt lớp điện toán (CT), chụp X quang động mạch và tĩnh mạch, chụp mạch máu số hóa xóa nền (DSA), chụp hệ niệu qua tĩnh mạch (UIV), chụp mật tụy ngược dòng (ERCP), chụp X quang khớp gối, và chụp các khoang khác của cơ thể.
Ultravist 370: Đặc biệt dùng trong chụp X quang mạch máu tim.
Không sử dụng Ultravist 300 và 370 để chụp nội tủy sống.
Liều lượng & Cách dùng
Thông tin chung
Thuốc cản quang được làm nóng bằng nhiệt độ cơ thể trước khi sử dụng có tác dụng dung nạp tốt hơn và tiêm dễ dàng hơn vì giảm bớt được độ nhớt của thuốc. Thông tin thêm về hướng dẫn sử dụng xin xem phần ''Hướng dẫn sử dụng''.
Liều lượng quy định
Liều lượng sử dụng theo đường tĩnh mạch
Nên điều chỉnh liều dùng theo tuổi tác, cân nặng,vấn đề lâm sàng và kỹ thuật tiến hành thủ thuật.
Liều dùng dưới đây chỉ là liều dùng thông thường được khuyên dùng cho người lớn với cân nặng trung bình là 70kg. Liều dùng được sử dụng cho 1 lần tiêm hoặc tính theo kg cân nặng cơ thể của bệnh nhân:
Nói chung, liều dùng đến 1,5 g iodine cho mỗi kg cân nặng được dung nạp tốt.
Liều khuyên dùng cho 1 lần tiêm:
Chụp mạch máu thông thường
Chụp quai động mạch chủ: 50-80 mL Ultravist 300
Chụp động mạch lựa chọn: 6-15 mL Ultravist 300
Chụp động mạch chủ ngực 50-80 mL Ultravist 300/370
Chụp động mạch chủ bụng 40-60 mL Ultravist 300
Chụp các động mạch khác:
· Chi trên: 8-12 mL Ultravist 300
· Chi dưới 20-30 mL Ultravist 300
Chụp X quang mạch máu tim:
· Tâm thất: 40-60 mL Ultravist 370
· Chụp mạch vành: 5-8 mL Ultravist 370
Chụp X quang tĩnh mạch
· Chi trên: 15-30 mL Ultravist 300
· Chi dưới: 30-60 mL Ultravist 300
Chụp mạch máu số hóa xóa nền qua tĩnh mạch
Tiêm bolus tĩnh mạch với liều 30-60 mL Ultravist 300 hay 370 (tốc độ tiêm 8-12 mL/giây khi tiêm tĩnh mạch cẳng tay; 10-12 mL/giây khi tiêm thẳng vào tĩnh mạch chủ), thường được chỉ định trong trường hợp cần làm nổi bật độ cản quang ở các mạch máu lớn. Lượng thuốc cản quang duy trì trong tĩnh mạch có thể giảm xuống và sử dụng để chẩn đoán bằng cách tiêm bolus tĩnh mạch dung dịch sodium chloride đẳng trương ngay sau đó.
Liều dùng đối với người lớn: 30-60mL Ultravist 300/370
Chụp cắt lớp điện toán
Trong trường hợp có thể, nên truyền bolus tĩnh mạch Ultravist, thường máy tiêm truyền được sử dụng nhiều hơn. Chỉ cho trường hợp chụp cắt lớp chậm, chỉ nửa tổng liều nên tiêm bolus tĩnh mạch và phần còn lại tiêm trong vòng 2-6 phút để đảm bảo mức độ trong máu tương đối không thay đổi mặc dù không đến mức tối đa.
Khi chụp cắt lớp (CT) xoắn trong kỹ thuật một dãy, đặc biệt trong kỹ thuật đa dãy, có thể nhanh chóng bơm một thể tích lớn trong mỗi lần nín thở. Để tăng hiệu quả tốt nhất của việc tiêm bolus tĩnh mạch (80-150 mL) Ultravist 300 trong khu vực đích (đỉnh, thời gian và giai đoạn tăng cường cản quang), phải nên sử dụng máy bơm tự động và theo dõi bolus.
· Chụp CT toàn thân
Trong chụp cắt lớp điện toán toàn thân, liều thuốc cản quang cần thiết và tốc độ tiêm truyền phụ thuộc vào bộ phận cần khảo sát, vấn đề cần chẩn đoán và đặc biệt là thời gian scan và tái tạo ảnh khác nhau của các máy scan sử dụng.
· Chụp CT sọ não
Người lớn
Ultravist 300: 1,0 - tối đa 2,0 mL/kg thể trọng
Ultravist 370: 1,0 - tối đa 1,5 mL/kg thể trọng
Chụp hệ niệu qua tĩnh mạch
Do khả năng cô đặc về mặt sinh lý của các vi cầu vẫn chưa trưởng thành kém của thận trẻ em đòi hỏi liều thuốc cản quang phải tương đối cao.
Liều dùng dưới đây được khuyên dùng:
Trẻ sơ sinh (dưới 1 tháng): 1,2 g L/kg trọng lượng cơ thể = 4,0 mL/kg trọng lượng cơ thể Ultravist 300 hoặc = 3,2 mL/kg trọng lượng cơ thể Ultravist 370
Trẻ nhỏ (từ 1 tháng đến 2 tuổi): 1,0 g L/kg trọng lượng cơ thể = 3,0 mL/kg trọng lượng cơ thể Ultravist 300 hoặc = 2,7 mL/kg trọng lượng cơ thể Ultravist 370
Trẻ em (2 đến 11 tuổi): 0,5 g L/kg trọng lượng cơ thể = 1,5 mL/kg trọng lượng cơ thể Ultravist 300 hoặc = 1,4 mL/kg trọng lượng cơ thể Ultravist 370
Thanh thiếu niên và người lớn: 0,3 g L/kg trọng lượng cơ thể = 1,0 mL/kg trọng lượng cơ thể Ultravist 300 hoặc = 0,8 mL/kg trọng lượng cơ thể Ultravist 370 và có thể tăng liều ở người lớn nếu cần trong những chỉ định đặc biệt.
Thời gian chụp phim
Khi tiêm một lượng Ultravist 300/370 theo liều khuyên dùng nêu trên trong thời gian từ 1-2 phút, độ cản quang ở nhu mô thận thường cao trong vòng từ 3-5 phút, ở bể thận với đường niệu từ 8-15 phút sau khi bắt đầu tiêm. Thời gian sớm hơn đối với người trẻ và thời gian muộn hơn đối với bệnh nhân lớn tuổi.
Thông thường nên chụp phim đầu tiên sớm, khoảng 2 phút sau khi tiêm thuốc cản quang. Ở nhũ nhi, trẻ nhỏ và bệnh nhân bị suy thận thì những phim về sau có thể thấy rõ đường niệu.
Liều dùng khi chụp các khoang trong cơ thể
Trong khi tiêm để chụp cản quang khớp xương, tử cung - vòi trứng và chụp mật, tụy ngược dòng (ERCP), nên kiểm soát việc tiêm thuốc cản quang bằng phép soi huỳnh quang.
Liều khuyên dùng cho một lần chụp
Liều dùng có thể khác nhau phụ thuộc vào tuổi tác, cân nặng và thể trạng của bệnh nhân. Nó cũng phụ thuộc vào các vấn đề lâm sàng, kỹ thuật chụp và vùng chụp. Dưới đây là liều dùng trung bình đối với người lớn bình thường:
Chụp cản quang các khớp: 5-15 mL Ultravist 300/370
ERCP: Phụ thuộc nói chung vào vấn đề lâm sàng và kích thước của cấu trúc cần chụp hình.
Các chỉ định khác: Phụ thuộc nói chung vào vấn đề lâm sàng và kích thước của cấu trúc cần chụp hình.
Thông tin thêm trên các dân số đặc biệt
Trẻ sơ sinh (dưới 1 tháng) và trẻ nhỏ (1 tháng - 2 tuổi)
Trẻ nhỏ (dưới 1 tuổi) và đặc biệt là trẻ sơ sinh rất dễ bị mất cân bằng điện giải và rối loạn huyết động. Do đó cần chú ý đến: liều dùng của thuốc cản quang, quy trình kỹ thuật thực hiện trong chụp Xquang và tình trạng bệnh nhân.
Người già (từ 65 tuổi trở lên)
Một nghiên cứu lâm sàng cho thấy không có sự khác biệt về dược động học của iopromide giữa người già (từ 65 tuổi trở lên) và các bệnh nhân ít tuổi hơn. Do đó, không có khuyến cáo đặc biệt đối với hiệu chỉnh liều cho người già ngoài các phần khác trong mục Liều lượng quy định.
Bệnh nhân suy giảm chức năng gan
Chức năng gan bị suy giảm không ảnh hưởng đến sự thải trừ của iopromide, chỉ có 2% liều dùng được thải trừ qua phân và iopromide không bị chuyển hóa. Không cần hiệu chỉnh liều ở bệnh nhân suy giảm chức năng gan.
Bệnh nhân suy giảm chức năng thận
Do iopromide thải trừ hầu như hoàn toàn qua thận dưới dạng không đổi, sự thải trừ của iopromide bị kéo dài ở bệnh nhân suy thận. Để giảm nguy cơ làm thận suy nặng thêm do thuốc cản quang ở bệnh nhân đã có suy thận trước, nên sử dụng liều thấp nhất có thể ở các bệnh nhân này (xem thêm phần Cảnh báo và Dược động học).
Hướng dẫn sử dụng
Nên làm nóng dung dịch Ultravist bằng nhiệt độ cơ thể trước khi dùng.
Kiểm tra bằng mắt trước khi sử dụng
Cần kiểm tra bằng mắt thường các chai thuốc cản quang trước khi sử dụng và không được sử dụng những chai thuốc đã đổi màu hoặc xuất hiện những chất hạt (kể cả các tinh thể) hoặc bao bì bị khiếm khuyết. Vì Ultravist là một dung dịch có nồng độ cao, sự kết tinh (xuất hiện những đám mây trắng đục và/ hoặc chất cặn ở đáy chai thuốc hoặc nổi những tinh thể) có thể xảy ra nhưng rất hiếm.
Chai lớn (chỉ sử dụng cho đường tĩnh mạch).
Cần áp dụng các quy tắc sau để rút nhiều liều thuốc cản quang từ chai 200 mL hoặc lớn hơn
Cần thực hiện việc rút thuốc cản quang ra nhiều lần bằng cách dùng một thiết bị được phê duyệt sử dụng nhiều lần.
Không bao giờ được đâm xuyên nút cao su quá 1 lần để đề phòng một lượng lớn phân tử nhỏ từ nút cao su đi vào dung dịch thuốc.
Dung dịch thuốc cản quang phải được sử dụng bằng máy bơm tiêm tự động hoặc bằng các thủ thuật được cho phép khác đảm bảo được được tính vô trùng của thuốc cản quang.
Phải thay ống tiêm từ máy bơm tiêm ở bệnh nhân (ống tiêm của bệnh nhân) sau khi sử dụng cho mỗi bệnh nhân để đề phòng nhiễm chéo.
Ống nối hoặc các bộ phận sử dụng một lần khác của máy bơm tiêm cần phải tiêu hủy khi hết thuốc trong chai truyền hoặc 10 giờ sau khi mở bao bì lần đầu tiên.
Phải tuân thủ theo hướng dẫn sử dụng thiết bị của nhà sản xuất.
Dung dịch thuốc cản quang không được sử dụng hết phải tiêu hủy sau 10 giờ mở nắp lần đầu tiên.
Cảnh báo
Đối với tất cả mọi chỉ định
Phản ứng quá mẫn
Ultravist có thể liên quan đến các phản ứng phản vệ/quá mẫn hoặc phản ứng đặc ứng với các biểu hiện trên tim mạch, hô hấp và da.
Các phản ứng giống như dị ứng thay đổi từ mức độ nhẹ đến nặng, kể cả sốc có thể xảy ra (xem phần Tác dụng ngoại ý). Hầu hết các phản ứng xảy ra trong vòng 30 phút sau khi dùng. Tuy nhiên, các phản ứng cũng có thể xảy ra muộn (sau vài giờ đến vài ngày).
Nguy cơ xảy ra các phản ứng quá mẫn cao hơn trong các trường hợp sau:
· đã từng có phản ứng với thuốc cản quang
· tiền sử hen phế quản hoặc các rối loạn dị ứng khác
Việc đánh giá giữa nguy cơ và lợi ích là rất cần thiết đối với những bệnh nhân có tiền sử mẫn cảm với Ultravist hoặc bất kỳ thành phần nào của Ultravist, hoặc có tiền sử phản ứng quá mẫn đối với bất kỳ loại thuốc cản quang có chứa i-ốt nào trước đó bởi nó có thể làm tăng nguy cơ phản ứng quá mẫn (bao gồm cả những phản ứng nghiêm trọng).
Tuy nhiên, những phản ứng này có bản chất không thường xuyên và khó dự đoán.
Bệnh nhân đã từng gặp các phản ứng như vậy khi sử dụng các thuốc chẹn beta có thể đề kháng lại tác dụng điều trị của các thuốc chủ vận beta (xem thêm phần Tương tác).
Trong phản ứng quá mẫn nặng, bệnh nhân có các bệnh tim mạch thường có nguy cơ gặp phải hậu quả nghiêm trọng hơn, thậm chí tử vong.
Do khả năng xảy ra các phản ứng quá mẫn nặng sau khi dùng, nên theo dõi bệnh nhân sau khi sử dụng thuốc.
Cần chuẩn bị sẵn sàng các phương tiện cấp cứu cho tất cả bệnh nhân.
Ở bệnh nhân có nguy cơ cao xảy ra các phản ứng giống dị ứng cấp tính, bệnh nhân có tiền sử mắc phản ứng dị ứng cấp tính, hen phế quản hoặc dị ứng ở mức độ trung bình hoặc nặng, cần được điều trị thuốc, nên cân nhắc với chế độ điều trị trước với corticosteroid.
Rối loạn chức năng tuyến giáp
Cần đặc biệt đánh giá thận trọng nguy cơ/lợi ích trên những bệnh nhân biết hoặc nghi ngờ có tăng năng tuyến giáp hay bướu giáp, vì thuốc cản quang có chứa i- ốt có thể gây nên tình trạng cường giáp và cơn độc giáp ở những bệnh nhân này. Việc kiểm tra chức năng tuyến giáp trước khi sử dụng Ultravist và/hoặc thuốc ngừa ức chế tuyến giáp có thể nên cân nhắc đối với những trường hợp có hoặc nghi ngờ có tăng năng tuyến giáp.
Ở trẻ sơ sinh, đặc biệt là trẻ thiếu tháng, đã từng phơi nhiễm với Ultravist hoặc qua người mẹ trong thời kỳ mang thai hoặc trong giai đoạn sơ sinh, thì cần theo dõi chức năng tuyến giáp do sự phơi nhiễm quá mức với iodine có thể gây ra hội chứng thiểu năng tuyến giáp, có thể cần phải điều trị.
Rối loạn thần kinh trung ương
Nguy cơ gặp các biến chứng thần kinh có liên quan đến Ultravist tăng lên ở các bệnh nhân có các rối loạn thần kinh trung ương. Biến chứng thần kinh thường gặp hơn ở các bệnh nhân chụp X-quang mạch não và các thủ thuật liên quan.
Cần thận trọng trong các tình trạng trong đó ngưỡng động kinh có thể giảm như bệnh nhân có tiền sử động kinh và sử dụng đồng thời một số thuốc.
Các yếu tố làm tăng tính thấm của thuốc qua hàng rào máu não sẽ làm tăng khả năng vận chuyển của thuốc cản quang vào mô não, có thể dẫn đến các phản ứng trên hệ thần kinh trung ương.
Truyền nước
Cần đảm bảo cho thêm đủ một lượng nước trước và sau khi sử dụng Ultravist dùng qua đường tĩnh mạch và tiêm trong bao để hạn chế tối đa nguy cơ độc tính trên thận do thuốc cản quang (xem thêm mục ''Sử dụng các thuốc theo đường tĩnh mạch'' - Suy giảm chức năng thận). Điều này đặc biệt áp dụng với bệnh nhân đa u tủy, đái tháo đường, chứng tiểu nhiều, chứng tiểu ít, tăng acid uric máu cũng như với trẻ sơ sinh, trẻ nhủ nhi, trẻ nhỏ và người già.
Tình trạng lo âu
Tình trạng hưng phấn, lo âu và đau rõ rệt có thể làm tăng nguy cơ các tác dụng phụ hoặc làm nặng thêm các phản ứng liên quan đến thuốc cản quang. Cần quan tâm đến các bệnh nhân này để giảm tối đa tình trạng lo âu.
Kiểm tra trước khi sử dụng
Không khuyến cáo kiểm tra độ nhạy cảm với thuốc trước khi sử dụng bằng cách dùng một liều nhỏ thuốc cản quang do điều này không có giá trị dự đoán. Hơn nữa, chính test kiểm tra độ nhạy cảm cũng có thể dẫn đến các phản ứng quá mẫn nghiêm trọng, thậm chí tử vong.
Sử dụng theo đường tĩnh mạch
Suy chức năng thận
Độc tính trên thận do thuốc cản quang, biểu hiện tổn thương chức năng thận thoáng qua, có thể xảy ra sau khi tiêm Ultravist theo đường tĩnh mạch. Suy thận cấp tính có thể xảy ra trong một số trường hợp. Các yếu tố nguy cơ bao gồm:
Bệnh nhân đã có suy chức năng thận.
Mất nước.
Đái tháo đường.
Đa u tủy/paraprotein máu.
Liều Ultravist nhắc lại và/hoặc cao.
Tất cả những bệnh nhân sử dụng Ultravist phải đảm bảo được thêm nước đầy đủ.
Bệnh nhân đang lọc máu, nếu không có chức năng thận còn lại, thì có thể sử dụng Ultravist cho thủ thuật chụp X quang bởi thuốc được đào thải khỏi cơ thể qua quá trình lọc máu.
Các bệnh về tim mạch
Nguy cơ phát triển các dấu hiệu lâm sàng liên quan đến các thay đổi huyết động học và loạn nhịp tim tăng lên ở những bệnh nhân mắc các bệnh tim hoặc bệnh mạch vành trầm trọng.
Sử dụng Ultravist theo đường tĩnh mạch có thể thúc đẩy tình trạng phù phổi cấp ở những bệnh nhân suy tim.
U tế bào ưa crom
Bệnh nhân có u tế bào ưa crôm có thể tăng nguy cơ phát triển cơn cao huyết áp.
Chứng nhược cơ nặng
Sử dụng Ultravist có thể làm tăng các triệu chứng của chứng nhược cơ nặng.
Biến cố thuyên tắc mạch
Đặc tính của các thuốc cản quang không có i-on là khả năng gây nhiễu các chức năng sinh lý thấp. Chính vì điều này nên các thuốc cản quang không chứa i-on thường ít hoạt tính chống đông trên in vitro hơn các thuốc cản quang có chứa i-on. Ngoài thuốc cản quang, rất nhiều yếu tố, bao gồm cả thời gian tiến hành thủ thuật, số lần tiêm truyền, chất liệu của catheter và xy-lanh, tình trạng bệnh lý tiềm ẩn và việc sử dụng đồng thời các thuốc khác có thể góp phần vào các biến cố huyết khối thuyên tắc mạch. Do vậy, khi tiến hành thủ thuật đặt catheter mạch máu, cần lưu ý vấn đề này và đặc biệt lưu ý trong kỹ thuật chụp X quang mạch máu và thường xuyên bơm rửa catheter với nước muối sinh lý (với Heparin nếu có thể) và giảm thiểu thời gian tiến hành thủ thuật để giảm tối đa nguy cơ gây huyết khối và thuyên tắc mạch.
Tác động lên khả năng lái xe và vận hành máy móc
Không rõ.
Quá Liều
Kết quả của những nghiên cứu về độc tính trên động vật không cho thấy nguy cơ gây ngộ độc cấp tính khi sử dụng Ultravist.
Sử dụng quá liều Ultravist theo đường tĩnh mạch
Triệu chứng có thể bao gồm mất cân bằng dịch và điện giải, suy thận, biến chứng tim mạch và phổi.
Trong trường hợp vô ý xảy ra quá liều khi sử dụng thuốc theo đường tĩnh mạch, cần theo dõi lượng dịch, điện giải và chức năng thận. Việc điều trị quá liều nên hướng đến hỗ trợ các chức năng sống còn của cơ thể. Ultravist có thể thẩm tách được.
Chống chỉ định
Không có chống chỉ định tuyệt đối với việc sử dụng Ultravist.
Sử dụng ở phụ nữ có thai và cho con bú
Phụ nữ có thai
Những nghiên cứu đầy đủ và có kiểm soát tốt chưa được tiến hành trên phụ nữ có thai. Sử dụng các thuốc cản quang không chứa i-on chưa được chứng minh đầy đủ là an toàn đối với phụ nữ có thai. Do vậy, nếu có thể, không nên tiến hành chụp X quang trong thời gian mang thai, lợi ích của việc chụp X quang, có hay không có sử dụng thuốc cản quang cần được cân nhắc với những nguy cơ có thể xảy ra.
Các nghiên cứu trên động vật không cho thấy những tác động có hại đối với thai nghén, sự phát triển của bào thai/ phôi thai, quá trình sinh con và sự phát triển sau sanh sau khi sử dụng thuốc cản quang không chứa i-on để chẩn đoán trên con người.
Bà mẹ đang cho con bú
Sự an toàn của Ultravist đối với trẻ bú mẹ chưa được nghiên cứu. Thuốc cản quang tiết vào trong sữa mẹ là rất thấp. Sự gây hại đối với trẻ bú mẹ có khả năng không xảy ra (xem mục Cảnh báo - phần ''Rối loạn chức năng tuyến giáp'').
Tương tác
Các biguanide (metformin)
Ở bệnh nhân suy thận cấp hoặc suy thận mạn nghiêm trọng, sự thải trừ biguanide có thể bị giảm dẫn đến tích lũy thuốc và gây nhiễm toan lactic. Do việc sử dụng Ultravist có thể dẫn đến suy thận hoặc làm nặng thêm bệnh suy thận, bệnh nhân điều trị bằng metformin có thể có nguy cơ cao nhiễm toan lactic, đặc biệt với các bệnh nhân trước đây đã bị suy thận (xem phần Cảnh báo - ''Sử dụng thuốc qua đường tĩnh mạch'' - Suy thận).
Interleukin-2
Việc điều trị Interleukin-2 trước đây (đến vài tuần) làm tăng nguy cơ các tác dụng ngoại ý muộn đối với Ultravist.
Đồng vị phóng xạ
Việc chẩn đoán và điều trị các rối loạn về tuyến giáp bằng phương pháp đồng vị phóng xạ hướng tuyến giáp có thể bị trở ngại cho đến vài tuần sau khi sử dụng Ultravist do khả năng hấp thu chất phóng xạ bị giảm xuống.
Tương kỵ
Không được trộn lẫn Ultravist với bất kỳ loại thuốc nào khác để ngăn ngừa nguy cơ tương kỵ có thể xảy ra.
Tác dụng ngoại ý
Tóm tắt các dữ liệu về độ an toàn
Toàn bộ các dữ liệu về độ an toàn của Ultravist dựa trên dữ liệu thu được trong các nghiên cứu trước khi lưu hành thuốc trên thị trường trên hơn 3.900 bệnh nhân và các nghiên cứu sau khi thuốc lưu hành trên thị trường trên hơn 74.000 bệnh nhân, cũng như dữ liệu từ báo cáo tự phát và y văn.
Các phản ứng có hại của thuốc thường gặp nhất (≥ 4 %) ở bệnh nhân sử dụng Ultravist là đau đầu, buồn nôn và giãn mạch.
Các phản ứng có hại nghiêm trọng khi sử dụng Ultravist là sốc dạng phản vệ, ngừng thở, co thắt phế quản, phù họng, phù thanh quản, hen suyễn, hôn mê, nhồi máu não, đột quỵ, phù não, co giật, loạn nhịp tim, ngừng tim, thiếu máu cục bộ cơ tim, nhồi máu cơ tim, suy tim, nhịp tim chậm, tím tái, hạ huyết áp, sốc, khó thở, phù phổi, suy hô hấp và viêm phổi hít.
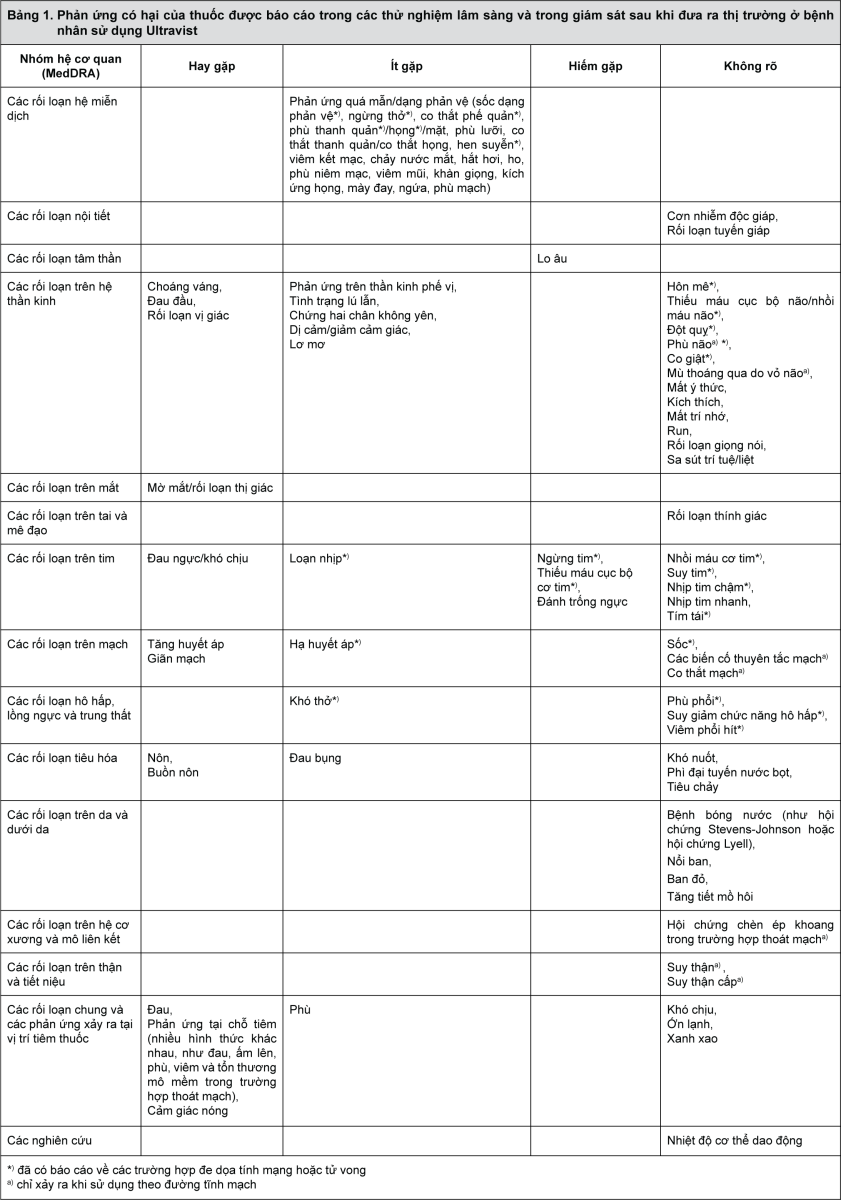
Bảng liệt kê các phản ứng có hại
Những phản ứng có hại của Ultravist được thể hiện trong bảng dưới đây. Các phản ứng này được phân loại theo nhóm hệ cơ quan. Các thuật ngữ MedDRA thích hợp nhất được sử dụng để mô tả một số phản ứng và những từ đồng nghĩa và những chứng bệnh có liên quan.
Các phản ứng có hại của thuốc ghi nhận từ các thử nghiệm lâm sàng được phân loại theo tần suất xảy ra. Các nhóm phân loại quy ước như sau:
hay gặp: ≥ 1/100 đến < 1/10;
ít gặp: ≥ 1/1.000 đến < 1/100;
hiếm gặp: ≥ 1/10.000 đến < 1/1.000.
Các phản ứng có hại chỉ được phát hiện trong giai đoạn giám sát sau khi đưa ra thị trường và không thể ước tính được tần suất xảy ra, được xếp vào nhóm “không rõ”.
- xem Bảng 1.
Cùng với các phản ứng có hại của thuốc (ADR) được nêu ở trên, còn có một số ADR sau được báo cáo khi sử dụng tiêm thuốc trong bao: viêm màng não do hóa chất và chứng kích thích màng não với tần suất xảy ra không rõ.
Cùng với các ADR được nêu ở trên, còn có một số ADR sau được báo cáo khi sử dụng thuốc để nội soi chụp mật tụy ngược dòng (ERCP): mức độ enzym tụy tăng lên và có thể xảy ra viêm tụy với tần suất không rõ.
Phần lớn các phản ứng sau khi chụp tủy sống hoặc đưa thuốc vào các khoang cơ thể xảy ra trong vài giờ sau khi dùng thuốc.
Bảo quản
Bảo quản ở nhiệt độ dưới 30°C. Tránh tiếp xúc với ánh sáng và các ion phóng xạ khác.
Phân loại ATC
V08AB05 - iopromide
Trình bày/Đóng gói
Dung dịch tiêm: hộp 10 chai 50mL hoặc 100mL.
- Abacavir
- Abernil
- Abiiogran
- Acarbose
- ACC
- Acebutolol
- Acenocoumarol
- Acetate Ringer's
- Acetazolamide
- Acetylcystein
- Acetylsalicylic acid
- Aciclovir
- Acid acetylsalicylic
- Acid aminocaproic
- Acid ascorbic
- Acid boric
- Acid chenodeoxycholic
- Acid ethacrynic
- Acid folic
- Acid fusidic
- Acid iopanoic
- Acid ioxaglic
- Acid nalidixic
- Acid pantothenic
- Acid para-aminobenzoic
- Acid salicylic
- Acid tranexamic
- Acid valproic
- Acid zoledronic
- Acitretin
- Aclasta
- Aclon
- Actapulgite
- Actelsar
- Actelsar HCT
- Actemra
- Actilyse
- Acular
- Acupan
- Acuvail
- Acyclovir STADA
- Acyclovir STADA Cream
- Adalat
- Adenosin
- Adenosin Ebewe
- Adipiodon
- Advagraf
- Aerius
- Afinitor
- Agicarvir
- Agifovir-E
- Agilosart
- Agilosart-H
- Agimepzol
- Agimosarid
- Agimstan
- Agimstan-H
- Agiremid
- Agivastar
- Aibezym
- Air-X
- Alaxan
- Albendazol
- Albiomin
- Albumin
- Albumin người Grifols 20%
- Albuminar
- AlbuRx
- Albutein
- Alcuronium chloride
- Aldesleukin
- Alendronat
- Alertin
- Alfa-Lipogamma 600 Oral
- Alfuzosin hydrochlorid
- Algotra
- Alimemazin
- Alimta
- Allipem
- Allopurinol
- Allopurinol STADA
- Aloxi
- Alprazolam
- Alpha Chymotrypsin
- Alpha tocopherol
- Alphachymotrypsin Glomed
- Alphagan-P
- Aluvia
- Alzental
- Amaryl
- Ambroco
- Ambroxol
- Amcinol-Paste
- Amigold
- Amikacin
- Aminocaproic acid
- Aminoleban
- Aminoleban Oral
- Aminosteril N-Hepa
- Amiparen
- Amitriptyline
- Amiyu
- Amlodipine
- Amlor
- Amoxicillin
- Amoxicillin & clavulanate
- Ampicillin
- Amquitaz
- Anaferon for children
- Anargil
- Anaropin
- Andriol Testocaps
- Anepzil
- Anyfen
- Apaisac
- Apidra SoloStar
- Apitim 5
- Aprovel
- Aquaphil
- Arcalion
- Arcoxia
- Aricept Evess
- Arimidex
- Arnetine
- Artrodar
- A-Scabs
- Ascorbic acid
- Asperlican/Candinazol
- Aspilets EC
- Aspirin
- Asthmatin
- Atelec
- Atocib 120
- Atocib 90
- Atosiban PharmIdea
- Atozet
- Attapulgite
- Atussin
- Atropin
- Augbactam
- Augmentin Sachet
- Augmentin SR
- Augmentin Tablets
- Augmex
- Avamys
- Avastin
- Avelox Dịch truyền
- Avelox Viên nén
- Avodart
- Axcel Cefaclor-125 Suspension
- Axcel Cetirizine Syrup
- Axcel Chlorpheniramine
- Axcel Dexchlorpheniramine
- Axcel Dicyclomine-S Syrup
- Axcel Diphenhydramine Paediatric Syrup
- Axcel Erythromycin ES
- Axcel Eviline
- Axcel Fungicort Cream
- Axcel Fusidic acid Cream
- Axcel Fusidic acid-B Cream
- Axcel Hydrocortisone Cream
- Axcel Lignocaine 2% Sterile Gel
- Axcel Loratadine
- Axcel Miconazole Cream
- Axcel Paracetamol
- Axcel Urea Cream
- Axitan
- Azenmarol
- Azicine
- Aziphar
- Azithromycin