Nhà sản xuất
Astellas
Thành phần
Mỗi viên: Febuxostat 80mg.
Cơ chế tác dụng
Acid uric là sản phẩm cuối cùng của sự chuyển hóa purin ở người và được tạo thành trong các đợt hypoxanthin → xanthin → acid uric. Cả hai bước trong sự chuyển dạng trên được xúc tác bởi xanthin oxidase (XO). Febuxostat là một dẫn xuất 2-arylthiazol đạt được hiệu quả điều trị làm giảm nồng độ acid uric huyết thanh bằng cách ức chế chọn lọc xanthin oxidase. Febuxostat là một chất ức chế chọn lọc xanthin oxidase không purin (NP-SIXO) mạnh với một giá trị Ki ức chế in vitro dưới 1 nanomol. Febuxostat đã được chứng minh là ức chế mạnh cả dạng oxy hóa và dạng khử của xanthin oxidase. Ở nồng độ điều trị, febuxostat không ức chế các enzym khác tham gia vào sự chuyển hóa purin hoặc pyrimidin, tức là guanin deaminase, hypoxanthin guanin phosphoribosyltransferase, orotat phosphoribosyltransferase, orotidin monophosphat decarboxylase hoặc purin nucleosid phosphorylase.
Dược lực học
Hiệu quả và độ an toàn về lâm sàng: Hiệu quả của febuxostat đã được chứng minh trong 3 nghiên cứu then chốt pha 3 (2 nghiên cứu then chốt APEX và FACT và nghiên cứu CONFIRMS bổ sung được mô tả dưới đây) đã được thực hiện ở 4101 bệnh nhân bị tăng acid uric huyết và bệnh gút. Trong mỗi nghiên cứu then chốt pha 3, febuxostat đã cho thấy khả năng trội hơn trong việc làm giảm và duy trì nồng độ acid uric huyết thanh so với alopurinol. Tiêu chí đánh giá chính về hiệu quả trong các nghiên cứu APEX và FACT là tỷ lệ bệnh nhân có 3 trị số nồng độ acid uric huyết thanh hàng tháng cuối cùng < 6,0mg/dL (357µmol/L). Trong nghiên cứu CONFIRMS pha 3 bổ sung, với kết quả có sau khi giấy phép lưu hành cho febuxostat được cấp lần đầu tiên, tiêu chí chính đánh giá hiệu quả là tỷ lệ bệnh nhân có nồng độ urat huyết thanh < 6,0mg/dL ở lần thăm khám cuối cùng. Không có bệnh nhân được ghép tạng nào đã được bao gồm trong các nghiên cứu này (xem phần Liều lượng và Cách dùng).
Nghiên cứu APEX: Nghiên cứu về hiệu quả của febuxostat có đối chứng với alopurinol và giả dược (Alopurinol and Placebo-Controlled Efficacy Study of Febuxostat - APEX) là một nghiên cứu 28 tuần, pha 3, ngẫu nhiên, mù đôi, đa trung tâm. Một ngàn bảy mươi hai (1.072) bệnh nhân được chọn ngẫu nhiên: giả dược (n=134), febuxostat 80mg, 1 lần/ngày (n=267), febuxostat 120mg, 1 lần/ngày (n=269), febuxostat 240mg, 1 lần/ngày (n=134) hoặc alopurinol (300mg, 1 lần/ngày [n=258] đối với những bệnh nhân có nồng độ creatinin huyết thanh ban đầu ≤ 1,5mg/dL hoặc 100mg, 1 lần/ngày [n=10] đối với những bệnh nhân có nồng độ creatinin huyết thanh ban đầu > 1,5mg/dL và ≤ 2,0mg/dL). Febuxostat 240mg (gấp 2 lần liều cao nhất được khuyến cáo) đã được sử dụng như một liều đánh giá độ an toàn.
Nghiên cứu APEX cho thấy sự trội hơn có ý nghĩa thống kê ở cả hai nhóm điều trị bằng febuxostat 80mg, 1 lần/ngày và febuxostat 120mg, 1 lần/ngày so với nhóm điều trị bằng alopurinol liều thông thường 300mg (n=258)/100mg (n=10) trong việc làm giảm nồng độ acid uric huyết thanh (sUA) dưới 6mg/dL (357µmol/L) (xem Bảng 1 và Hình 1).
Nghiên cứu FACT: Nghiên cứu thử nghiệm về febuxostat có đối chứng với alopurinol (Febuxostat Alopurinol Controlled Trial - FACT) là một nghiên cứu 52 tuần, pha 3, ngẫu nhiên, mù đôi, đa trung tâm. Bảy trăm sáu mươi (760) bệnh nhân được chọn ngẫu nhiên: febuxostat 80mg, 1 lần/ngày (n=256), febuxostat 120mg, 1 lần/ngày (n=251) hoặc alopurinol 300mg, 1 lần/ngày (n=253).
Nghiên cứu FACT cho thấy sự trội hơn có ý nghĩa thống kê của cả hai nhóm điều trị bằng febuxostat 80mg 1 lần/ngày và febuxostat 120mg, 1 lần/ngày so với nhóm điều trị bằng alopurinol liều thông thường 300mg trong việc làm giảm và duy trì nồng độ acid uric huyết thanh (sUA) dưới 6mg/dL (357µmol/L).
Bảng 1 tóm tắt kết quả theo tiêu chí đánh giá chính về hiệu quả:

Khả năng febuxostat làm giảm nồng độ acid uric trong huyết thanh là ngay tức thì và kéo dài. Sự giảm nồng độ acid uric huyết thanh xuống < 6,0mg/dL (357µmol/L) đã được ghi nhận vào lần thăm khám ở tuần thứ 2 và được duy trì trong suốt thời gian điều trị. Nồng độ acid uric huyết thanh trung bình theo thời gian đối với mỗi nhóm điều trị từ 2 nghiên cứu pha 3 then chốt được thể hiện trong Hình 1.
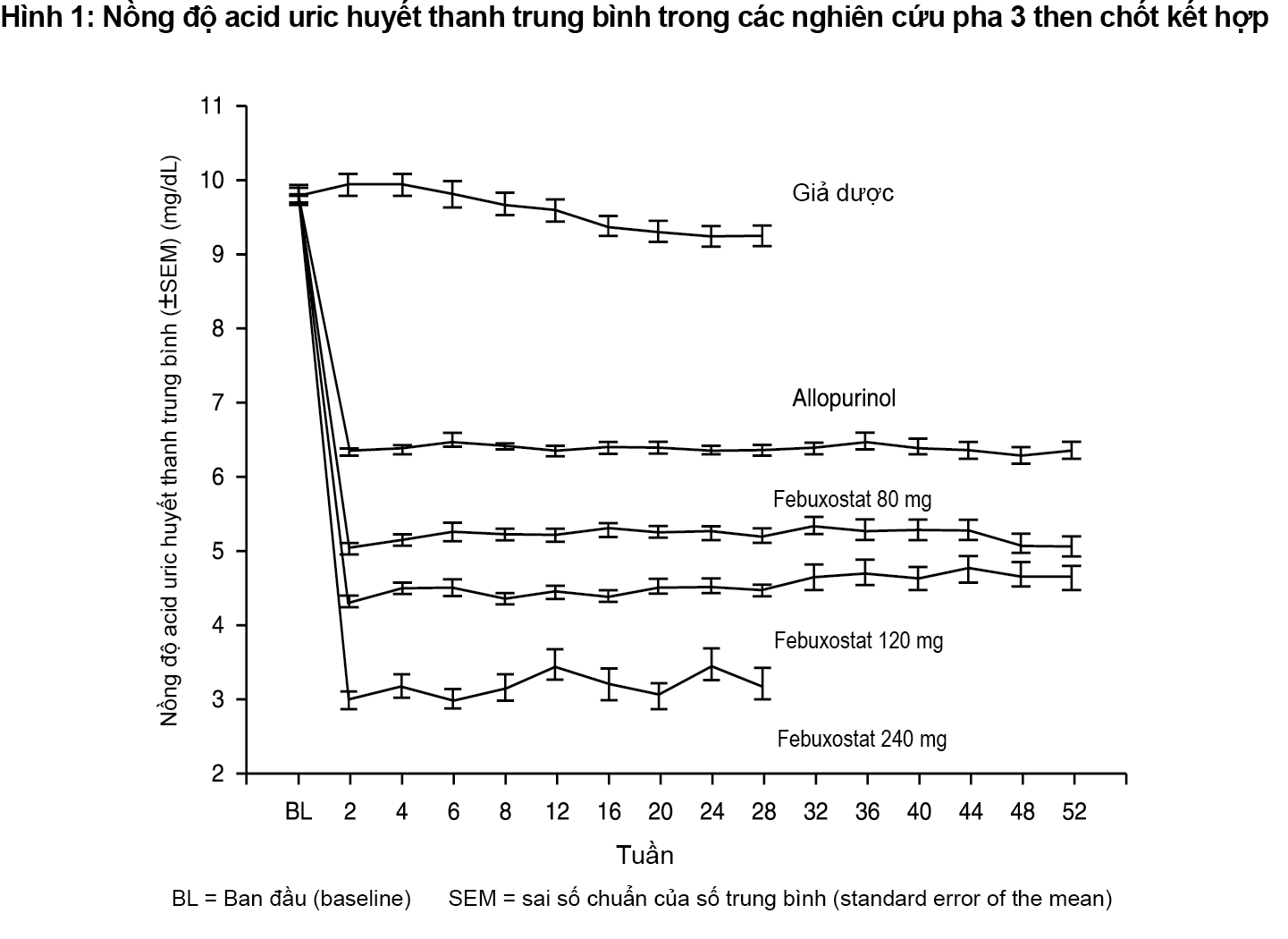
Lưu ý: 509 bệnh nhân được điều trị bằng alopurinol 300mg, 1 lần/ngày, 10 bệnh nhân có nồng độ creatinin huyết thanh > 1,5 và < 2,0mg/dL được cho dùng liều 100mg, 1 lần/ngày. (10 bệnh nhân trong số 268 trong nghiên cứu APEX). Febuxostat 240mg đã được sử dụng để đánh giá độ an toàn của febuxostat ở liều gấp hai lần liều cao nhất được khuyến cáo.
Nghiên cứu CONFIRMS: Nghiên cứu CONFIRMS là một nghiên cứu 26 tuần, pha 3, ngẫu nhiên, có đối chứng để đánh giá độ an toàn và hiệu quả của febuxostat 40mg và 80mg so với alopurinol 300mg hoặc 200mg ở những bệnh nhân bị bệnh gút và tăng acid uric huyết. Hai ngàn hai trăm sáu mươi chín (2269) bệnh nhân được chọn ngẫu nhiên: febuxostat 40mg, 1 lần/ngày (n=757), febuxostat 80mg, 1 lần/ngày (n=756), hoặc alopurinol 300/200mg, 1 lần/ngày (n=756). Ít nhất 65% bệnh nhân có suy thận nhẹ-trung bình (có độ thanh thải creatinin 30-89mL/phút). Điều trị dự phòng các đợt bùng phát bệnh gút là bắt buộc trong thời gian 26 tuần.
Tỷ lệ bệnh nhân có nồng độ urat huyết thanh < 6,0mg/dL (357µmol/L) trong lần thăm khám cuối cùng là 45% đối với febuxostat 40mg, 67% đối với febuxostat 80mg và 42% đối với alopurinol 300/200mg, tương ứng.
Tiêu chí đánh giá chính đối với phân nhóm bệnh nhân suy thận: Nghiên cứu APEX đã đánh giá hiệu quả ở 40 bệnh nhân suy thận (ví dụ nồng độ creatinin huyết thanh ban đầu > 1,5mg/dL và ≤ 2,0mg/dL). Đối với các đối tượng suy thận được chọn ngẫu nhiên vào nhóm điều trị bằng alopurinol, liều được giới hạn ở mức 100mg, 1 lần/ngày. Febuxostat đã đạt được tiêu chí đánh giá chính về hiệu quả ở 44% bệnh nhân (80mg, 1 lần/ngày), 45% bệnh nhân (120mg, 1 lần/ngày) và 60% bệnh nhân (240mg, 1 lần/ngày) so với 0% ở nhóm dùng alopurinol 100mg, 1 lần/ngày và nhóm dùng giả dược.
Không có sự khác biệt có ý nghĩa lâm sàng về mức giảm phần trăm đối với nồng độ acid uric huyết thanh ở các đối tượng khỏe mạnh bất kể chức năng thận (58% ở nhóm chức năng thận bình thường và 55% ở nhóm rối loạn chức năng thận nặng).
Phân tích ở những bệnh nhân bị bệnh gút và suy thận được xác định theo thời gian trong nghiên cứu CONFIRMS và cho thấy febuxostat hiệu quả hơn có ý nghĩa trong việc làm giảm nồng độ urat huyết thanh < 6mg/dL so với alopurinol 300mg/200mg ở những bệnh nhân bị bệnh gút kèm suy thận nhẹ đến trung bình (65% bệnh nhân được nghiên cứu).
Tiêu chí đánh giá chính đối với phân nhóm bệnh nhân có nồng độ acid huyết thanh (sUA) ≥ 10mg/dL: Khoảng 40% bệnh nhân (nghiên cứu APEX và FACT kết hợp) có nồng độ acid uric ban đầu ≥ 10mg/dL. Trong phân nhóm này febuxostat đã đạt được tiêu chí đánh giá chính về hiệu quả (nồng độ acid uric huyết thanh (sUA) < 6,0mg/dL trong 3 lần thăm khám cuối cùng) ở 41% bệnh nhân (80mg, 1 lần/ngày), 48% bệnh nhân (120mg, 1 lần/ngày) và 66% bệnh nhân (240mg, 1 lần/ngày) so với 9% ở nhóm dùng alopurinol 300mg/100mg, 1 lần/ngày và 0% ở nhóm dùng giả dược.
Trong nghiên cứu CONFIRMS, tỷ lệ bệnh nhân đạt được tiêu chí chính đánh giá về hiệu quả (nồng độ acid uric huyết thanh (sUA) < 6,0mg/dL trong lần thăm khám cuối cùng) đối với những bệnh nhân có nồng độ urat huyết thanh ban đầu ≥ 10mg/dL được điều trị với febuxostat 40mg, 1 lần/ngày là 27% (66/249), với febuxostat 80mg, 1 lần/ngày là 49% (125/254) và với alopurinol 300mg/200mg, 1 lần/ngày là 31% (72/230), tương ứng.
Kết quả lâm sàng: tỷ lệ bệnh nhân cần phải điều trị đợt bùng phát bệnh gút.
+ Nghiên cứu APEX: Trong thời gian điều trị dự phòng 8 tuần, một tỷ lệ lớn hơn của các đối tượng trong nhóm điều trị bằng febuxostat 120mg (36%) cần phải điều trị đợt bùng phát bệnh gút so với các nhóm điều trị bằng febuxostat 80mg (28%), alopurinol 300mg (23%) và giả dược (20%). Các đợt bùng phát bệnh gút tăng lên sau thời gian điều trị dự phòng và giảm dần theo thời gian. 46% đến 55% đối tượng đã được điều trị các đợt bùng phát bệnh gút từ tuần thứ 8 đến tuần thứ 28. Các đợt bùng phát bệnh gút trong 4 tuần cuối cùng của nghiên cứu (tuần thứ 24-28) đã được quan sát thấy ở 15% đối tượng (febuxostat 80mg, 120mg), 14% đối tượng (alopurinol 300mg) và 20% đối tượng (giả dược).
+ Nghiên cứu FACT: Trong thời gian điều trị dự phòng 8 tuần, một tỷ lệ lớn hơn của các đối tượng trong nhóm điều trị bằng febuxostat 120mg (36%) cần phải điều trị đợt bùng phát bệnh gút so với cả hai nhóm điều trị bằng febuxostat 80mg (22%) và alopurinol 300mg (21%). Sau thời gian điều trị dự phòng 8 tuần, tỷ lệ các đợt bùng phát tăng và giảm dần theo thời gian (64% và 70% đối tượng được điều trị các đợt bùng phát bệnh gút từ tuần thứ 8-52). Các đợt bùng phát bệnh gút trong 4 tuần cuối cùng của nghiên cứu (tuần thứ 49-52) đã được quan sát thấy ở 6-8% đối tượng (febuxostat 80mg, 120mg) và 11% đối tượng (alopurinol 300mg).
Tỷ lệ các đối tượng cần phải điều trị đợt bùng phát bệnh gút (nghiên cứu APEX và FACT) giảm về mặt số lượng ở các nhóm đã đạt được nồng độ urat huyết thanh trung bình sau mức ban đầu < 6,0mg/dL, < 5,0mg/dL hoặc < 4,0mg/dL so với nhóm đạt được nồng độ urat huyết thanh trung bình sau mức ban đầu ≥ 6,0mg/dL trong 32 tuần cuối của thời gian điều trị (các khoảng thời gian tuần thứ 20-24 đến tuần thứ 49-52).
Trong nghiên cứu CONFIRMS, tỷ lệ bệnh nhân cần phải điều trị các đợt bùng phát bệnh gút (ngày thứ 1 đến tháng thứ 6) là 31% đối với nhóm febuxostat 80mg và 25% đối với nhóm alopurinol. Không quan sát thấy sự khác biệt về tỷ lệ bệnh nhân cần phải điều trị các đợt bùng phát bệnh gút giữa nhóm dùng febuxostat 80mg và nhóm dùng febuxostat 40mg.
Các nghiên cứu mở rộng nhãn mở, dài hạn:
+ Nghiên cứu EXCEL (C02-021): Nghiên cứu Excel là một nghiên cứu mở rộng 3 năm về độ an toàn, pha 3, nhãn mở, đa trung tâm, ngẫu nhiên, đối chứng với alopurinol ở những bệnh nhân đã hoàn thành các nghiên cứu pha 3 then chốt (APEX hoặc FACT). Tổng cộng có 1.086 bệnh nhân được đưa vào nghiên cứu: febuxostat 80mg, 1 lần/ngày (n=649), febuxostat 120mg, 1 lần/ngày (n=292) và alopurinol 300/100mg, 1 lần/ngày (n=145). Khoảng 69% bệnh nhân không cần thay đổi điều trị để đạt được điều trị ổn định cuối cùng. Những bệnh nhân có 3 trị số nồng độ acid uric huyết thanh (sUA) liên tiếp > 6mg/dL được rút khỏi nghiên cứu.
Nồng độ urat được duy trì theo thời gian (tức là 91% bệnh nhân điều trị ban đầu bằng febuxostat 80 mg và 93% bệnh nhân điều trị ban đầu bằng febuxostat 120mg có nồng độ acid uric huyết thanh < 6mg/dL ở tháng thứ 36).
Dữ liệu 3 năm cho thấy sự giảm về tỷ lệ các đợt bùng phát bệnh gút với dưới 4% bệnh nhân cần phải điều trị đợt bùng phát (tức là hơn 96% bệnh nhân không cần điều trị đợt bùng phát) ở tháng thứ 16-24 và tháng thứ 30-36.
46% bệnh nhân điều trị ổn định cuối cùng bằng febuxostat 80mg, 1 lần/ngày và 38% bệnh nhân điều trị ổn định cuối cùng bằng febuxostat 120mg, 1 lần/ngày có sự giảm hoàn toàn các sạn urat nguyên phát sờ thấy được từ lúc ban đầu cho đến lần thăm khám cuối cùng.
+ Nghiên cứu FOCUS (TMX-01-005): là một nghiên cứu mở rộng 5 năm về độ an toàn, pha 2, nhãn mở, đa trung tâm, đối với những bệnh nhân đã hoàn thành 4 tuần dùng febuxostat theo phương pháp mù đôi trong nghiên cứu TMX-00-004. 116 bệnh nhân đã được đưa vào nghiên cứu và được điều trị ban đầu bằng febuxostat 80mg, 1 lần/ngày. 62% bệnh nhân không cần điều chỉnh liều để duy trì nồng độ acid uric huyết thanh < 6mg/dL và 38% bệnh nhân cần phải điều chỉnh liều để đạt được liều ổn định cuối cùng.
Tỷ lệ bệnh nhân có nồng độ urat huyết thanh < 6,0mg/dL (357µmol/L) trong lần thăm khám cuối cùng là lớn hơn 80% (81-100%) ở mỗi liều febuxostat.
Trong các nghiên cứu lâm sàng pha 3, đã quan sát thấy các bất thường về xét nghiệm chức năng gan nhẹ ở những bệnh nhân được điều trị bằng febuxostat (5,0%). Tỷ lệ này tương tự như tỷ lệ được báo cáo khi dùng alopurinol (4,2%) (xem phần Cảnh báo). Các trị số TSH tăng (> 5,5μIU/mL) đã được quan sát thấy ở những bệnh nhân điều trị lâu dài bằng febuxostat (5,5%) và những bệnh nhân điều trị bằng alopurinol (5,8%) trong các nghiên cứu mở rộng nhãn mở dài hạn (xem phần Cảnh báo).
Dược động học
Ở các đối tượng khỏe mạnh, nồng độ tối đa trong huyết tương (Cmax) và diện tích dưới đường cong nồng độ trong huyết tương theo thời gian (AUC) của febuxostat tăng tỷ lệ với liều dùng sau khi dùng liều đơn và nhiều liều 10mg đến 120mg. Đối với các liều từ 120mg đến 300mg, đã quan sát thấy một mức tăng lớn hơn sự tăng tỷ lệ với liều dùng về AUC đối với febuxostat. Không có sự tích lũy đáng kể khi dùng liều 10mg đến 240mg mỗi 24 giờ. Febuxostat có thời gian bán thải (t1/2) pha cuối trung bình biểu kiến khoảng 5-8 giờ.
Phân tích dược động học/dược lực học quần thể đã được tiến hành ở 211 bệnh nhân bị tăng acid uric huyết và bệnh gút, được điều trị bằng febuxostat 40-240mg, 1 lần/ngày. Nói chung, các thông số dược động học của febuxostat được ước tính bởi các phân tích này phù hợp với các thông số dược động học đạt được từ các đối tượng khỏe mạnh chỉ ra rằng các đối tượng khỏe mạnh là đại diện cho sự đánh giá dược động học/dược lực học ở nhóm bệnh nhân bị bệnh gút.
+ Hấp thu: Febuxostat được hấp thu nhanh (tmax 1,0-1,5 giờ) và được hấp thu tốt (ít nhất là 84%). Sau khi uống một liều đơn và nhiều liều 80mg và 120mg, 1 lần/ngày, Cmax khoảng 2,8-3,2µg/mL đối với liều 80mg, 1 lần/ngày và 5,0-5,3µg/mL đối với liều 120mg, 1 lần/ngày. Sinh khả dụng tuyệt đối của công thức viên nén febuxostat chưa được nghiên cứu.
Sau khi uống nhiều liều 80mg, 1 lần/ngày hoặc một liều đơn 120mg với bữa ăn có nhiều chất béo, có sự giảm 49% về Cmax đối với liều 80mg và giảm 38% về Cmax đối với liều 120mg, giảm 18% về AUC đối với liều 80mg và giảm 16% về AUC đối với liều 120mg. Tuy nhiên, không quan sát thấy sự thay đổi có ý nghĩa lâm sàng về mức giảm phần trăm đối với nồng độ acid uric huyết thanh khi xét nghiệm (nhiều liều 80mg). Vì vậy febuxostat có thể được dùng không liên quan đến thức ăn.
+ Phân bố: Thể tích phân bố biểu kiến ở trạng thái ổn định (VSS/F) của febuxostat khoảng 29-75 lít sau khi dùng các liều uống 10-300mg. Sự gắn kết của febuxostat với protein huyết tương khoảng 99,2% (chủ yếu là với albumin) và không thay đổi trên phạm vi nồng độ đạt được với liều 80mg và 120mg. Sự gắn kết của các chất chuyển hóa có hoạt tính với protein huyết tương từ khoảng 82% đến 91%.
+ Biến đổi sinh học: Febuxostat được chuyển hóa mạnh do sự liên hợp thông qua hệ thống enzym uridin diphosphat glucuronosyltransferase (UDPGT) và sự oxy hóa thông qua hệ thống cytochrom P450 (CYP). 4 chất chuyển hóa hydroxyl có hoạt tính dược lý đã được xác định, trong đó 3 chất có trong huyết tương người. Các nghiên cứu in vitro với microsom gan người cho thấy những chất chuyển hóa oxy hóa trên được hình thành chủ yếu bởi CYP1A1, CYP1A2, CYP2C8 hoặc CYP2C9 và febuxostat glucuronid được hình thành chủ yếu bởi UGT 1A1, 1A8 và 1A9.
+ Thải trừ: Febuxostat được thải trừ qua cả hai đường gan và thận. Sau khi uống một liều 80mg febuxostat có đánh dấu 14C, khoảng 49% liều dùng được tìm thấy trong nước tiểu dưới dạng febuxostat không thay đổi (3%), acyl acglucuronid của hoạt chất (30%), các chất chuyển hóa oxy hóa đã biết của nó và các chất liên hợp (13%) và các chất chuyển hóa khác chưa được biết (3%). Ngoài sự bài tiết qua nước tiểu, khoảng 45% liều dùng được tìm thấy trong phân dưới dạng febuxostat không thay đổi (12%), acyl glucuronid của hoạt chất (1%), các chất chuyển hóa oxy hóa đã biết của nó và các chất liên hợp (25%) và các chất chuyển hóa khác chưa được biết (7%).
+ Suy thận: Sau khi dùng nhiều liều febuxostat 80mg ở những bệnh nhân suy thận nhẹ, trung bình hoặc nặng, Cmax của febuxostat không thay đổi so với các đối tượng có chức năng thận bình thường. Tổng AUC trung bình của febuxostat tăng khoảng 1,8 lần từ 7,5 μg·giờ/mL ở nhóm có chức năng thận bình thường đến 13,2 μg·giờ/mL ở nhóm rối loạn chức năng thận nặng. Cmax của các chất chuyển hóa tăng 2 lần và AUC của các chất chuyển hóa tăng 4 lần. Tuy nhiên, không cần thiết điều chỉnh liều ở bệnh nhân suy thận nhẹ hoặc trung bình.
+ Suy gan: Sau khi dùng nhiều liều febuxostat 80mg ở những bệnh nhân suy gan nhẹ (Child-Pugh loại A) hoặc trung bình (Child-Pugh loại B), Cmax và AUC của febuxostat và các chất chuyển hóa của nó không thay đổi có ý nghĩa so với các đối tượng có chức năng gan bình thường. Chưa có nghiên cứu nào được thực hiện ở bệnh nhân suy gan nặng (Child-Pugh loại C).
+ Tuổi: Không quan sát thấy sự thay đổi đáng kể về AUC của febuxostat hoặc các chất chuyển hóa của nó sau nhiều liều uống febuxostat ở các đối tượng cao tuổi so với các đối tượng trẻ tuổi khỏe mạnh.
+ Giới tính: Sau khi dùng nhiều liều uống febuxostat, Cmax cao hơn 24% ở nữ so với ở nam và AUC cao hơn 12% ở nữ so với ở nam. Tuy nhiên, Cmax và AUC được điều chỉnh trọng số tương tự giữa các giới tính. Không cần thiết điều chỉnh liều dựa theo giới tính.
An toàn tiền lâm sàng
Các tác dụng trong những nghiên cứu tiền lâm sàng thường được quan sát thấy ở các mức tiếp xúc vượt quá mức tiếp xúc tối đa ở người.
Tính gây ung thư, gây đột biến, suy giảm khả năng sinh sản: Ở chuột cống đực, sự tăng có ý nghĩa thống kê về các khối u bàng quang (u nhú tế bào chuyển tiếp và ung thư biểu mô) được tìm thấy chỉ liên quan với sỏi xanthin ở nhóm dùng liều cao, với mức tiếp xúc gấp khoảng 11 lần mức tiếp xúc ở người. Không có sự tăng có ý nghĩa về bất kỳ loại khối u nào khác ở chuột nhắt đực hoặc cái hay chuột cống đực hoặc cái. Những phát hiện này được xem là hậu quả của sự chuyển hóa purin đặc hiệu loài và thành phần nước tiểu và không có ý nghĩa đối với việc sử dụng trên lâm sàng.
Một loạt thử nghiệm tiêu chuẩn về độc tính gen không cho thấy bất kỳ tác dụng gây độc gen nào có ý nghĩa về mặt sinh học đối với febuxostat.
Febuxostat ở các liều uống lên đến 48mg/kg/ngày đã được tìm thấy không có tác dụng trên khả năng sinh sản và hiệu suất sinh sản của chuột cống đực và cái.
Không có bằng chứng về sự suy giảm khả năng sinh sản, tác dụng gây quái thai hoặc gây tổn hại cho thai do febuxostat. Đã thấy có độc tính đối với chuột mẹ ở liều cao đi kèm với giảm chỉ số cai sữa và giảm sự phát triển của con trên chuột cống ở mức tiếp xúc với thuốc gấp khoảng 4,3 lần mức tiếp xúc ở người. Các nghiên cứu về quái thai được thực hiện ở chuột cống ở mức tiếp xúc gấp khoảng 4,3 lần mức tiếp xúc ở người và thỏ mang thai ở mức tiếp xúc gấp khoảng 13 lần mức tiếp xúc ở người không cho thấy bất kỳ tác dụng gây quái thai nào.
Chỉ định/Công dụng
Điều trị tăng acid uric huyết mạn tính trong các tình trạng đã xảy ra sự lắng đọng urat (bao gồm tiền sử hoặc hiện tại bị sạn urat và/hoặc viêm khớp trong bệnh gút).
FEBURIC được chỉ định ở người lớn.
Liều lượng & Cách dùng
Liều dùng: Liều uống được khuyến cáo của FEBURIC là 80 mg, 1 lần/ngày không liên quan đến thức ăn. Nếu nồng độ acid uric huyết thanh > 6mg/dL (357µmol/L) sau 2-4 tuần, có thể xem xét dùng liều 120 mg, 1 lần/ngày.
FEBURIC tác dụng đủ nhanh để cho phép xét nghiệm lại nồng độ acid uric huyết thanh sau 2 tuần. Mục tiêu điều trị là làm giảm và duy trì nồng độ acid uric huyết thanh dưới 6mg/dL (357μmol/L).
Khuyến cáo nên điều trị dự phòng đợt bùng phát bệnh gút trong ít nhất 6 tháng (xem phần Cảnh báo).
+ Người cao tuổi: Không cần thiết điều chỉnh liều ở người cao tuổi (xem phần Dược động học).
+ Suy thận: Hiệu quả và độ an toàn chưa được đánh giá đầy đủ ở bệnh nhân suy thận nặng (độ thanh thải creatinin < 30mL/phút, xem phần Dược động học). Vì vậy, cần thận trọng khi dùng thuốc ở những bệnh nhân này.
Không cần thiết điều chỉnh liều ở bệnh nhân suy thận nhẹ hoặc trung bình.
+ Suy gan: Hiệu quả và độ an toàn của FEBURIC chưa được nghiên cứu ở bệnh nhân suy gan nặng (Child Pugh loại C).
Liều khuyến cáo ở bệnh nhân suy gan nhẹ là 80 mg. Thông tin hiện có còn hạn chế ở bệnh nhân suy gan trung bình.
+ Nhóm bệnh nhân trẻ em: Độ an toàn và hiệu quả của FEBURIC ở trẻ em dưới 18 tuổi chưa được xác định. Hiện chưa có dữ liệu.
Cách dùng: Nên uống FEBURIC bằng miệng và có thể uống cùng hoặc không cùng với thức ăn.
Cảnh báo
Thuốc này chỉ dùng theo đơn của bác sĩ.
Rối loạn tim mạch: Không khuyến cáo điều trị bằng febuxostat ở những bệnh nhân bị bệnh tim thiếu máu cục bộ hoặc suy tim sung huyết.
Đã quan sát thấy một tỷ lệ lớn hơn về mặt số lượng các biến cố tim mạch theo APTC được báo cáo bởi nhà nghiên cứu (các tiêu chí được xác định bởi nhóm cộng tác thử nghiệm chống tiểu cầu (APTC) bao gồm tử vong tim mạch, nhồi máu cơ tim không gây tử vong, đột quỵ không gây tử vong) trong tổng số nhóm dùng febuxostat so với nhóm dùng alopurinol ở các nghiên cứu APEX và FACT (1,3 biến cố/100 bệnh nhân-năm (PYs) so với 0,3 biến cố/100 bệnh nhân-năm), nhưng không quan sát thấy trong nghiên cứu CONFIRMS (xem phần Dược lực học về đặc điểm chi tiết của nghiên cứu). Tỷ lệ các biến cố tim mạch theo APTC trong các nghiên cứu pha 3 kết hợp được báo cáo bởi nhà nghiên cứu (các nghiên cứu APEX, FACT và CONFIRMS) là 0,7 biến cố/100 bệnh nhân-năm so với 0,6 biến cố/100 bệnh nhân-năm. Trong các nghiên cứu mở rộng dài hạn, tỷ lệ các biến cố theo APTC được báo cáo bởi nhà nghiên cứu là 1,2 biến cố/100 bệnh nhân-năm đối với febuxostat và 0,6 biến cố/100 bệnh nhân-năm đối với alopurinol. Không tìm thấy sự khác biệt có ý nghĩa thống kê và không có mối quan hệ nhân quả nào với febuxostat được xác lập. Các yếu tố nguy cơ được xác định ở những bệnh nhân này là tiền sử y khoa về bệnh xơ vữa động mạch và/hoặc nhồi máu cơ tim hoặc suy tim sung huyết.
Dị ứng/quá mẫn với thuốc: Các báo cáo hiếm gặp về phản ứng dị ứng/quá mẫn nghiêm trọng, bao gồm hội chứng Stevens-Johnson, hoại tử thượng bì nhiễm độc và phản ứng phản vệ/sốc cấp tính đe dọa tính mạng, đã được thu thập trong kinh nghiệm hậu mãi. Trong hầu hết trường hợp, các phản ứng trên xảy ra trong tháng đầu tiên điều trị bằng febuxostat. Một số nhưng không phải tất cả các bệnh nhân này đã báo cáo về suy thận và/hoặc quá mẫn trước đó với alopurinol. Phản ứng quá mẫn nặng, bao gồm phản ứng thuốc có kèm tăng bạch cầu ưa acid và các triệu chứng toàn thân (hội chứng DRESS) có liên quan với sốt, huyết học, thận hoặc gan trong một số trường hợp.
Phải thông báo cho bệnh nhân về các dấu hiệu và triệu chứng và cần theo dõi chặt chẽ các triệu chứng của phản ứng dị ứng/quá mẫn (xem phần Tác dụng ngoại ý). Phải ngừng điều trị bằng febuxostat ngay lập tức nếu xảy ra phản ứng dị ứng/quá mẫn nghiêm trọng, bao gồm hội chứng Stevens-Johnson, vì việc ngừng thuốc sớm liên quan với một tiên lượng tốt hơn. Nếu bệnh nhân xuất hiện phản ứng dị ứng/quá mẫn bao gồm hội chứng Stevens-Johnson và phản ứng và phản vệ/sốc cấp tính, không được bắt đầu sử dụng lại FEBURIC ở bệnh nhân này bất cứ lúc nào.
Cơn gút cấp tính (đợt bùng phát bệnh gút): Không nên bắt đầu điều trị bằng febuxostat cho đến khi cơn gút cấp tính đã giảm xuống hoàn toàn. Các đợt bùng phát bệnh gút có thể xảy ra trong thời gian bắt đầu điều trị do sự thay đổi nồng độ acid uric huyết thanh dẫn đến huy động urat từ sự lắng đọng ở các mô (xem phần Tác dụng ngoại ý và Dược lực học). Lúc bắt đầu điều trị bằng febuxostat, khuyến cáo nên điều trị dự phòng các đợt bùng phát bằng thuốc chống viêm không steroid (NSAID) hoặc colchicin trong ít nhất 6 tháng (xem phần Liều lượng và Cách dùng).
Nếu một đợt bùng phát bệnh gút xảy ra trong khi điều trị bằng febuxostat, không nên ngưng thuốc. Nên xử trí đợt bùng phát bệnh gút đồng thời một cách thích hợp đối với từng bệnh nhân. Việc điều trị liên tục bằng febuxostat làm giảm tần suất và cường độ của các đợt bùng phát bệnh gút.
Lắng đọng xanthin: Ở những bệnh nhân có tỷ lệ hình thành urat tăng cao (ví dụ bệnh ác tính và điều trị của nó, hội chứng Lesch-Nyhan), trong những trường hợp hiếm gặp, nồng độ tuyệt đối của xanthin trong nước tiểu có thể tăng đủ để cho phép sự lắng đọng trong đường tiết niệu. Do chưa có kinh nghiệm với febuxostat, không khuyến cáo sử dụng febuxostat ở nhóm bệnh nhân này.
Mercaptopurin/azathioprin: Không khuyến cáo sử dụng FEBURIC ở những bệnh nhân được điều trị đồng thời bằng mercaptopurin/azathioprin. Trong trường hợp không thể tránh được sự phối hợp này, cần theo dõi bệnh nhân chặt chẽ. Khuyến cáo giảm liều mercaptopurin hoặc azathioprin để tránh những tác dụng về huyết học có thể có (xem phần Tương tác).
Bệnh nhân được ghép tạng: Do chưa có kinh nghiệm ở bệnh nhân được ghép tạng, không khuyến cáo sử dụng FEBURIC ở những bệnh nhân này (xem phần Dược lực học).
Theophylin: Sử dụng đồng thời Febuxostat 80mg và liều đơn theophyllin 400mg cho đối tượng khỏe mạnh không cho thấy bất kỳ sự tương tác nào về mặt dược động học (xem mục Tương tác). Febuxostat 80mg có thể sử dụng cho những bệnh nhân được điều trị đồng thời với theophyllin mà không có nguy cơ làm tăng nồng độ huyết thanh của theophyllin. Không có dữ liệu nghiên cứu cho febuxostat 120mg.
Rối loạn gan: Trong các nghiên cứu lâm sàng pha 3 kết hợp, đã quan sát thấy bất thường về xét nghiệm chức năng gan nhẹ ở những bệnh nhân được điều trị bằng febuxostat (5%). Khuyến cáo xét nghiệm chức năng gan trước khi bắt đầu điều trị bằng febuxostat và định kỳ sau đó dựa trên đánh giá lâm sàng (xem phần Dược lực học).
Rối loạn tuyến giáp: Đã quan sát thấy tăng các trị số hormon kích thích tuyến giáp (TSH (> 5,5µIU/mL) ở những bệnh nhân điều trị lâu dài bằng febuxostat (5,5%) trong các nghiên cứu mở rộng nhãn mở dài hạn. Cần thận trọng khi sử dụng febuxostat ở bệnh nhân có thay đổi chức năng tuyến giáp (xem phần Dược lực học).
Lactose: Viên nén FEBURIC có chứa lactose. Những bệnh nhân có các vấn đề di truyền hiếm gặp về không dung nạp galactose, thiếu hụt Lapp lactase hoặc kém hấp thu glucose-galactose không nên dùng thuốc này.
Tác động trên khả năng lái xe và vận hành máy móc: Buồn ngủ, chóng mặt, dị cảm và nhìn mờ đã được báo cáo với việc sử dụng febuxostat. Bệnh nhân cần thận trọng trước khi lái xe, vận hành máy móc hoặc tham gia vào các hoạt động nguy hiểm cho đến khi họ chắc chắn một cách hợp lý rằng FEBURIC không ảnh hưởng bất lợi đến hiệu năng hoạt động.
Quá Liều
Bệnh nhân bị quá liều cần được xử trí bằng điều trị triệu chứng và điều trị hỗ trợ.
Chống chỉ định
Quá mẫn với hoạt chất hoặc với bất kỳ tá dược nào (xem thêm phần Tác dụng ngoại ý).
Sử dụng ở phụ nữ có thai và cho con bú
• Phụ nữ có thai: Dữ liệu trên một số lượng rất hạn chế các phụ nữ mang thai sử dụng febuxostat đã không cho thấy bất kỳ tác dụng bất lợi nào của febuxostat đối với sự mang thai hoặc đối với sức khỏe của thai/trẻ sơ sinh. Các nghiên cứu trên động vật không cho thấy tác dụng có hại trực tiếp hoặc gián tiếp đến việc mang thai, sự phát triển của phôi/thai hoặc sự sinh đẻ (xem phần An toàn tiền lâm sàng). Chưa rõ các nguy cơ có thể xảy ra đối với người. Không nên sử dụng febuxostat trong thời kỳ mang thai.
• Phụ nữ cho con bú: Chưa rõ liệu febuxostat có được bài tiết vào sữa mẹ hay không. Các nghiên cứu trên động vật đã cho thấy sự bài tiết của hoạt chất này vào sữa mẹ và giảm sự phát triển của con vật bú mẹ. Không thể loại trừ nguy cơ đối với trẻ bú mẹ. Không nên sử dụng febuxostat trong khi cho con bú.
• Khả năng sinh sản: Ở động vật, các nghiên cứu về sinh sản lên đến 48mg/kg/ngày cho thấy không có tác dụng bất lợi nào phụ thuộc liều đối với khả năng sinh sản (xem phần An toàn tiền lâm sàng). Chưa rõ ảnh hưởng của febuxostat đến khả năng sinh sản ở người.
Tương tác
Mercaptopurin/azathioprin: Trên cơ sở cơ chế tác dụng của febuxostat đối với sự ức chế xanthin oxidase (XO), không khuyến cáo sử dụng đồng thời. Sự ức chế xanthin oxidase bởi febuxostat có thể làm tăng nồng độ của các thuốc này trong huyết tương, dẫn đến độc tính (xem phần Cảnh báo). Các nghiên cứu về tương tác thuốc giữa febuxostat với các thuốc được chuyển hóa bởi xanthin oxidase chưa được thực hiện.
Các nghiên cứu về tương tác thuốc giữa febuxostat và hóa trị liệu gây độc tế bào chưa được tiến hành. Chưa có dữ liệu về độ an toàn của febuxostat trong điều trị gây độc tế bào.
Rosiglitazon và cơ chất CYP2C8: Febuxostat được thấy là chất ức chế yếu của trên in vitro. Trong một nghiên cứu trên đối tượng khỏe mạnh, dùng đồng thời 120mg febuxostat QD với uống một liều đơn 4mg rosiglitazone không có ảnh hưởng nào trên dược động học của rosiglitazone và chất chuyển hóa metabolite N-desmethyl rosiglitazon, điều này chỉ ra rằng febuxostat không phải là chất ức chế enzyme CYP2C8 trên in vivo. Bởi vậy, sử dụng đồng thời febuxostat với rosiglitazone và các cơ chất CYP2C8 được cho là không cần phải điều chỉnh liều cho những chế phẩm này.
Theophylin: Một nghiên cứu về tương tác thuốc thực hiện trên những người khỏe mạnh dùng febuxostat để đánh giá xem liệu sự ức chế XO có thể gây ra sự tăng nồng độ theophylline trong tuần hoàn hay không như các chất ức chế XO khác đã được báo cáo trước đây. Kết quả nghiên cứu cho thấy rằng dùng đồng thời febuxostat 80mg QD cùng với liều đơn theophylline 400mg không gây ảnh hưởng đến dược động học hoặc tính an toàn của theophylline. Bởi vậy, không có thận trọng đặc biệt nào được đưa ra khi dùng đồng thời febuxostat 80mg và theophylline. Không có dữ liệu cho febuxostat 120mg.
Naproxen và các chất ức chế sự glucuronid hóa khác: Sự chuyển hóa của febuxostat phụ thuộc vào enzym Uridine Glucuronosyl transferase (UGT). Các thuốc ức chế sự glucuronid hóa như thuốc chống viêm không steroid (NSAID) và probenecid, trên lý thuyết có thể ảnh hưởng đến sự thải trừ febuxostat. Ở các đối tượng khỏe mạnh, sử dụng đồng thời febuxostat và naproxen 250mg, 2 lần/ngày có liên quan với sự tăng mức tiếp xúc với febuxostat (nồng độ tối đa trong huyết tương (Cmax) 28%, diện tích dưới đường cong nồng độ trong huyết tương theo thời gian (AUC) 41% và thời gian bán thải (t1/2 26%). Trong các nghiên cứu lâm sàng, việc sử dụng naproxen hoặc các thuốc ức chế NSAID/Cox-2 khác không liên quan với bất kỳ sự tăng nào về các phản ứng phụ có ý nghĩa lâm sàng.
Febuxostat có thể được sử dụng đồng thời với naproxen mà không cần điều chỉnh liều febuxostat hoặc naproxen.
Thuốc gây cảm ứng sự glucuronid hóa: Các thuốc gây cảm ứng mạnh enzym UGT có thể dẫn đến tăng chuyển hóa và giảm hiệu quả của febuxostat. Vì vậy khuyến cáo nên theo dõi nồng độ acid uric huyết thanh 1-2 tuần sau khi bắt đầu điều trị bằng một thuốc gây cảm ứng mạnh sự glucuronid hóa. Ngược lại, việc ngừng điều trị bằng một thuốc gây cảm ứng có thể dẫn đến tăng nồng độ của febuxostat trong huyết tương.
Colchicin/indomethacin/hydroclorothiazid/warfarin: Febuxostat có thể được sử dụng đồng thời với colchicin hoặc indomethacin mà không cần điều chỉnh liều febuxostat hoặc hoạt chất dùng kết hợp.
Không cần thiết điều chỉnh liều febuxostat khi dùng với hydroclorothiazid.
Không cần thiết điều chỉnh liều warfarin khi dùng với febuxostat. Việc sử dụng febuxostat (80mg hoặc 120mg, 1 lần/ngày) với warfarin không ảnh hưởng đến dược động học của warfarin ở các đối tượng khỏe mạnh. Chỉ số chuẩn hóa quốc tế (INR) và hoạt tính yếu tố VII cũng không bị ảnh hưởng bởi việc dùng đồng thời với febuxostat.
Desipramin/cơ chất CYP2D6: Febuxostat đã cho thấy là một chất ức chế yếu CYP2D6 in vitro. Trong một nghiên cứu ở các đối tượng khỏe mạnh, febuxostat 120mg, 1 lần/ngày (QD) dẫn đến tăng trung bình 22% về AUC của desipramin - một cơ chất của CYP2D6 cho thấy tác dụng ức chế yếu có thể có của febuxostat trên enzym CYP2D6 in vivo. Vì vậy, việc dùng đồng thời febuxostat với các cơ chất của CYP2D6 khác không được cho là sẽ cần bất kỳ sự điều chỉnh liều nào đối với những hợp chất này.
Thuốc kháng acid: Việc uống đồng thời với thuốc kháng acid chứa magnesi hydroxid và hydroxid nhôm đã được chứng minh là làm chậm sự hấp thu của febuxostat (khoảng 1 giờ) và làm giảm Cmax 32% nhưng không quan sát thấy sự thay đổi có ý nghĩa về AUC. Vì vậy, febuxostat có thể được dùng không liên quan đến việc sử dụng thuốc kháng acid.
Tác dụng ngoại ý
Tóm tắt về hồ sơ an toàn: Các phản ứng phụ được báo cáo thường gặp nhất trong các thử nghiệm lâm sàng (4.072 đối tượng được điều trị ít nhất là với liều từ 10 mg đến 300 mg) và trong kinh nghiệm hậu mãi là các đợt bùng phát bệnh gút, bất thường chức năng gan, tiêu chảy, buồn nôn, nhức đầu, ban và phù. Những phản ứng phụ này hầu hết có mức độ nhẹ hoặc trung bình. Các phản ứng quá mẫn nghiêm trọng hiếm gặp với febuxostat, một số phản ứng có liên quan với triệu chứng toàn thân đã xảy ra trong kinh nghiệm hậu mãi.
Bảng liệt kê các phản ứng phụ: Các phản ứng phụ thường gặp (≥1/100 đến <1/10), ít gặp (≥1/1.000 đến <1/100) và hiếm gặp (≥1/10.000 đến <1/1.000) xảy ra ở bệnh nhân điều trị bằng febuxostat được liệt kê dưới đây.
Trong mỗi nhóm tần suất, các phản ứng phụ được trình bày theo thứ tự mức độ nghiêm trọng giảm dần.
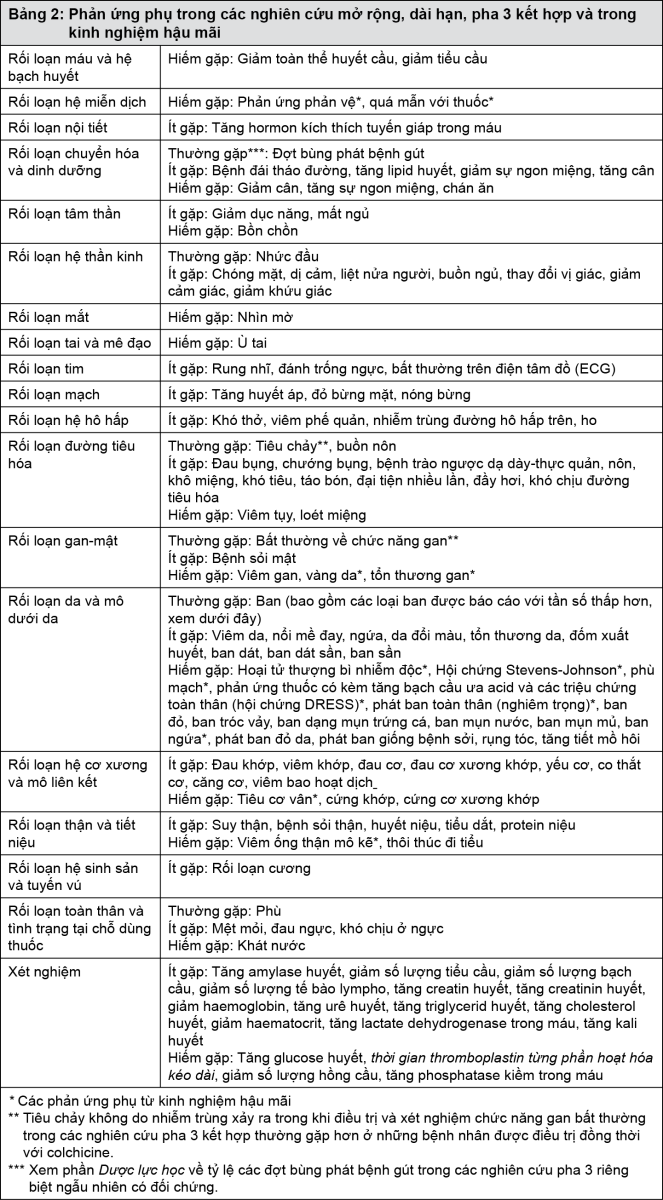
Mô tả các phản ứng phụ chọn lọc: Phản ứng quá mẫn nghiêm trọng hiếm gặp với febuxostat, bao gồm hội chứng Stevens-Johnson, hoại tử thượng bì nhiễm độc và phản ứng phản vệ/sốc, đã xảy ra trong kinh nghiệm hậu mãi. Hội chứng Stevens-Johnson và hoại tử thượng bì nhiễm độc được đặc trưng bởi phát ban da tiến triển đi kèm với bóng nước hoặc tổn thương niêm mạc và kích ứng mắt. Phản ứng quá mẫn với febuxostat có thể liên quan với những triệu chứng sau đây: phản ứng da đặc trưng bởi ban dát sần thâm nhiễm, phát ban toàn thân hoặc tróc vảy, ngoài ra còn có tổn thương da, phù mặt, sốt, bất thường về huyết học như giảm tiểu cầu và bạch cầu ưa acid và liên quan đến một hoặc nhiều cơ quan (gan và thận bao gồm viêm ống thận mô kẽ) (xem phần Cảnh báo).
Các đợt bùng phát bệnh gút thường được quan sát thấy ngay sau khi bắt đầu điều trị và trong những tháng đầu tiên. Sau đó, tần suất các đợt bùng phát bệnh gút theo cách phụ thuộc thời gian. Khuyến cáo điều trị dự phòng bùng phát bệnh gút (xem phần Liều lượng và Cách dùng và Cảnh báo).
Bảo quản
Bảo quản dưới 30oC.
Phân loại ATC
M04AA03 - febuxostat
Trình bày/Đóng gói
Viên nén bao film: hộp 3 vỉ x 10 viên.
- Abacavir
- Abernil
- Abiiogran
- Acarbose
- ACC
- Acebutolol
- Acenocoumarol
- Acetate Ringer's
- Acetazolamide
- Acetylcystein
- Acetylsalicylic acid
- Aciclovir
- Acid acetylsalicylic
- Acid aminocaproic
- Acid ascorbic
- Acid boric
- Acid chenodeoxycholic
- Acid ethacrynic
- Acid folic
- Acid fusidic
- Acid iopanoic
- Acid ioxaglic
- Acid nalidixic
- Acid pantothenic
- Acid para-aminobenzoic
- Acid salicylic
- Acid tranexamic
- Acid valproic
- Acid zoledronic
- Acitretin
- Aclasta
- Aclon
- Actapulgite
- Actelsar
- Actelsar HCT
- Actemra
- Actilyse
- Acular
- Acupan
- Acuvail
- Acyclovir STADA
- Acyclovir STADA Cream
- Adalat
- Adenosin
- Adenosin Ebewe
- Adipiodon
- Advagraf
- Aerius
- Afinitor
- Agicarvir
- Agifovir-E
- Agilosart
- Agilosart-H
- Agimepzol
- Agimosarid
- Agimstan
- Agimstan-H
- Agiremid
- Agivastar
- Aibezym
- Air-X
- Alaxan
- Albendazol
- Albiomin
- Albumin
- Albumin người Grifols 20%
- Albuminar
- AlbuRx
- Albutein
- Alcuronium chloride
- Aldesleukin
- Alendronat
- Alertin
- Alfa-Lipogamma 600 Oral
- Alfuzosin hydrochlorid
- Algotra
- Alimemazin
- Alimta
- Allipem
- Allopurinol
- Allopurinol STADA
- Aloxi
- Alprazolam
- Alpha Chymotrypsin
- Alpha tocopherol
- Alphachymotrypsin Glomed
- Alphagan-P
- Aluvia
- Alzental
- Amaryl
- Ambroco
- Ambroxol
- Amcinol-Paste
- Amigold
- Amikacin
- Aminocaproic acid
- Aminoleban
- Aminoleban Oral
- Aminosteril N-Hepa
- Amiparen
- Amitriptyline
- Amiyu
- Amlodipine
- Amlor
- Amoxicillin
- Amoxicillin & clavulanate
- Ampicillin
- Amquitaz
- Anaferon for children
- Anargil
- Anaropin
- Andriol Testocaps
- Anepzil
- Anyfen
- Apaisac
- Apidra SoloStar
- Apitim 5
- Aprovel
- Aquaphil
- Arcalion
- Arcoxia
- Aricept Evess
- Arimidex
- Arnetine
- Artrodar
- A-Scabs
- Ascorbic acid
- Asperlican/Candinazol
- Aspilets EC
- Aspirin
- Asthmatin
- Atelec
- Atocib 120
- Atocib 90
- Atosiban PharmIdea
- Atozet
- Attapulgite
- Atussin
- Atropin
- Augbactam
- Augmentin Sachet
- Augmentin SR
- Augmentin Tablets
- Augmex
- Avamys
- Avastin
- Avelox Dịch truyền
- Avelox Viên nén
- Avodart
- Axcel Cefaclor-125 Suspension
- Axcel Cetirizine Syrup
- Axcel Chlorpheniramine
- Axcel Dexchlorpheniramine
- Axcel Dicyclomine-S Syrup
- Axcel Diphenhydramine Paediatric Syrup
- Axcel Erythromycin ES
- Axcel Eviline
- Axcel Fungicort Cream
- Axcel Fusidic acid Cream
- Axcel Fusidic acid-B Cream
- Axcel Hydrocortisone Cream
- Axcel Lignocaine 2% Sterile Gel
- Axcel Loratadine
- Axcel Miconazole Cream
- Axcel Paracetamol
- Axcel Urea Cream
- Axitan
- Azenmarol
- Azicine
- Aziphar
- Azithromycin





