Nhà sản xuất
Novartis Pharma
Thành phần
Uperio 50mg Mỗi viên: Sacubitril 24,3mg, valsartan 25,7mg (dưới dạng muối phức hợp sacubitril valsartan natri 56,551mg).
Uperio 100mg Mỗi viên: Sacubitril 48,6mg, valsartan 51,4mg (dưới dạng muối phức hợp sacubitril valsartan natri 113,103mg).
Uperio 200mg Mỗi viên: Sacubitril 97,2mg, valsartan 102,8mg (dưới dạng muối phức hợp sacubitril valsartan natri 226,206mg).
Mô tả
Uperio 50mg: Viên bao phim màu tím nhạt hai mặt lồi với các cạnh vát, khắc chìm chữ “NVR” trên một mặt và “LZ” trên mặt còn lại.
Uperio 100mg: Viên bao phim màu vàng nhạt hai mặt lồi với các cạnh vát, khắc chìm chữ “NVR” trên một mặt và “L1” trên mặt còn lại.
Uperio 200mg: Viên bao phim màu hồng nhạt hai mặt lồi với các cạnh vát, khắc chìm chữ “NVR” trên một mặt và “L11” trên mặt còn lại.
Dược lý
Nhóm điều trị: Các tác nhân hoạt động trên hệ thống renin-angiotensin; Angiotensin II, dạng kết hợp khác.
Mã ATC: C09DX04
Cơ chế tác dụng
Uperio ức chế theo cơ chế tác dụng mới của chất ức chế thụ thể angiotensin neprilysin (ARNI) bằng cách ức chế đồng thời neprilysin (endopeptidase trung tính; NEP) thông qua LBQ657 - là chất chuyển hóa có hoạt tính của tiền thuốc sacubitril và bằng cách ức chế thụ thể angiotensin II typ 1 (AT1) của valsartan. Hiệu quả bổ trợ trên tim mạch và tác dụng trên thận của Uperio trên bệnh nhân suy tim là do LBQ657 làm tăng nồng độ các peptid bị phân hủy bởi neprilysin như natriuretic peptides (NP) và tác dụng ức chế đồng thời tác dụng bất lợi của angiotensin II bởi valsartan. Các NP thể hiện tác dụng thông qua hoạt hóa thụ thể guanylyl cyclase gắn trên màng dẫn đến làm tăng nồng độ các guanosin monophosphat vòng truyền tin thứ cấp (cGMP), do đó thúc đẩy sự giãn mạch, tăng thải trừ natri và lợi niệu, tăng tốc độ lọc cầu thận và tăng lưu lượng máu qua thận, ức chế giải phóng renin và aldosteron, giảm hoạt động giao cảm, tác dụng chống phì đại và chống xơ hóa. Hoạt hóa kéo dài hệ renin-angiotensin-aldosteron dẫn đến co mạch, giữ nước và muối ở thận, kích hoạt sự sinh trưởng và nhân lên của tế bào và hậu quả gây tái cấu trúc thích nghi. Valsartan ức chế tác động có hại trên tim mạch và trên thận của angiotensin 2 bằng cách ức chế chọn lọc thụ thể AT1, đồng thời ức chế giải phóng aldosteron phụ thuộc angiotensin II.
Tác dụng dược lực học
Tác dụng dược lực học của Uperio được đánh giá sau khi dùng liều đơn và liều lặp lại trên người tình nguyện khỏe mạnh và bệnh nhân suy tim phù hợp với tác dụng ức chế đồng thời neprilysin và hệ renin-angiotensin-aldosteron. Trong một nghiên cứu 7 ngày có đối chứng với valsartan trên bệnh nhân giảm phân suất tống máu (HFrEF), sử dụng Uperio dẫn đến sự gia tăng có ý nghĩa nhưng không bền sự bài tiết natri niệu, tăng GMP vòng trong nước tiểu và làm giảm MR-proANP và NT-proBNP trong huyết tương so với valsartan. Trong một nghiên cứu 21 ngày trên bệnh nhân có phân suất tống máu giảm, Uperio làm giảm có ý nghĩa ANP và GMP vòng trong nước tiểu, GMP vòng trong huyết tương, giảm NT-proBNP, aldosteron và endothelin-1 trong huyết tương so với trước điều trị. Uperio cũng ức chế thụ thể AT1 thông qua việc làm giảm hoạt tính và nồng độ renin huyết tương. Trong nghiên cứu PARADIGM-HF, Uperio làm giảm NT-proBNP huyết tương và tăng BNP huyết tương, GMP vòng trong nước tiểu so với enalapril. Trong khi BNP là một cơ chất của neprilysin thì NT-proBNP không phải là cơ chất của neprilysin. Do đó, NT-proBNP (chứ không phải BNP) là một chất chỉ điểm sinh học thích hợp để theo dõi bệnh nhân suy tim được điều trị bằng Uperio.
Trong một nghiên cứu lâm sàng đánh giá khoảng toàn diện QTc thực hiện trên người tình nguyện khỏe mạnh là nam giới dùng liều đơn 400 mg và 1200 mg cho thấy Uperio không có tác động trên sự tái cực cơ tim.
Neprilysin là một trong số nhiều enzym tham gia vào thanh thải amyloid-β (Aβ) từ não và dịch não tủy. Sử dụng Uperio 400 mg một lần/ngày trong 2 tuần trên người tình nguyện khỏe mạnh làm tăng nồng độ Aβ 1-38 trong dịch não tủy so với dùng giả dược; không có sự thay đổi về nồng độ Aβ 1-40 và 1-42 trong dịch não tủy. Ý nghĩa lâm sàng của kết quả này hiện chưa được biết rõ (xem mục An toàn tiền lâm sàng).
Dược động học
Hấp thu
Sau khi dùng đường uống, Uperio giải phóng sacubitril, chất này sau đó được chuyển hóa thành LBQ657, và valsartan. Các chất này đạt nồng độ đỉnh trong huyết tương tương ứng sau 0,5 giờ, 2 giờ và 1,5 giờ. Sinh khả dụng tuyệt đối đường uống của sacubitril và valsartan ước tính tương ứng ≥ 60% và 23%.
Sau khi dùng liều Uperio hai lần/ngày, nồng độ của sacubitril, LBQ657 và valsartan đạt trạng thái ổn định trong vòng 3 ngày. Ở trạng thái ổn định, sacubitril và valsartan không tích lũy khác biệt rõ rệt, trong khi tích lũy LBQ657 tăng 1,6 lần. Sử dụng Uperio cùng với thức ăn không ảnh hưởng có ý nghĩa trên lâm sàng đến nồng độ của sacubitril, LBQ657 và valsartan trong tuần hoàn. Mặc dù có sự giảm nồng độ của valsartan trong tuần hoàn khi dùng Uperio cùng với thức ăn, việc giảm này không kèm theo việc giảm tác dụng điều trị trên lâm sàng. Do đó, Uperio có thể dùng cùng hoặc không cùng với thức ăn.
Phân bố
Uperio liên kết mạnh với protein huyết tương (94%-97%). Qua so sánh nồng độ trong huyết tương và trong dịch não tủy, LBQ657 qua hàng rào máu não với mức độ hạn chế (0,28%). Uperio có thể tích phân bố biểu kiến dao động từ 75L đến 103 L.
Chuyển hóa sinh học/Chuyển hóa
Sacubitril dễ chuyển thành LBQ657 bởi các men esterase; LBQ657 sau đó không được tiếp tục chuyển hóa với mức độ đáng kể. Valsartan được chuyển hóa ở mức độ tối thiểu, chỉ khoảng 20% liều được tìm thấy dưới dạng chất chuyển hóa. Chất chuyển hóa dạng hydroxyl hóa được xác định ở nồng độ thấp trong huyết tương (< 10%). Do sacubitril và valsartan ít chuyển hóa qua trung gian CYP450, sử dụng đồng thời thuốc này với các loại thuốc tác động trên hệ CYP450 không gây ảnh hưởng đến dược động học của thuốc.
Thải trừ
Sau khi dùng đường uống, 52%-68% sacubitril (chủ yếu dưới dạng LBQ657) và khoảng 13% valsartan và các chất chuyển hóa của nó được thải trừ qua nước tiểu; 37%-48% sacubitril (chủ yếu dưới dạng LBQ657) và 86% valsartan và các chất chuyển hóa của nó thải trừ qua phân.
Sacubitril, LBQ657 và valsartan được thải trừ khỏi huyết tương với thời gian bán thải trung bình (t1/2) tương ứng khoảng 1,43 giờ, 11,48 giờ và 9,90 giờ.
Tuyến tính/Không tuyến tính
Dược động học của sacubitril, LBQ657 và valsartan tuyến tính trong khoảng liều thử nghiệm (50-400 mg Uperio).
Quần thể đặc biệt
Bệnh nhân cao tuổi
Nồng độ LBQ657 và valsartan tăng ở các đối tượng trên 65 tuổi theo thứ tự là 42% và 30% so với các đối tượng trẻ hơn.
Suy giảm chức năng thận
Một sự tương quan đã được quan sát thấy giữa chức năng thận và nồng độ LBQ657 toàn thân ở những bệnh nhân suy thận nhẹ đến nặng. Nồng độ LBQ657 ở những bệnh nhân suy thận trung bình (30mL/phút/1,73m2 ≤ eGFR < 60mL/phút/1,73m2) và suy thận nặng (15mL/phút/1,73m2 ≤ eGFR < 30mL/phút/1,73m2) cao hơn gấp 1,4 lần và 2,2 lần so với những bệnh nhân suy thận nhẹ (60 mL/phút/1,73m2 ≤ eGFR < 90mL/phút/1,73m2) - nhóm bệnh nhân lớn nhất tham gia vào nghiên cứu PARADIGM-HF. Nồng độ valsartan tương tự ở những bệnh nhân suy thận trung bình và nặng so với những bệnh nhân suy thận nhẹ. Chưa có nghiên cứu nào được thực hiện ở những bệnh nhân đang được thẩm phân. Tuy nhiên, LBQ657 và valsartan gắn kết cao với protein huyết tương và do đó không được loại bỏ hiệu quả bằng thẩm phân.
Suy giảm chức năng gan
Ở những bệnh nhân suy gan nhẹ đến trung bình, nồng độ sacubitril tăng theo thứ tự gấp 1,5 lần và 3,4 lần, LBQ657 tăng gấp 1,5 lần và 1,9 lần, và valsartan tăng gấp 1,2 lần và 2,1 lần so với các đối tượng khỏe mạnh phù hợp. Tuy nhiên, ở những bệnh nhân suy gan nhẹ đến trung bình, nồng độ LBQ657 tự do tăng theo thứ tự gấp 1,47 lần và 3,08 lần, và nồng độ valsartan tự do tăng theo thứ tự là 1,09 lần và 2,20 lần so với các đối tượng khỏe mạnh phù hợp. Uperio chưa được nghiên cứu ở những bệnh nhân suy gan nặng, xơ gan mật hoặc ứ mật (xem phần Chống chỉ định và Cảnh báo).
Bệnh nhi (dưới 18 tuổi)
Uperio không nghiên cứu trên bệnh nhi.
Nhóm chủng tộc
Dược động học của Uperio (sacubitril, LBQ657 và valsartan) không có sự khác biệt giữa các chủng tộc và các nhóm dân tộc khác nhau (người da trắng, người da đen, người châu Á, Nhật Bản và các nước khác).
Ảnh hưởng của giới tính
Dược động học của Uperio (sacubitril, LBQ657 và valsartan) không có sự khác biệt trên phụ nữ và nam giới.
CÁC NGHIÊN CỨU LÂM SÀNG
PARADIGM-HF
Nghiên cứu PARADIGM-HF là một nghiên cứu đa quốc gia, ngẫu nhiên, mù đôi so sánh Uperio và enalapril, được thực hiện trên 8442 bệnh nhân. Cả hai thuốc được sử dụng trên người lớn bị suy tim mạn tính, phân loại NYHA II-IV, có rối loạn chức năng tâm thu (phân suất tống máu tâm thất trái ≤ 40%), trên nền các điều trị suy tim khác. Tiêu chí đánh giá chính là tỷ lệ tử vong do các bệnh tim mạch (CV) hoặc nhập viện do suy tim.
Trước khi tham gia vào nghiên cứu, bệnh nhân đã được điều trị tốt bằng các phác đồ điều trị chuẩn bao gồm các thuốc ức chế men chuyển hoặc thuốc ức chế thụ thể angiotensin (> 99%), các thuốc chẹn beta (94%), các thuốc kháng aldosterone (58%) và các thuốc lợi tiểu (83%). Thời gian theo dõi trung bình là 27 tháng và bệnh nhân được điều trị tới 4,3 năm.
Bệnh nhân được yêu cầu ngừng điều trị bằng các thuốc ức chế men chuyển hoặc thuốc ức chế thụ thể angiotensin và tham gia vào giai đoạn khởi động điều trị mù đơn, trong đó bệnh nhân được điều trị bằng enalapril 10 mg hai lần/ngày, sau đó điều trị bằng Uperio 100 mg hai lần/ngày, tăng lên đến 200 mg hai lần/ngày. Bệnh nhân sau đó được phân nhóm ngẫu nhiên vào giai đoạn mù đôi của nghiên cứu, hoặc dùng Uperio 200mg hoặc enalapril 10 mg hai lần/ngày [Uperio (n=4.209); enalapril (n=4.233)].
Tuổi trung bình của quần thể nghiên cứu là 64 tuổi và 19% từ 75 tuổi trở lên. Tại thời điểm phân nhóm ngẫu nhiên, 70% bệnh nhân suy tim theo phân loại NYHA ở mức độ II và 25% ở mức độ III/IV.
Trong nhóm dùng Uperio, 76% bệnh nhân duy trì liều đích 200 mg hai lần/ngày cho đến khi kết thúc nghiên cứu (liều hàng ngày trung bình 375 mg). Trong nhóm dùng enalapril, 75% bệnh nhân duy trì liều đích 10 mg hai lần/ngày cho đến khi kết thúc nghiên cứu (liều trung bình hàng ngày là 18,9 mg).
Uperio đã chứng minh tính vượt trội có ý nghĩa lâm sàng và có ý nghĩa thống kê so với enalapril, làm giảm 20% nguy cơ tử vong do các bệnh tim mạch hoặc nhập viện do suy tim (tỷ số nguy cơ (Hazard Ratio): 0,80, khoảng tin cậy (CI) 95% [0,73; 0,87], p một phía = 0,0000002) so với enalapril. Tác dụng này được quan sát thấy sớm và được duy trì trong thời gian thử nghiệm. Độ giảm nguy cơ tuyệt đối ARR là 4,69%. Ghi nhận giảm có ý nghĩa thống kê của tỷ lệ tử vong do các bệnh tim mạch và tỷ lệ nhập viện lần đầu do suy tim (tỷ lệ tử vong do các bệnh tim mạch, RRR 20%, HR 0,80; CI 95% [0,71; 0,89], p một phía = 0,00004; và nhập viện do suy tim RRR 21%; HR 0,79; CI 95% [0,71; 0,89], p một phía = 0,00004); xem Bảng 1 và Hình 1. Đột tử chiếm 45% số lượng ca tử vong do bệnh tim mạch và đã giảm 20% trong nhóm bệnh nhân được điều trị bằng Uperio so với nhóm bệnh nhân điều trị bằng enalapril (HR 0,80, p=0,0082). Suy giảm chức năng tống máu chiếm 26% số lượng ca tử vong do các bệnh tim mạch và đã giảm 21% trong nhóm bệnh nhân điều trị bằng Uperio so với nhóm bệnh nhân điều trị bằng enalapril (HR 0,79; p=0,0338).
Sự giảm nguy cơ này được ghi nhận nhất quán trong các phân nhóm bao gồm: tuổi, giới, chủng tộc, vùng địa lý, phân loại NYHA, phân suất tống máu, chức năng thận, tiền sử đái tháo đường hoặc tăng huyết áp, điều trị suy tim trước đó và rung nhĩ. Uperio cũng làm giảm có ý nghĩa 16% tỷ lệ tử vong do mọi nguyên nhân so với enalapril (RRR 16%, HR 0,84; CI 95% [0,76 đến 0,93], p một phía = 0,0005) (Bảng 1). Độ giảm nguy cơ tuyệt đối ARR là 2,84%.
- xem Bảng 1.
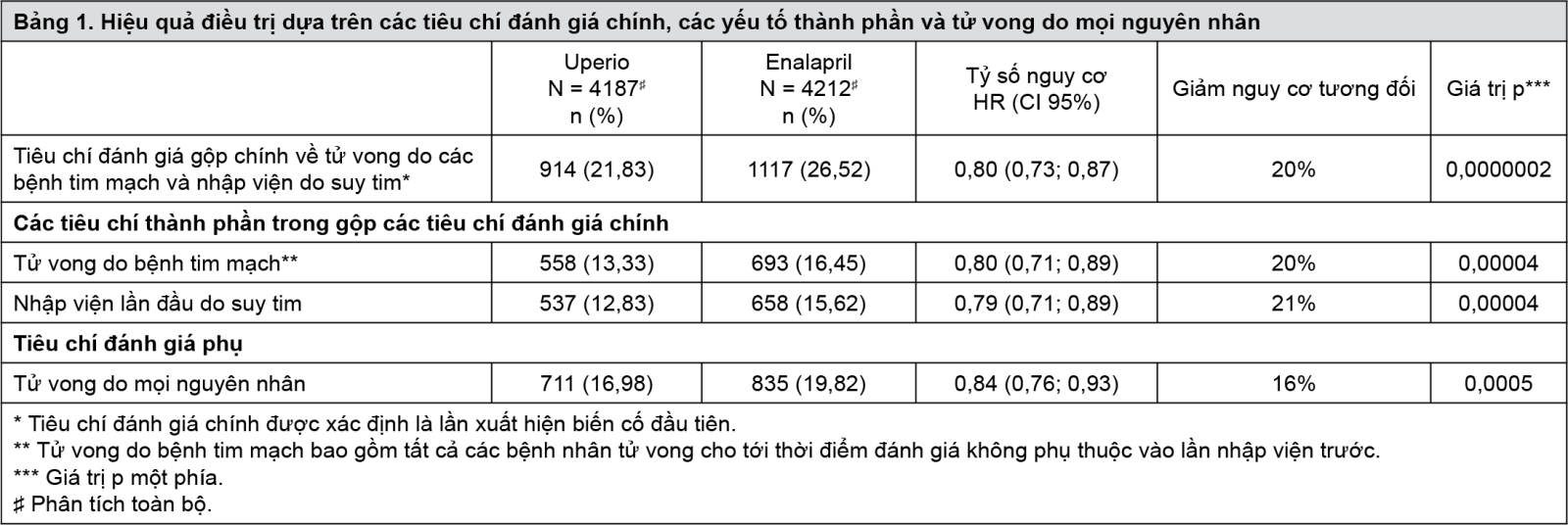
Đường cong Kaplan-Meier được trình bày trong Hình 1 (bên trái) cho thấy thời gian để xuất hiện tiêu chí đánh giá chính là tử vong do bệnh tim mạch hoặc nhập viện do suy tim. Hiệu quả điều trị của Uperio thể hiện sớm và duy trì trong thời gian nghiên cứu. Đường cong Kaplan-Meier được trình bày dưới đây (bên phải) cho thấy thời gian xuất hiện tử vong do bệnh tim mạch.
- xem Hình 1.
Nhìn chung, tỷ lệ nhập viện do mọi nguyên nhân thấp hơn trên nhóm bệnh nhân điều trị bằng Uperio so với enalapril, bao gồm giảm 12% nguy cơ tương đối cho lần nhập viện đầu tiên (HR 0,88 [CI 95%: 0,82; 0,94], P<0,001) và giảm 16% nguy cơ tương đối số lần nhập viện (RR 0,84 [CI 95%: 0,78; 0,91], P<0,001).
Khi đánh giá theo bộ câu hỏi tự trả lời KCCQ (Kansas City Cardiomyopathy Questionnaire), Uperio đã cho thấy tổng điểm lâm sàng tốt hơn có ý nghĩa liên quan đến các triệu chứng suy tim và hạn chế về mặt vận động thể lực được. Số bệnh nhân có cải thiện bệnh theo phân loại NYHA từ thời điểm trước điều trị đến tháng thứ 8 cao hơn trên nhóm bệnh nhân dùng Uperio (16%) so với nhóm bệnh nhân dùng enalapril (14%), và ít bệnh nhân bị tiến triển suy tim nặng hơn theo phân loại NYHA (10% so với 13% ở hai nhóm tương ứng).
Nghiên cứu TITRATION
Nghiên cứu TITRATION là một nghiên cứu về tính an toàn và khả năng dung nạp kéo dài 12 tuần trên 538 bệnh nhân bị suy tim mạn tính (phân loại NYHA độ II-IV) có rối loạn chức năng tâm thu (phân suất tống máu tâm thất trái ≤ 35%) chưa được điều trị bằng các thuốc ức chế men chuyển hoặc thuốc ức chế thụ thể angiotensin hoặc đang thay đổi liều các thuốc ức chế ACE hoặc ARB trước khi tham gia vào nghiên cứu. Bệnh nhân bắt đầu dùng Uperio 50 mg hai lần/ngày, được điều chỉnh lên 100 mg hai lần/ngày và sau đó đến liều đích 200 mg hai lần/ngày trong vòng 3 hoặc 6 tuần.
Nhìn chung, 76% bệnh nhân đạt đến và duy trì liều đích Uperio 200 mg hai lần/ngày mà không phải ngừng thuốc hoặc giảm liều trong 12 tuần. Số bệnh nhân chưa được điều trị bằng các thuốc ức chế men chuyển hoặc thuốc ức chế thụ thể angiotensin trước đó hoặc điều trị ở liều thấp (tương đương < 10 mg enalapril/ngày) đạt được và duy trì Uperio 200mg khi tăng liều trong vòng 6 tuần nhiều hơn so với 3 tuần.
Nghiên cứu PARAMOUNT
Nghiên cứu PARAMOUNT là một nghiên cứu lâm sàng ngẫu nhiên, mù đôi trên bệnh nhân có phân suất tống máu tâm thất trái ≥ 45% so sánh giữa bệnh nhân dùng Uperio 200mg (n=149) so với valsartan 160 mg (n=152) hai lần/ngày. Nghiên cứu đã chứng minh thuốc làm giảm tỷ lệ NT pro-BNP lớn hơn có ý nghĩa thống kê từ lúc ban đầu cho đến tuần thứ 12. Tỷ lệ giảm NT-proBNP so với ban đầu tương tự ở tuần thứ 12 và 36 trong nhóm bệnh nhân được điều trị bằng Uperio, trong khi NT-proBNP giảm từ tuần 12 đến tuần 36 trong nhóm bệnh nhân điều trị bằng valsartan. Sự giảm có ý nghĩa kích thước nhĩ trái, bao gồm cả thể tích nhĩ trái (p=0,0069) và đường kính nhĩ trái (p=0,0337) đã được ghi nhận ở tuần 36. Sự cải thiện có ý nghĩa thống kê về mức độ bệnh theo NYHA đã được ghi nhận ở tuần thứ 36 (p=0,0488).
An toàn tiền lâm sàng
Các nghiên cứu về tính an toàn tiền lâm sàng được thực hiện với Uperio bao gồm đánh giá tính an toàn dược lý, độc tính liều lặp lại, độc tính trên gen, khả năng gây ung thư độc tính trên sinh sản và phát triển của Uperio cho thấy không có ảnh hưởng bất lợi trên các cơ quan sinh tồn. Các nghiên cứu độc tính liều lặp lại cho thấy, hầu hết các tác dụng ngoại ý có khả năng hồi phục và chủ yếu liên quan đến tác dụng dược lý ức chế thụ thể AT1 của thuốc.
Khả năng gây ung thư, đột biến gen và độc tính trên gen
Các nghiên cứu về khả năng gây ung thư được thực hiện trên chuột nhắt và chuột cống với sacubitril và valsartan không phát hiện thấy bất cứ khả năng gây ung thư nào của Uperio. Liều sacubitril được nghiên cứu (liều cao 1200 và 400 mg/kg/ngày tương ứng trên chuột nhắt và chuột cống) gấp khoảng 29 và 19 lần liều dùng tối đa được khuyến cáo trên người tính theo đơn vị mg/m2. Liều valsartan được nghiên cứu (liều cao 160 và 200 mg/kg/ngày tương ứng trên chuột nhắt và chuột cống) gấp khoảng 4 và 10 lần liều dùng tối đa được khuyến cáo trên người tính theo đơn vị mg/m2.
Các nghiên cứu đột biến gen và đứt gẫy chromosome được thực hiện với Uperio, sacubitril và valsartan không cho thấy tác động cả trên gen và nhiễm sắc thể.
Khả năng sinh sản và phát triển
Uperio không cho thấy bất cứ ảnh hưởng nào trên khả năng sinh sản trên chuột cống với liều lên đến 150 mg/kg/ngày (≤ 1,0 lần và ≤ 0,18 lần liều dùng tối đa hàng ngày được khuyến cáo trên người tương ứng dựa trên AUC của valsartan và LBQ657).
Điều trị bằng Uperio trong giai đoạn hình thành các cơ quan dẫn đến tăng tỷ lệ tử vong của thai nhi trên chuột cống ở mức liều ≥ 100 mg/kg/ngày [≤ 0.72 lần liều dùng tối đa hàng ngày được khuyến cáo trên người dựa trên AUC] và trên thỏ ở mức liều ≥ 10 mg/kg/ngày [2 lần và 0.03 lần liều dùng tối đa hàng ngày được khuyến cáo trên người tương ứng dựa trên AUC của valsartan và LBQ657]. Khi dùng Uperio với mức liều ≥ 10 mg/kg/ngày trên thỏ, quan sát thấy tính gây quái thai của Uperio căn cứ trên tỷ lệ thấp não úng thủy của thai nhi có liên quan đến liều độc trên cơ thể mẹ đã được. Tác động bất lợi trên bào thai-thai nhi của Uperio là do tác dụng đối kháng thụ thể angiotensin (xem mục Sử dụng ở phụ nữ có thai và cho con bú).
Các nghiên cứu về sự phát triển trước và sau khi sinh trên chuột cống được thực hiện với sacubitril ở liều lên đến 750 mg/kg/ngày [2,2 lần liều dùng tối đa hàng ngày được khuyến cáo trên người dựa trên AUC] và valsartan ở liều lên đến 600 mg/kg/ngày [0,86 lần liều dùng tối đa hàng ngày được khuyến cáo trên người dựa trên UC] cho thấy điều trị bằng Uperio trong giai đoạn hình thành các cơ quan, mang thai và cho con bú có thể ảnh hưởng đến sự phát triển và khả năng sống của thai nhi.
Các kết quả nghiên cứu tiền lâm sàng khác
Ảnh hưởng của Uperio trên nồng độ amyloid-β trong dịch não tủy và mô não được đánh giá trên khỉ đuôi dài (2-4 tuổi) dùng Uperio (50 mg/kg/ngày) trong 2 tuần. Trong nghiên cứu này, Uperio có tác dụng dược lực trên độ thanh thải Aβ trong dịch não tủy, tăng nồng độ Aβ 1-40, 1-42 và 1-38 trong dịch não tủy, tuy nhiên không tương ứng với mức tăng nồng độ Aβ trong não. Không ghi nhận được sự tăng Aβ 1-40 và 1-42 trong dịch não tủy trong một nghiên cứu kéo dài 2 tuần trên người tình nguyện khỏe mạnh (xem mục Dược lý). Hơn nữa, trong nghiên cứu độc tính trên khỉ đuôi dài dùng Uperio ở mức liều 300 mg/kg/ngày trong 39 tuần, không ghi nhận sự tích lũy amyloid-β trong não.
Chỉ định/Công dụng
Uperio được chỉ định điều trị suy tim có triệu chứng ở bệnh nhân có rối loạn chức năng tâm thu. Uperio đã được chứng minh làm giảm tỷ lệ tử vong do bệnh tim mạch và nhập viện do suy tim so với enalapril.
Uperio cũng cho thấy làm giảm tỷ lệ tử vong do mọi nguyên nhân so với enalapril.
Liều lượng & Cách dùng
Liều mục tiêu của Uperio là 200 mg, hai lần/ngày.
Liều khởi đầu được khuyến cáo của Uperio là 100 mg, hai lần/ngày. Liều khởi đầu 50 mg dùng hai lần/ngày được khuyến cáo cho bệnh nhân đang không sử dụng các thuốc ức chế men chuyển angiotensin (ACE) hoặc thuốc chẹn thụ thể angiotensin II (ARB) và được cân nhắc dùng cho bệnh nhân trước đây đã dùng các thuốc này ở liều thấp (xem mục Các nghiên cứu lâm sàng).
Nên tăng gấp đôi liều của Uperio sau mỗi 2-4 tuần đến liều mục tiêu 200 mg dùng 2 lần/ngày tùy theo sự dung nạp của bệnh nhân.
Do nguy cơ phù mạch tăng lên khi dùng đồng thời với thuốc ức chế men chuyển, không nên bắt đầu dùng Uperio trong vòng 36 giờ sau khi ngừng điều trị bằng thuốc ức chế men chuyển (xem mục Chống chỉ định).
Không nên dùng đồng thời Uperio với thuốc chẹn thụ thể angiotensin II do tác dụng chẹn thụ thể angiotensin II của Uperio (xem mục Cảnh báo và mục Tương tác).
Nếu bệnh nhân gặp các vấn đề về khả năng dung nạp (huyết áp tâm thu [SBP] ≤ 95mmHg, hạ huyết áp triệu chứng, tăng kali máu, rối loạn chức năng thận), khuyến cáo điều chỉnh liều các thuốc dùng đồng thời, chuẩn độ giảm liều tạm thời hoặc ngừng điều trị bằng Uperio.
Không nên bắt đầu điều trị ở những bệnh nhân có nồng độ kali huyết thanh > 5,4mmol/L hoặc có huyết áp tâm thu < 100mmHg (xem phần Cảnh báo). Nên xem xét dùng liều khởi đầu 50 mg, hai lần mỗi ngày đối với bệnh nhân có huyết áp tâm thu ≥ 100-110mmHg.
Những đối tượng đặc biệt
Nhóm bệnh nhân cao tuổi
Liều dùng nên phù hợp với chức năng thận của bệnh nhân cao tuổi.
Suy thận
Không cần điều chỉnh liều ở bệnh nhân suy thận nhẹ (tốc độ lọc cầu thận ước tính [eGFR] 60-90mL/phút/1,73m2). Nên xem xét dùng liều khởi đầu 50 mg, hai lần mỗi ngày ở bệnh nhân suy thận trung bình (eGFR 30-60mL/phút/1,73m2). Do kinh nghiệm lâm sàng còn rất hạn chế ở bệnh nhân suy thận nặng (eGFR < 30mL/phút/1,73m2) (xem phần Dược lý), cần thận trọng khi dùng Uperio và khuyến cáo dùng liều khởi đầu 50 mg, hai lần mỗi ngày. Không có kinh nghiệm ở bệnh nhân bị bệnh thận giai đoạn cuối và không khuyến cáo sử dụng.
Suy gan
Không cần điều chỉnh liều khi dùng Uperio cho bệnh nhân suy gan nhẹ (phân loại Child-Pugh A). Kinh nghiệm lâm sàng còn hạn chế ở bệnh nhân suy gan trung bình (phân loại Child-Pugh B) hoặc có giá trị AST/ALT cao gấp hai lần giới hạn trên của mức bình thường. Cần thận trọng khi dùng Uperio ở những bệnh nhân này và liều khởi đầu được khuyến cáo là 50 mg, hai lần mỗi ngày (xem phần Cảnh báo và Dược lý). Chống chỉ định dùng Uperio ở bệnh nhân suy gan nặng, xơ gan mật hoặc ứ mật (phân loại Child-Pugh C) (xem phần Chống chỉ định).
Nhóm bệnh nhân trẻ em
Độ an toàn và hiệu quả của Uperio ở trẻ em và thiếu niên dưới 18 tuổi chưa được xác định. Hiện chưa có dữ liệu.
Cách dùng
Dùng đường uống. Có thể dùng Uperio cùng hoặc không cùng với thức ăn (xem mục Dược lý).
Cảnh báo
Thuốc này chỉ dùng theo sự kê đơn của bác sĩ.
Phong tỏa kép hệ Renin-Angiotensin-Aldosteron (RAAS)
• Không dùng đồng thời Uperio với thuốc ức chế men chuyển do nguy cơ phù mạch. Không nên bắt đầu dùng Uperio trong vòng 36 giờ sau khi dùng liều cuối thuốc ức chế men chuyển. Nếu ngừng dùng Uperio, điều trị bằng thuốc ức chế men chuyển không nên bắt đầu trong vòng 36 giờ sau liều cuối của Uperio (xem mục Chống chỉ định, mục Liều lượng và Cách dùng, và mục Tương tác).
• Thận trọng khi dùng đồng thời Uperio với các thuốc ức chế trực tiếp renin như aliskiren (xem mục Chống chỉ định và mục Tương tác). Không được dùng đồng thời Uperio với aliskiren cho bệnh nhân đái tháo đường typ 2 (xem mục Chống chỉ định).
• Không dùng đồng thời Uperio với các thuốc ức chế thụ thể angiotensin do tác dụng chẹn thụ thể angiotensin II của Uperio (xem mục Liều lượng và Cách dùng và mục Tương tác).
• Hạ huyết áp
Không nên bắt đầu điều trị trừ khi huyết áp tâm thu ≥ 100mmHg. Những bệnh nhân có huyết áp tâm thu < 100mmHg chưa được nghiên cứu (xem phần Dược lý). Các trường hợp hạ huyết áp triệu chứng đã được báo cáo ở những bệnh nhân điều trị bằng Uperio trong các nghiên cứu lâm sàng (xem phần Tác dụng ngoại ý), đặc biệt ở bệnh nhân ≥ 65 tuổi, bệnh nhân bị bệnh thận và bệnh nhân có huyết áp tâm thu thấp (< 112mmHg). Khi bắt đầu điều trị hoặc trong khi chuẩn độ liều Uperio, nên theo dõi huyết áp thường xuyên. Nếu hạ huyết áp xảy ra, khuyến cáo chuẩn độ giảm liều tạm thời hoặc ngừng điều trị bằng Uperio (xem phần Liều lượng và Cách dùng). Nên xem xét điều chỉnh liều của thuốc lợi tiểu, thuốc chống tăng huyết áp dùng đồng thời và điều trị các nguyên nhân khác gây hạ huyết áp (ví dụ giảm thể tích máu). Hạ huyết áp triệu chứng có nhiều khả năng xảy ra hơn nếu bệnh nhân bị giảm thể tích, ví dụ do điều trị lợi tiểu, hạn chế muối trong chế độ ăn, tiêu chảy hoặc nôn. Cần điều chỉnh sự thiếu hụt natri và/hoặc giảm thể tích trước khi bắt đầu điều trị bằng Uperio, tuy nhiên, phải cân nhắc cẩn thận hành động điều chỉnh này với nguy cơ quá tải thể tích.
• Suy giảm chức năng thận
Đánh giá bệnh nhân suy tim nên luôn bao gồm đánh giá chức năng thận. Những bệnh nhân suy thận nhẹ và trung bình có nhiều nguy cơ bị hạ huyết áp (xem phần Liều lượng và Cách dùng). Kinh nghiệm lâm sàng còn rất hạn chế ở bệnh nhân suy thận nặng (tốc độ lọc cầu thận (GFR) ước tính < 30mL/phút/1,73m2) và những bệnh nhân này có nguy cơ cao nhất về hạ huyết áp (xem phần Liều lượng và Cách dùng). Không có kinh nghiệm ở bệnh nhân bị bệnh thận giai đoạn cuối và không khuyến cáo sử dụng Uperio.
• Chức năng thận xấu đi
Sử dụng Uperio có thể liên quan đến giảm chức năng thận. Nguy cơ này có thể tăng thêm do mất nước hoặc sử dụng đồng thời với thuốc chống viêm không steroid (NSAID) (xem phần Tương tác). Nên xem xét giảm liều ở những bệnh nhân phát sinh giảm chức năng thận có ý nghĩa lâm sàng.
Tăng kali máu
Không nên bắt đầu điều trị nếu nồng độ kali huyết thanh > 5,4mmol/L. Sử dụng Uperio có thể liên quan đến tăng nguy cơ về tăng kali máu, mặc dù giảm kali máu cũng có thể xảy ra (xem phần Tác dụng ngoại ý). Khuyến cáo theo dõi kali huyết thanh, đặc biệt ở những bệnh nhân có các yếu tố nguy cơ như suy thận, bệnh đái tháo đường hoặc giảm aldosteron huyết hoặc những người có chế độ ăn nhiều kali hoặc đang dùng thuốc đối kháng corticoid khoáng (xem phần Liều lượng và Cách dùng). Nếu bệnh nhân tăng kali máu có ý nghĩa lâm sàng, khuyến cáo điều chỉnh liều các thuốc dùng đồng thời hoặc chuẩn độ giảm liều tạm thời hoặc ngừng dùng thuốc. Nên xem xét ngừng điều trị nếu nồng độ kali huyết thanh > 5,4mmol/L.
Phù mạch
Phù mạch đã được ghi nhận trên bệnh nhân điều trị bằng Uperio. Nếu phù mạch xuất hiện, nên ngừng dùng Uperio ngay và có biện pháp điều trị thích hợp và theo dõi cho đến khi hết hẳn các triệu chứng và dấu hiệu lâm sàng. Không được dùng lại Uperio. Trường hợp vị trí phù mạch được xác định khu trú ở mặt và môi, phù mạch thường tự thoái lui mà không cần điều trị, mặc dù có thể sử dụng thuốc kháng histamin để làm giảm triệu chứng.
Phù mạch liên quan đến phù thanh môn có thể gây tử vong. Nếu phù mạch xuất hiện ở lưỡi, thanh môn hoặc thanh quản và là nguyên nhân gây tắc nghẽn đường thở, cần triển khai ngay các biện pháp điều trị thích hợp bằng tiêm dưới da adrenalin 1:1000 (0,3mL đến 0,5mL) và/hoặc các biện pháp cần thiết để đảm bảo thông khí.
Chưa có nghiên cứu sử dụng thuốc trên nhóm bệnh nhân có tiền sử phù mạch trước đó. Do các bệnh nhân này có nguy cơ phù mạch cao hơn, khuyến cáo thận trọng khi sử dụng Uperio cho họ. Không sử dụng Uperio cho các bệnh nhân có tiền sử phù mạch liên quan đến các thuốc ức chế men chuyển hoặc liên quan đến điều trị bằng các thuốc ức chế thụ thể angiotensin trước đó (xem mục Chống chỉ định).
Bệnh nhân da đen có thể tăng mẫn cảm với hiện tượng phù mạch.
Bệnh nhân hẹp động mạch thận
Tương tự các thuốc khác ảnh hưởng trên hệ renin-angiotensin-aldosteron, Uperio có thể làm tăng ure máu và nồng độ creatinin huyết thanh trên bệnh nhân hẹp động mạch thận hai bên hoặc một bên. Cần thận trọng trên những bệnh nhân hẹp động mạch thận và khuyến cáo theo dõi chức năng thận.
Bệnh nhân với phân loại chức năng độ IV theo NYHA
Cần thận trọng khi sử dụng Uperio cho bệnh nhân NYHA độ IV do kinh nghiệm lâm sàng với đối tượng bệnh nhân này còn hạn chế.
Peptid lợi niệu natri type B (BNP)
BNP không phải là một chất chỉ điểm sinh học thích hợp về suy tim ở bệnh nhân điều trị bằng Uperio vì nó là một cơ chất của neprilysin (xem phần Dược lý).
Bệnh nhân suy gan
Kinh nghiệm lâm sàng còn hạn chế ở bệnh nhân suy gan trung bình (phân loại Child-Pugh B) hoặc có giá trị AST/ALT cao gấp hai lần giới hạn trên của mức bình thường. Ở những bệnh nhân này, nồng độ có thể tăng lên và độ an toàn chưa được xác định. Do đó khuyến cáo nên thận trọng khi dùng Uperio ở những bệnh nhân này (xem phần Liều lượng và Cách dùng và Dược lý). Chống chỉ định dùng Uperio ở những bệnh nhân suy gan nặng, xơ gan mật hoặc ứ mật (phân loại Child-Pugh C) (xem phần Chống chỉ định).
Ảnh hưởng đến khả năng lái xe và vận hành máy móc
Không có nghiên cứu liên quan được tiến hành. Cần thận trọng khi sử dụng máy móc hoặc lái xe, do uống thuốc có thể gây chóng mặt và mệt mỏi.
Quá Liều
Có ít các dữ liệu về sử dụng quá liều Uperio trên người. Trên người tình nguyện khỏe mạnh, liều đơn Uperio 1200 mg và 900 mg đa liều (14 ngày) đã được nghiên cứu và cho thấy thuốc được dung nạp tốt.
Hạ huyết áp là triệu chứng quá liều thường gặp nhất do tác dụng hạ huyết áp của Uperio. Điều trị triệu chứng nên được thực hiện.
Không loại được Uperio bằng lọc máu do thuốc liên kết mạnh với protein huyết tương.
Chống chỉ định
• Quá mẫn với hoạt chất, sacubitril, valsartan hoặc bất cứ thành phần tá dược nào.
• Sử dụng đồng thời với các thuốc ức chế men chuyển (xem mục Cảnh báo, mục Liều lượng và Cách dùng và mục Tương tác). Không nên dùng Uperio trong vòng 36 giờ sau khi dừng điều trị bằng thuốc ức chế men chuyển.
• Bệnh nhân có tiền sử phù mạch liên quan đến điều trị bằng các thuốc ức chế men chuyển hoặc thuốc ức chế thụ thể angiotensin.
• Suy gan nặng, xơ gan mật hoặc ứ mật (xem phần Liều lượng và Cách dùng).
• Sử dụng đồng thời với aliskiren trên bệnh nhân đái tháo đường typ 2 (xem mục Cảnh báo và mục Tương tác).
• Phụ nữ có thai (xem mục Sử dụng ở phụ nữ có thai và cho con bú).
Sử dụng ở phụ nữ có thai và cho con bú
Phụ nữ có khả năng mang thai (và các biện pháp tránh thai nếu có)
Phụ nữ có khả năng mang thai nên được tư vấn về những hệ quả của việc sử dụng Uperio trong khi mang thai và nên được khuyên sử dụng các biện pháp tránh thai trong thời gian điều trị bằng Uperio và 1 tuần sau khi dùng liều thuốc cuối cùng.
Phụ nữ có thai
Tương tự các thuốc khác tác động trực tiếp trên hệ renin-angiotensin-aldosteron, không sử dụng Uperio trong thời kỳ có thai (xem mục Chống chỉ định). Uperio tác động đối kháng angiotensin II. Do đó, không thể loại trừ nguy cơ của thuốc trên thai nhi. Đã có các báo cáo về tổn thương do thuốc trên sự phát triển của thai nhi (như sảy thai tự nhiên, thiểu ối và rối loạn chức năng thận ở trẻ sơ sinh) khi người mẹ mang thai dùng valsartan. Bệnh nhân nên được khuyên ngưng Uperio ngay sau khi mang thai và thông báo cho bác sĩ của mình.
Phụ nữ cho con bú
Hiện chưa biết Uperio có bài tiết vào sữa mẹ hay không. Thành phần của Uperio, sacubitril và valsartan bài tiết vào sữa chuột cống mẹ (xem mục An toàn tiền lâm sàng). Do nguy cơ các phản ứng bất lợi có thể xảy ra trên trẻ sơ sinh và trẻ nhỏ bú mẹ, khuyến cáo không dùng Uperio trong thời gian cho con bú. Nên cân nhắc quyết định ngừng cho con bú hoặc ngừng dùng Uperio trong thời gian cho con bú, có tính đến tầm quan trọng của Uperio đối với người mẹ.
Khả năng sinh sản
Chưa có các dữ liệu về tác dụng của Uperio trên khả năng sinh sản của người. Thuốc không ảnh hưởng đến khả năng sinh sản đã được chứng minh trong các nghiên cứu với Uperio trên chuột cống đực và cái (xem mục An toàn tiền lâm sàng).
Tương tác
Tương tác thuốc chống chỉ định
Các thuốc ức chế men chuyển angiotensin (ACE): Chống chỉ định sử dụng đồng thời Uperio với các thuốc ức chế men chuyển do sự ức chế đồng thời của neprilysin (NEP) và thuốc ức chế men chuyển có thể làm tăng nguy cơ phù mạch. Không bắt đầu sử dụng Uperio trong vòng 36 giờ sau khi dùng liều cuối thuốc ức chế men chuyển. Không bắt đầu điều trị bằng thuốc ức chế men chuyển trong vòng 36 giờ sau khi dùng liều cuối Uperio (xem mục Chống chỉ định và mục Liều lượng và Cách dùng).
Aliskiren: Chống chỉ định sử dụng đồng thời Uperio cho bệnh nhân đái tháo đường typ 2 (xem mục Chống chỉ định).
Tương tác thuốc khuyến cáo không sử dụng đồng thời
Không nên dùng đồng thời Uperio với thuốc chẹn thụ thể angiotensin II (ARB) do tác dụng chẹn thụ thể angiotensin II của Uperio (xem mục Cảnh báo).
Nên tránh dùng thuốc đồng thời với aliskiren trên bệnh nhân suy thận (tốc độ lọc cầu thận ước tính < 60mL/phút/1.73m2) (xem mục Cảnh báo).
Tương tác đã được ghi nhận cần cân nhắc khi phối hợp
Các Statin: Các dữ liệu in vitro cho thấy sacubitril ức chế các hệ vận chuyển OATP1B1 và OATP1B3. Do đó, Uperio có thể làm tăng nồng độ toàn thân của các cơ chất của OATP1B1 và OATP1B3 như các statin. Sử dụng đồng thời với Uperio làm tăng gấp đôi nồng độ Cmax của atorvastatin và các chất chuyển hóa của thuốc và làm tăng đến 1,3 lần diện tích dưới đường cong AUC. Do đó, nên thận trọng khi dùng đồng thời Uperio với các statin.
Ức chế PDE5 bao gồm sildenafil: Dùng thêm đồng thời liều đơn sildenafil cùng với Uperio ở trạng thái ổn định trên bệnh nhân tăng huyết áp gây hạ huyết áp mạnh hơn so với dùng Uperio đơn độc. Do đó, nên thận trọng khi bắt đầu dùng sildenafil hoặc thuốc ức chế PDE-5 khác cho bệnh nhân được điều trị bằng Uperio.
Tương tác thuốc có thể xuất hiện cần được cân nhắc khi phối hợp
Kali: Sử dụng đồng thời với các thuốc lợi tiểu giữ kali (như triamteren, amilorid), các thuốc đối kháng thụ thể corticoid khoáng (như spironolacton, eplerenon), các chế phẩm bổ sung kali hoặc các dạng muối có chứa kali có thể dẫn đến làm tăng nồng độ kali huyết thanh và dẫn đến tăng nồng độ creatinin huyết thanh. Khuyến cáo theo dõi nồng độ kali huyết thanh nếu sử dụng đồng thời Uperio với các thuốc này (xem mục Cảnh báo).
Các thuốc kháng viêm không steroid (NSAID) bao gồm các thuốc ức chế chọn lọc cyclooxygenase-2 (các thuốc ức chế COX-2): Trên bệnh nhân cao tuổi, bệnh nhân bị giảm thể tích tuần hoàn (bao gồm các bệnh nhân đang điều trị bằng thuốc lợi tiểu), hoặc bệnh nhân có chức năng thận suy giảm, sử dụng đồng thời Uperio và các thuốc NSAID có thể dẫn đến tăng nguy cơ làm xấu đi chức năng thận. Do đó, khuyến cáo theo dõi chức năng thận khi bắt đầu hoặc thay đổi điều trị trên bệnh nhân đang dùng các thuốc NSAID sử dụng đồng thời Uperio.
Lithi: Khả năng tương tác thuốc giữa Uperio và lithi chưa được nghiên cứu. Tăng nồng độ lithi huyết thanh có hồi phục và độc tính đã được ghi nhận khi sử dụng đồng thời lithi với các thuốc ức chế men chuyển hoặc các thuốc đối kháng thụ thể angiotensin II. Do đó, khuyến cáo thận trọng theo dõi nồng độ lithi huyết thanh khi sử dụng đồng thời với Uperio. Nếu sử dụng cùng một thuốc lợi tiểu, nguy cơ độc tính của lithi còn có thể tăng thêm.
Các chất vận chuyển OATP và MRP2: Chất chuyển hóa có hoạt tính của sacubitril (LBQ657) và valsartan là cơ chất OATP1B1, OATP1B3 và OAT3; valsartan cũng là cơ chất MRP2. Do đó, sử dụng đồng thời Uperio với các thuốc ức chế OATP1B1, OATP1B3, OAT3 (như rifampin, cyclosporin) hoặc MPR2 (như ritonavir) có thể làm tăng nồng độ LBQ657 hoặc valsartan tương ứng trong tuần hoàn. Cần thận trọng khi bắt đầu hoặc ngừng điều trị với các thuốc này.
Tương tác không có ý nghĩa
Tương tác thuốc-thuốc không có ý nghĩa trên lâm sàng đã được ghi nhận khi sử dụng đồng thời Uperio với furosemid, digoxin, warfarin, hydrochlorothiazid, amlodipin, metformin, omeprazol, carvedilol, nitroglycerin đường tĩnh mạch hoặc dạng kết hợp levonorgestrel/ethinyl estradiol. Không có tương tác của thuốc với atenolol, indomethacin, glyburid hoặc cimetidin.
Các tương tác qua trung gian CYP 450: Các nghiên cứu chuyển hóa in vitro cho thấy khả năng tương tác thuốc trên CYP 450 thấp do Uperio ít chuyển hóa qua hệ enzym CYP 450. Uperio không gây cảm ứng hoặc ức chế enzym CYP 450.
Tác dụng ngoại ý
Tóm tắt hồ sơ về an toàn
Các phản ứng bất lợi đã được báo cáo thường xuyên nhất trong khi điều trị bằng Uperio là hạ huyết áp, tăng kali máu và suy thận (xem phần Cảnh báo). Phù mạch đã được báo cáo ở bệnh nhân điều trị bằng Uperio (xem Mô tả các phản ứng bất lợi chọn lọc).
Độ an toàn của Uperio ở bệnh nhân suy tim mạn tính đã được đánh giá trong nghiên cứu then chốt PARADIGM-HF pha 3 so sánh các bệnh nhân được điều trị hai lần mỗi ngày bằng Uperio 200mg (n=4.203) hoặc enalapril 10 mg (n=4.229). Các bệnh nhân được phân ngẫu nhiên vào nhóm Uperio đã được điều trị trong thời gian dùng thuốc trung vị là 24 tháng; 3.271 bệnh nhân đã được điều trị trong hơn một năm.
Trong nghiên cứu PARADIGM-HF, các đối tượng trước đây đã được điều trị bằng thuốc ức chế ACE và/hoặc ARB và cũng đã phải hoàn thành thành công giai đoạn điều trị thử nghiệm tuần tự bằng enalapril và Uperio (thời gian dùng thuốc trung vị theo thứ tự là 15 ngày và 29 ngày) trước khi vào giai đoạn điều trị ngẫu nhiên, mù đôi. Trong giai đoạn điều trị thử nghiệm bằng enalapril, 1.102 bệnh nhân (10,5%) đã ngừng điều trị vĩnh viễn, 5,6% do một phản ứng bất lợi, thường gặp nhất là rối loạn chức năng thận (1,7%), tăng kali máu (1,7%) và hạ huyết áp (1,4%). Trong giai đoạn điều trị thử nghiệm bằng Uperio, 10,4% bệnh nhân đã ngừng điều trị vĩnh viễn, 5,9% do một phản ứng bất lợi, thường gặp nhất là rối loạn chức năng thận (1,8%), hạ huyết áp (1,7%) và tăng kali máu (1,3%). Do các trường hợp ngừng dùng thuốc trong giai đoạn điều trị thử nghiệm, tỷ lệ các phản ứng bất lợi như được trình bày trong bảng dưới đây có thể thấp hơn tỷ lệ các phản ứng bất lợi dự kiến trong thực hành lâm sàng.
Việc ngừng điều trị do một phản ứng bất lợi trong giai đoạn điều trị mù đôi của nghiên cứu PARADIGM-HF đã xảy ra ở 450 bệnh nhân điều trị bằng Uperio (10,7%) và 516 bệnh nhân điều trị bằng enalapril (12,2%).
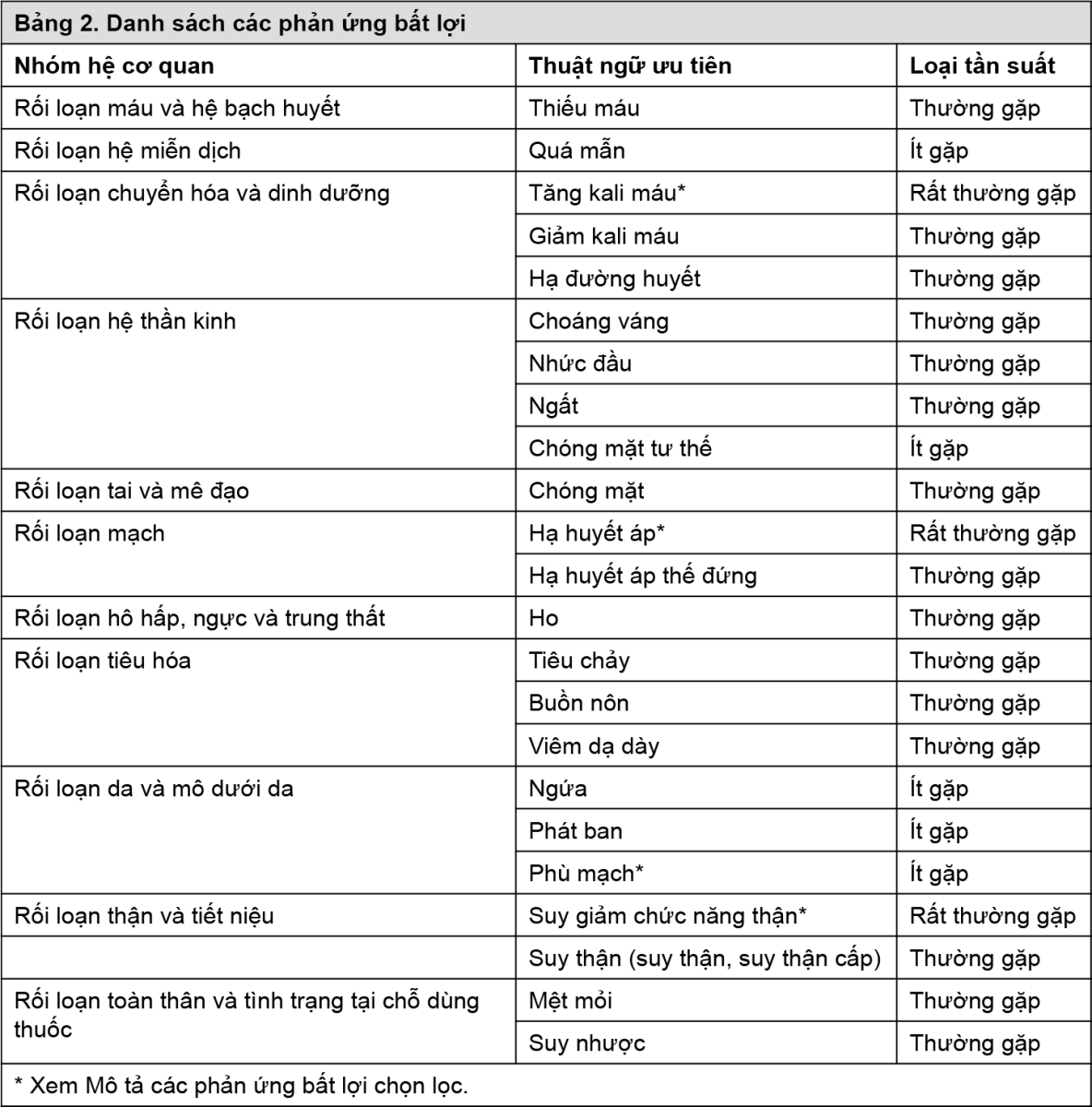
Bảng liệt kê các phản ứng bất lợi
Các phản ứng bất lợi được sắp xếp theo nhóm hệ cơ quan và sau đó theo tần suất, đầu tiên là các phản ứng thường gặp nhất, sử dụng quy ước sau đây: rất thường gặp (≥1/10); thường gặp (≥1/100 đến <1/10); ít gặp (≥1/1.000 đến <1/100); hiếm gặp (≥1/10.000 đến <1/1.000); rất hiếm gặp (<1/10.000). Trong mỗi nhóm tần suất, các phản ứng bất lợi được sắp xếp theo thứ tự mức độ nghiêm trọng giảm dần.
- xem Bảng 2.
Mô tả các phản ứng bất lợi chọn lọc
Phù mạch
Phù mạch đã được báo cáo ở bệnh nhân điều trị bằng Uperio. Trong nghiên cứu PARADIGM-HF, phù mạch đã được báo cáo ở 0,5% bệnh nhân điều trị bằng Uperio, so với 0,2% bệnh nhân điều trị bằng enalapril. Tỷ lệ phù mạch cao hơn đã được quan sát thấy ở bệnh nhân người da đen điều trị bằng Uperio (2,4%) và enalapril (0,5%) (xem phần Cảnh báo).
Tăng kali máu và kali huyết thanh
Trong nghiên cứu PARADIGM-HF, tăng kali máu và nồng độ kali huyết thanh > 5,4mmol/L đã được báo cáo theo thứ tự ở 11,6% và 19,7% bệnh nhân điều trị bằng Uperio và 14,0% và 21,1% bệnh nhân điều trị bằng enalapril.
Huyết áp
Trong nghiên cứu PARADIGM-HF, hạ huyết áp và huyết áp tâm thu thấp có ý nghĩa lâm sàng (< 90mmHg và giảm so với ban đầu > 20mmHg) đã được báo cáo theo thứ tự ở 17,6% và 4,76% bệnh nhân điều trị bằng Uperio so với 11,9% và 2,67% bệnh nhân điều trị bằng enalapril.
Suy thận
Trong nghiên cứu PARADIGM-HF, suy thận đã được báo cáo ở 10,1% bệnh nhân điều trị bằng Uperio và 11,5% bệnh nhân điều trị bằng enalapril.
Bảo quản
Bảo quản ở nhiệt độ không quá 30oC. Tránh ẩm. Giữ thuốc trong bao bì gốc.
Phân loại ATC
C09DX04 - valsartan and sacubitril
Trình bày/Đóng gói
Viên nén bao phim: Uperio 50mg/Uperio 100mg: hộp 2 vỉ x 14 viên, Uperio 200mg: hộp 4 vỉ x 7 viên.
- Abacavir
- Abernil
- Abiiogran
- Acarbose
- ACC
- Acebutolol
- Acenocoumarol
- Acetate Ringer's
- Acetazolamide
- Acetylcystein
- Acetylsalicylic acid
- Aciclovir
- Acid acetylsalicylic
- Acid aminocaproic
- Acid ascorbic
- Acid boric
- Acid chenodeoxycholic
- Acid ethacrynic
- Acid folic
- Acid fusidic
- Acid iopanoic
- Acid ioxaglic
- Acid nalidixic
- Acid pantothenic
- Acid para-aminobenzoic
- Acid salicylic
- Acid tranexamic
- Acid valproic
- Acid zoledronic
- Acitretin
- Aclasta
- Aclon
- Actapulgite
- Actelsar
- Actelsar HCT
- Actemra
- Actilyse
- Acular
- Acupan
- Acuvail
- Acyclovir STADA
- Acyclovir STADA Cream
- Adalat
- Adenosin
- Adenosin Ebewe
- Adipiodon
- Advagraf
- Aerius
- Afinitor
- Agicarvir
- Agifovir-E
- Agilosart
- Agilosart-H
- Agimepzol
- Agimosarid
- Agimstan
- Agimstan-H
- Agiremid
- Agivastar
- Aibezym
- Air-X
- Alaxan
- Albendazol
- Albiomin
- Albumin
- Albumin người Grifols 20%
- Albuminar
- AlbuRx
- Albutein
- Alcuronium chloride
- Aldesleukin
- Alendronat
- Alertin
- Alfa-Lipogamma 600 Oral
- Alfuzosin hydrochlorid
- Algotra
- Alimemazin
- Alimta
- Allipem
- Allopurinol
- Allopurinol STADA
- Aloxi
- Alprazolam
- Alpha Chymotrypsin
- Alpha tocopherol
- Alphachymotrypsin Glomed
- Alphagan-P
- Aluvia
- Alzental
- Amaryl
- Ambroco
- Ambroxol
- Amcinol-Paste
- Amigold
- Amikacin
- Aminocaproic acid
- Aminoleban
- Aminoleban Oral
- Aminosteril N-Hepa
- Amiparen
- Amitriptyline
- Amiyu
- Amlodipine
- Amlor
- Amoxicillin
- Amoxicillin & clavulanate
- Ampicillin
- Amquitaz
- Anaferon for children
- Anargil
- Anaropin
- Andriol Testocaps
- Anepzil
- Anyfen
- Apaisac
- Apidra SoloStar
- Apitim 5
- Aprovel
- Aquaphil
- Arcalion
- Arcoxia
- Aricept Evess
- Arimidex
- Arnetine
- Artrodar
- A-Scabs
- Ascorbic acid
- Asperlican/Candinazol
- Aspilets EC
- Aspirin
- Asthmatin
- Atelec
- Atocib 120
- Atocib 90
- Atosiban PharmIdea
- Atozet
- Attapulgite
- Atussin
- Atropin
- Augbactam
- Augmentin Sachet
- Augmentin SR
- Augmentin Tablets
- Augmex
- Avamys
- Avastin
- Avelox Dịch truyền
- Avelox Viên nén
- Avodart
- Axcel Cefaclor-125 Suspension
- Axcel Cetirizine Syrup
- Axcel Chlorpheniramine
- Axcel Dexchlorpheniramine
- Axcel Dicyclomine-S Syrup
- Axcel Diphenhydramine Paediatric Syrup
- Axcel Erythromycin ES
- Axcel Eviline
- Axcel Fungicort Cream
- Axcel Fusidic acid Cream
- Axcel Fusidic acid-B Cream
- Axcel Hydrocortisone Cream
- Axcel Lignocaine 2% Sterile Gel
- Axcel Loratadine
- Axcel Miconazole Cream
- Axcel Paracetamol
- Axcel Urea Cream
- Axitan
- Azenmarol
- Azicine
- Aziphar
- Azithromycin