Mỗi viên: Sofosbuvir 400mg, velpatasvir 100mg.
Viên nén có hình thoi, màu đỏ, có màng bao phim và có chữ dập chìm “GSI” ở một mặt và “7916” ở mặt còn lại.
Nhóm dược điều trị: Thuốc kháng vi rút có tác động trực tiếp
Các đặc tính dược lực học
Cơ chế tác dụng
Velpatasvir là một chất ức chế HCV có đích tác dụng là protein NS5A của HCV, một protein cần thiết để sao chép RNA và tạo lập các hạt vi rút HCV. Các nghiên cứu chọn lọc đề kháng in vitro và kháng thuốc chéo cho thấy cơ chế tác dụng của velpatasvir là tác dụng trên đích NS5A.
Hoạt tính kháng virút
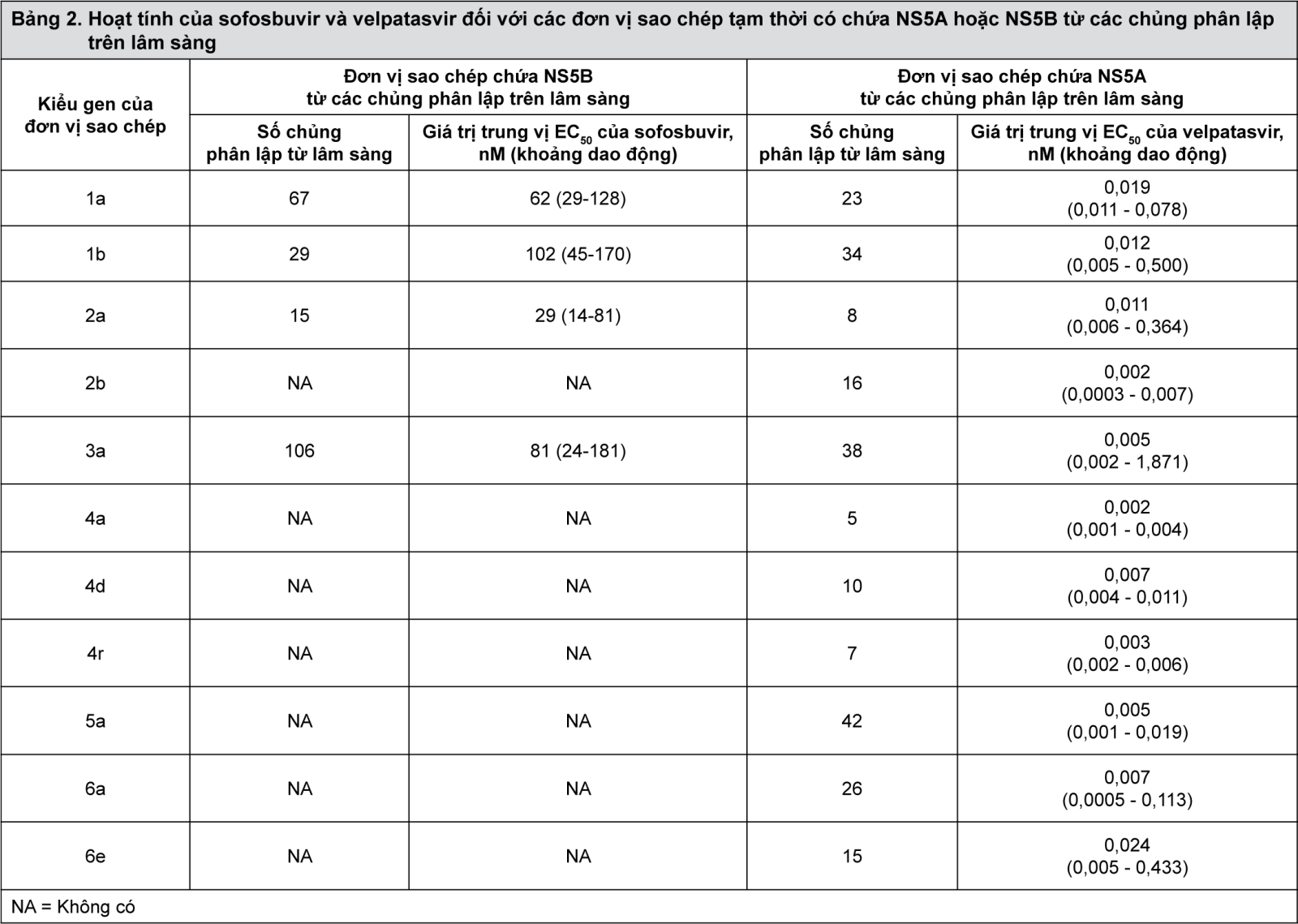
Các giá trị 50% nồng độ hiệu lực (EC50) của sofosbuvir và velpatasvir với các đơn vị sao chép chiều dài đầy đủ hoặc đơn vị sao chép khảm mã hóa các chuỗi NS5B và NS5A từ các chủng phòng thí nghiệm được trình bày trong Bảng 1. Các giá trị EC50 của sofosbuvir và velpatasvir đối với các chủng phân lập trên lâm sàng được trình bày trong Bảng 2.
- xem Bảng 1 & Bảng 2.

Sự hiện diện của 40% huyết thanh người không làm ảnh hưởng tới hoạt tính kháng HCV của sofosbuvir nhưng lại làm giảm hoạt tính kháng HCV của velpatasvir 13 lần chống lại các đơn vị sao chép HCV kiểu gen 1a.
Đánh giá sofosbuvir khi kết hợp với velpatasvir cho thấy không có tác dụng đối kháng trong việc làm giảm nồng độ HCV RNA ở các tế bào đơn vị sao chép.
Kháng thuốc
Trong nuôi cấy tế bào
Các đơn vị sao chép HCV giảm nhạy cảm với sofosbuvir đã được chọn lọc trong nuôi cấy tế bào cho nhiều kiểu gen, bao gồm 1b, 2a, 2b, 3a, 4a, 5a và 6a. Sự giảm nhạy cảm với sofosbuvir có liên quan với đột biến thay thế NS5B chính là S282T ở tất cả kiểu gen đơn vị sao chép được kiểm tra. Tạo đột biến định hướng điểm thay thế S282T ở các đơn vị sao chép kiểu gen từ 1 đến 6 làm giảm độ nhạy cảm với sofosbuvir từ 2 đến 18 lần và làm giảm khả năng sao chép vi rút từ 89% đến 99% so với chủng hoang dại tương ứng. Trong các thử nghiệm sinh hóa, khả năng chất chuyển hóa triphosphate có hoạt tính của sofosbuvir (GS-461203) ức chế polymerase NS5B tái tổ hợp từ các kiểu gen 1b, 2a, 3a và 4a biểu hiện đột biến thay thế S282T giảm đi so với khả năng ức chế polymerase NS5B tái tổ hợp từ chủng hoang dại, như được thấy bởi sự gia tăng từ 8,5 đến 24 lần nồng độ ức chế 50% (IC50).
Chọn lọc in vitro các đơn vị sao chép HCV có giảm độ nhạy cảm với velpatasvir đã được thực hiện trong nuôi cấy tế bào cho nhiều kiểu gen, bao gồm 1a, 1b, 2a, 3a, 4a, 5a và 6a. Các biến thể được chọn lọc ở các vị trí liên quan đến kháng NS5A là 24, 28, 30, 31, 32, 58, 92 và 93. Các biến thể liên quan đến sự kháng thuốc (RAV) được chọn trong 2 hoặc nhiều kiểu gen là F28S, L31I/V và Y93H. Đột biến định hướng điểm với NS5A RAV đã biết cho thấy các đột biến thay thế làm giảm độ nhạy cảm với velpatasvir trên 100 lần là M28G, A92K và Y93H/N/R/W ở kiểu gen 1a, A92K ở kiểu gen 1b, C92T và Y93H/N ở kiểu gen 2b, Y93H ở kiểu gen 3, và L31V và P32A/L/Q/R ở kiểu gen 6. Không có đột biến thay thế riêng lẻ được thử nghiệm cho các kiểu gen 2a, 4a hoặc 5a làm giảm độ nhạy cảm với velpatasvir trên 100 lần. Kết hợp các biến thể này thường cho thấy mức độ giảm độ nhạy cảm với velpatasvir cao hơn so với khi chỉ có các RAV đơn.
Trong các nghiên cứu lâm sàng
Nghiên cứu ở bệnh nhân không mắc xơ gan và bệnh nhân mắc xơ gan còn bù
Trong một phân tích gộp đối với các bệnh nhân không mắc xơ gan hoặc mắc xơ gan còn bù sử dụng Epclusa trong 12 tuần trong ba nghiên cứu Giai đoạn 3, 12 bệnh nhân (2 bệnh nhân có kiểu gen 1 và 10 bệnh nhân có kiểu gen 3) đủ điều kiện để phân tích kháng thuốc do thất bại vi rút học. Thêm một bệnh nhân nhiễm HCV kiểu gen 3 ở thời điểm ban đầu tái nhiễm HCV kiểu gen 1a khi thất bại vi rút học và được loại trừ khỏi phân tích vi rút học. Không có bệnh nhân nào nhiễm HCV kiểu gen 2, 4, 5 hoặc 6 gặp phải thất bại vi rút học.
Trong số 2 bệnh nhân thất bại vi rút học mắc kiểu gen 1, một bệnh nhân mang vi rút với NS5A RAV Y93N mới xuất hiện và bệnh nhân còn lại mang vi rút với NS5A RAV L31I/V và Y93H mới xuất hiện khi thất bại vi rút học. Cả hai bệnh nhân đều mang vi rút ở thời điểm ban đầu chứa NS5A RAV. Không quan sát thấy các RAV chất ức chế nucleoside (NI) NS5B tại thời điểm thất bại ở 2 bệnh nhân.
Trong số 10 bệnh nhân thất bại vi rút học kiểu gen 3, đã quan sát thấy Y93H ở tất cả 10 bệnh nhân tại thời điểm thất bại (6 bệnh nhân có Y93H xuất hiện sau khi điều trị và 4 bệnh nhân có Y93H ở thời điểm ban đầu và sau khi điều trị). Không quan sát thấy NS5B NI RAV tại thời điểm thất bại ở 10 bệnh nhân.
Nghiên cứu ở bệnh nhân mắc xơ gan mất bù
Ở một nghiên cứu Giai đoạn 3 trên các bệnh nhân mắc xơ gan mất bù sử dụng Epclusa + RBV trong 12 tuần, 3 bệnh nhân (1 bệnh nhân nhiễm kiểu gen 1 và 2 bệnh nhân nhiễm kiểu gen 3) đủ điều kiện để phân tích kháng thuốc do thất bại vi rút học. Không có bệnh nhân nào nhiễm HCV kiểu gen 2 hoặc 4 gặp phải thất bại vi rút học trong nhóm điều trị bằng Epclusa + RBV trong 12 tuần.
1 bệnh nhân nhiễm HCV kiểu gen 1 bị thất bại vi rút học không có RAV NS5A hoặc NS5B tại thời điểm thất bại.
Trong số 2 bệnh nhân nhiễm HCV kiểu gen 3 bị thất bại vi rút học, một bệnh nhân có NS5A RAV Y93H xuất hiện tại thời điểm thất bại. Một bệnh nhân khác nhiễm vi rút có Y93H ở thời điểm ban đầu và khi thất bại vi rút học và cũng đã xuất hiện mức độ thấp (dưới 5%) của NS5B NI RAV N142T và E237G tại thời điểm thất bại. Dữ liệu dược động học ở bệnh nhân này phù hợp với việc không tuân thủ điều trị.
Trong nghiên cứu này, 2 bệnh nhân được điều trị bằng Epclusa trong 12 hoặc 24 tuần không có ribavirin có NS5B S282T mới xuất hiện ở mức độ thấp (dưới 5%) cùng với L159F.
Ảnh hưởng của các biến thể liên quan đến kháng thuốc HCV ở thời điểm ban đầu đối với kết quả điều trị
Nghiên cứu ở bệnh nhân không mắc xơ gan và bệnh nhân mắc xơ gan còn bù
Phân tích được thực hiện để khám phá mối tương quan giữa NS5A RAV đã có sẵn ở thời điểm ban đầu và kết quả điều trị cho bệnh nhân không mắc xơ gan hoặc mắc xơ gan còn bù trong ba nghiên cứu lâm sàng Giai đoạn 3 (ASTRAL-1, ASTRAL-2 và ASTRAL-3). Trong số 1.035 bệnh nhân được điều trị với sofosbuvir/velpatasvir trong ba nghiên cứu lâm sàng Giai đoạn 3, 1.023 bệnh nhân được đưa vào phân tích NS5A RAV; 7 bệnh nhân bị loại khỏi phân tích do họ không đạt được đáp ứng vi rút học bền vững (SVR12) hoặc gặp thất bại vi rút học và thêm 5 bệnh nhân bị loại trừ do thất bại với việc lập chuỗi gen NS5A. Trong phân tích gộp của các nghiên cứu Giai đoạn 3, 380/1.023 (37%) bệnh nhân nhiễm vi rút có NS5A RAV ở thời điểm ban đầu. Bệnh nhân nhiễm HCV kiểu gen 2, 4, và 6 có tỷ lệ NS5A RAV cao hơn (tương ứng là 70%, 63% và 52%) so với bệnh nhân nhiễm HCV kiểu gen 1 (23%), kiểu gen 3 (16%) và kiểu gen 5 (18%).
RAV ở thời điểm ban đầu không có ảnh hưởng liên quan đến tỷ lệ đạt SVR12 ở bệnh nhân nhiễm HCV kiểu gen 1, 2, 4, 5 và 6 như tóm tắt trong Bảng 3. Bệnh nhân nhiễm HCV kiểu gen 3 có NS5A RAV Y93H ở thời điểm ban đầu có tỷ lệ SVR12 thấp hơn bệnh nhân không có Y93H sau khi điều trị với Epclusa trong 12 tuần, như tóm tắt trong Bảng 4. Trong nghiên cứu ASTRAL-3, đã phát hiện thấy có Y93H RAV vào thời điểm ban đầu ở 9% bệnh nhân điều trị với Epclusa.
- xem Bảng 3 & Bảng 4.


Không phát hiện thấy NS5B NI RAV S282T trong chuỗi NS5B tại thời điểm ban đầu ở bất kỳ bệnh nhân nào trong các nghiên cứu Giai đoạn 3. Đã đạt được SVR12 ở tất cả 77 bệnh nhân có NS5B NI RAV tại thời điểm ban đầu, bao gồm N142T, L159F, E/N237G, C/M289L/I, L320F/I/V, V321A/I và S282G+V321I.
Nghiên cứu ở bệnh nhân mắc xơ gan mất bù (CPT Loại B)
Phân tích đã được thực hiện để khám phá mối tương quan giữa NS5A RAV đã tồn tại sẵn ở thời điểm ban đầu và kết quả điều trị cho bệnh nhân mắc xơ gan mất bù trong một nghiên cứu Giai đoạn 3 (ASTRAL-4). Trong số 87 bệnh nhân được điều trị với Epclusa + RBV, 85 bệnh nhân được đưa vào phân tích NS5A RAV; 2 bệnh nhân bị loại khỏi phân tích do họ không đạt được SVR12 hoặc bị thất bại vi rút học. Trong số bệnh nhân được điều trị với Epclusa + RBV trong 12 tuần, 29% (25/85) bệnh nhân nhiễm vi rút có NS5A RAV ở thời điểm ban đầu: 29% (19/66), 75% (3/4), 15% (2/13) và 50% (1/2) lần lượt cho bệnh nhân nhiễm HCV kiểu gen 1, 2, 3 và 4.
SVR12 ở bệnh nhân có hoặc không có NS5A RAV tại thời điểm ban đầu trong nhóm điều trị bằng Epclusa + RBV trong 12 tuần cho nghiên cứu này được trình bày trong Bảng 5.
- xem Bảng 5.

Bệnh nhân kiểu gen 3 duy nhất có NS5A RAV tại thời điểm ban đầu và không đạt được SVR12 có đột biến thay thế NS5A Y93H tại thời điểm ban đầu; dữ liệu dược động học ở bệnh nhân này phù hợp với việc không tuân thủ điều trị.
Ba bệnh nhân trong nhóm điều trị bằng Epclusa + RBV trong 12 tuần có NS5B NI RAV (N142T và L159F) ở thời điểm ban đầu và tất cả ba bệnh nhân đều đạt được SVR12.
Kháng thuốc chéo
Dữ liệu thử nghiệm in vitro cho thấy đa số NS5A RAV gây ra kháng với ledipasvir và daclatasvir vẫn còn nhạy cảm với velpatasvir.Velpatasvir là thuốc có hoạt tính đầy đủ đối với đột biến thay thế S282T liên quan đến kháng sofosbuvir trong chuỗi NS5B trong khi tất cả đột biến thay thế liên quan đến kháng thuốc velpatasvir trong chuỗi NS5A hoàn toàn nhạy cảm với sofosbuvir. Cả sofosbuvir và velpatasvir đều có hoạt tính đầy đủ chống lại các đột biến thay thế liên quan tới kháng các nhóm thuốc kháng vi rút tác động trực tiếp khác có cơ chế tác dụng khác, chẳng hạn như chất ức chế NS5B không có cấu trúc nucleoside và chất ức chế protease NS3. Chưa đánh giá được hiệu quả của Epclusa ở những bệnh nhân đã từng thất bại khi điều trị bằng các phác đồ khác có chứa một thuốc ức chế NS5A.
Hiệu quả và an toàn lâm sàng
Hiệu quả của Epclusa được đánh giá trong ba nghiên cứu Giai đoạn 3 ở bệnh nhân nhiễm HCV kiểu gen từ 1 đến 6 có mắc hoặc không mắc xơ gan còn bù và một nghiên cứu Giai đoạn 3 ở bệnh nhân nhiễm HCV kiểu gen từ 1 đến 6 mắc xơ gan mất bù, được tóm tắt trong Bảng 6.
- xem Bảng 6.

Liều dùng ribavirin được dùng dựa trên cân nặng (1.000 mg dùng hàng ngày, chia thành hai lần cho bệnh nhân <75kg và 1.200 mg cho bệnh nhân ≥75kg), và chia thành hai lần khi sử dụng kết hợp với sofosbuvir trong nghiên cứu ASTRAL-2 và ASTRAL-3 hoặc sử dụng kết hợp với Epclusa trong nghiên cứu ASTRAL-4. Việc điều chỉnh liều dùng ribavirin được thực hiện theo thông tin kê đơn ribavirin. Giá trị HCV RNA huyết thanh được đo trong suốt quá trình nghiên cứu lâm sàng bằng xét nghiệm COBAS AmpliPrep/COBAS Taqman HCV (phiên bản 2.0) với giới hạn định lượng dưới (LLOQ) là 15 IU/mL. Đáp ứng vi rút học bền vững (SVR12), được định nghĩa là HCV RNA thấp hơn LLOQ tại 12 tuần sau khi dừng điều trị, là tiêu chí chính để xác định tỷ lệ chữa trị thành công HCV.
Nghiên cứu lâm sàng ở bệnh nhân không mắc xơ gan và bệnh nhân mắc xơ gan còn bù
Người lớn nhiễm HCV kiểu gen 1, 2, 4, 5 và 6 – ASTRAL-1 (nghiên cứu 1138)
ASTRAL-1 là nghiên cứu ngẫu nhiên, mù đôi, đối chứng giả dược nhằm đánh giá 12 tuần điều trị bằng Epclusa so với 12 tuần điều trị bằng giả dược ở bệnh nhân nhiễm HCV kiểu gen 1, 2, 4, 5 hoặc 6. Bệnh nhân nhiễm HCV kiểu gen 1, 2, 4 hoặc 6 được chọn ngẫu nhiên theo tỷ lệ 5:1 để điều trị với Epclusa trong 12 tuần hoặc với giả dược trong 12 tuần. Bệnh nhân nhiễm HCV kiểu gen 5 được đăng ký vào nhóm sử dụng Epclusa. Lựa chọn ngẫu nhiên được phân chia theo kiểu gen HCV (1, 2, 4, 6 và không xác định) và mắc hoặc không mắc bệnh xơ gan.
Đặc điểm nhân khẩu học và đặc điểm ban đầu được cân bằng giữa nhóm điều trị bằng Epclusa và nhóm điều trị bằng giả dược. Trong số 740 bệnh nhân được điều trị, giá trị trung vị của tuổi là 56 tuổi (khoảng dao động: từ 18 đến 82); 60% bệnh nhân là nam; 79% là người da trắng, 9% là người da đen; 21% có chỉ số khối cơ thể tại thời điểm ban đầu tối thiểu là 30kg/m2; tỷ lệ bệnh nhân nhiễm HCV kiểu gen 1, 2, 4, 5 hoặc 6 tương ứng là 53%, 17%, 19%, 5% và 7%; 69% có gen alen IL28B không phải CC (CT hoặc TT); 74% có nồng độ HCV RNA tại thời điểm ban đầu tối thiểu là 800.000 IU/mL; 19% mắc bệnh xơ gan còn bù; và 32% đã từng được điều trị.
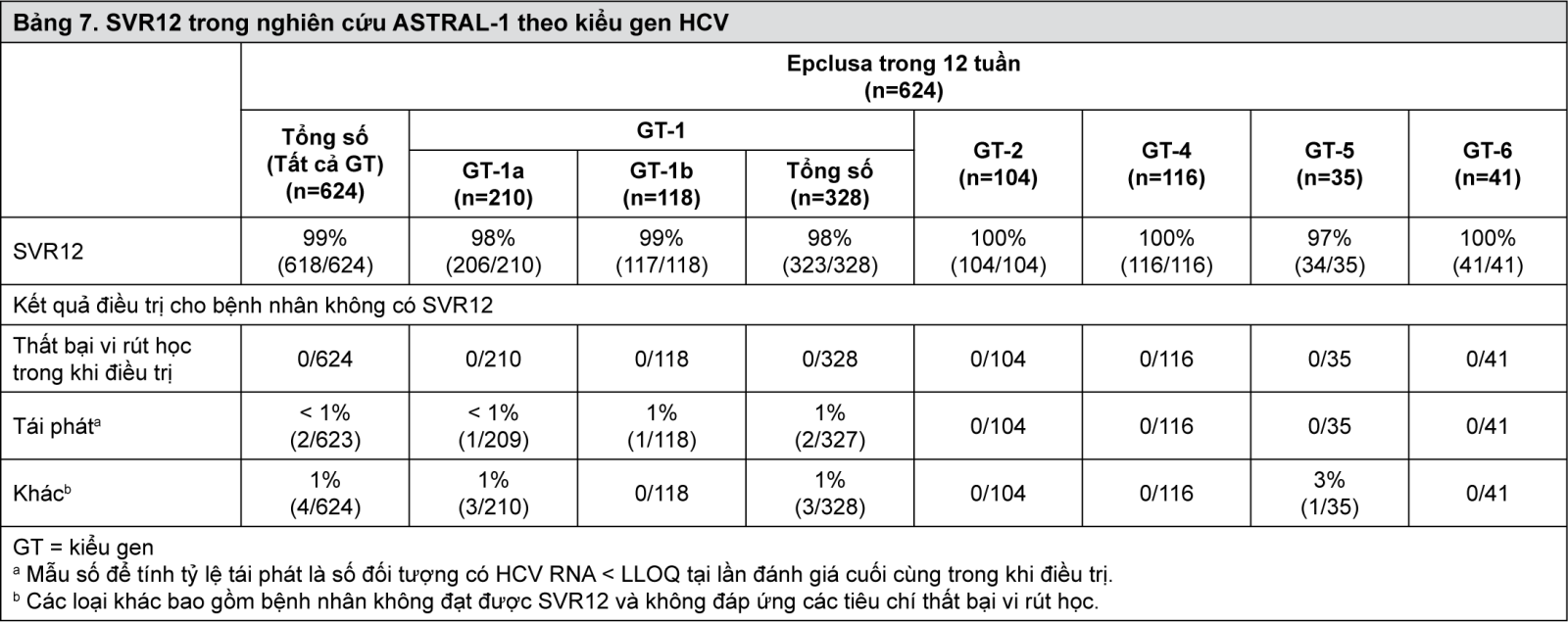
Bảng 7 trình bày SVR12 cho nghiên cứu ASTRAL-1 theo kiểu gen HCV. Không có bệnh nhân nào trong nhóm điều trị bằng giả dược đạt được SVR12.
- xem Bảng 7.
Người lớn nhiễm HCV kiểu gen 2 – ASTRAL-2 (nghiên cứu 1139)
ASTRAL-2 là nghiên cứu ngẫu nhiên, nhãn mở nhằm đánh giá 12 tuần điều trị bằng Epclusa so với 12 tuần điều trị bằng SOF+RBV ở bệnh nhân nhiễm HCV kiểu gen 2. Bệnh nhân được phân ngẫu nhiên theo tỷ lệ 1:1 để điều trị với Epclusa trong 12 tuần hoặc SOF + RBV trong 12 tuần. Lựa chọn ngẫu nhiên được phân chia theo tình trạng mắc hoặc không mắc bệnh xơ gan và kinh nghiệm điều trị (bệnh nhân chưa từng điều trị so với bệnh nhân đã từng điều trị).
Đặc điểm nhân khẩu học và đặc tính ban đầu được cân bằng giữa hai nhóm điều trị. Trong số 266 bệnh nhân được điều trị, giá trị trung vị của tuổi là 58 tuổi (khoảng dao động: từ 23 đến 81); 59% bệnh nhân là nam; 88% là người da trắng, 7% là người da đen; 33% có chỉ số khối cơ thể tại thời điểm ban đầu tối thiểu là 30kg/m2; 62% có gen alen IL28B không phải CC (CT hoặc TT); 80% có mức độ HCV RNA tại thời điểm ban đầu tối thiểu là 800.000 IU/mL; 14% mắc xơ gan còn bù; và 15% đã từng được điều trị.
Bảng 8 trình bày SVR12 cho nghiên cứu ASTRAL-2.
- xem Bảng 8.

Điều trị bằng Epclusa trong 12 tuần đã chứng minh được sự vượt trội có ý nghĩa thống kê (p=0,018) so với điều trị bằng SOF + RBV trong 12 tuần (chênh lệch điều trị +5,2%; 95% khoảng tin cậy: +0,2% đến +10,3%).
Người lớn nhiễm HCV kiểu gen 3 – ASTRAL-3 (nghiên cứu 1140)
ASTRAL-3 là nghiên cứu ngẫu nhiên, nhãn mở nhằm đánh giá 12 tuần điều trị bằng Epclusa so với 24 tuần điều trị bằng SOF+RBV ở bệnh nhân nhiễm HCV kiểu gen 3. Bệnh nhân được phân ngẫu nhiên theo tỷ lệ 1:1 để điều trị với Epclusa trong 12 tuần hoặc SOF + RBV trong 24 tuần. Lựa chọn ngẫu nhiên được phân chia theo tình trạng mắc hoặc không mắc bệnh xơ gan và kinh nghiệm điều trị (bệnh nhân chưa từng điều trị so với bệnh nhân đã từng điều trị).
Đặc điểm nhân khẩu học và đặc tính ban đầu được cân bằng giữa hai nhóm điều trị. Trong số 552 bệnh nhân được điều trị, giá trị trung vị của tuổi là 52 tuổi (khoảng dao động: từ 19 đến 76); 62% bệnh nhân là nam; 89% là người da trắng, 9% là người châu Á; 1% là người da đen; 20% có chỉ số khối cơ thể tại thời điểm ban đầu tối thiểu là 30kg/m2; 61% có gen alen IL28B không phải CC (CT hoặc TT); 70% có nồng độ HCV RNA tại thời điểm ban đầu tối thiểu là 800.000 IU/mL; 30% mắc bệnh xơ gan còn bù; và 26% đã từng được điều trị.
Bảng 9 trình bày SVR12 cho nghiên cứu ASTRAL-3.
- xem Bảng 9.

Điều trị bằng Epclusa trong 12 tuần đã chứng minh được sự vượt trội có ý nghĩa thống kê (p=0,001) so với điều trị bằng SOF + RBV trong 24 tuần (chênh lệch điều trị +14,8%; 95% khoảng tin cậy: +9,6% đến +20,0%).
SVR12 của các phân nhóm đã chọn được trình bày trong Bảng 10.
- xem Bảng 10.

Nghiên cứu lâm sàng ở bệnh nhân mắc bệnh xơ gan mất bù – ASTRAL-4 (nghiên cứu 1137)
ASTRAL-4 là nghiên cứu ngẫu nhiên, nhãn mở ở bệnh nhân nhiễm HCV kiểu gen 1, 2, 3, 4, 5 hoặc 6 và bị xơ gan CPT Loại B. Bệnh nhân được phân ngẫu nhiên theo tỷ lệ 1:1:1 để điều trị với Epclusa trong 12 tuần, Epclusa + RBV trong 12 tuần hoặc Epclusa trong 24 tuần. Lựa chọn ngẫu nhiên được phân chia theo kiểu gen HCV (1, 2, 3, 4, 5, 6 và không xác định).
Đặc điểm nhân khẩu học và đặc tính ban đầu được cân bằng giữa các nhóm điều trị. Trong số 267 bệnh nhân được điều trị, giá trị trung vị của tuổi là 59 tuổi (khoảng dao động: 40 đến 73); 70% bệnh nhân là nam giới; 90% là người da trắng; 6% là người da đen; 42% có chỉ số khối cơ thể tại thời điểm ban đầu ít nhất là 30kg/m2. Tỷ lệ bệnh nhân nhiễm HCV với kiểu gen 1, 2, 3, 4 hoặc 6 tương ứng là 78%, 4%, 15%, 3% và dưới 1% (1 bệnh nhân). Không có bệnh nhân nào nhiễm HCV kiểu gen 5 được đăng ký tham gia. 76% bệnh nhân có gen alen IL28B không phải CC (CT hoặc TT); 56% có nồng độ HCV RNA tại thời điểm ban đầu tối thiểu là 800.000 IU/mL; 55% đã từng được điều trị; 90% và 95% bệnh nhân mắc bệnh xơ gan CPT Loại B và điểm số Mô hình bệnh gan giai đoạn cuối (MELD) ≤15 tại thời điểm ban đầu.
Bảng 11 trình bày SVR12 cho nghiên cứu ASTRAL-4 theo kiểu gen HCV.
- xem Bảng 11.

Bảng 12 trình bày kết quả vi rút học cho bệnh nhân nhiễm HCV kiểu gen 1 hoặc 3 trong nghiên cứu ASTRAL-4.
Không có bệnh nhân nào nhiễm HCV kiểu gen 2, 4 hoặc 6 gặp phải thất bại vi rút học.
- xem Bảng 12.

Các thay đổi về các thông số trong thang điểm CPT ở bệnh nhân đạt được SVR12 trong nghiên cứu ASTRAL-4 (tất cả 3 phác đồ) được trình bày trong Bảng 13.
- xem Bảng 13.

Nhóm bệnh nhân nhi
Cơ quan Quản lý Sản phẩm Y tế Châu Âu đã hoãn nghĩa vụ nộp kết quả nghiên cứu với Epclusa trong một hoặc nhiều phân nhóm của quần thể bệnh nhân nhi trong điều trị bệnh viêm gan C mạn tính (xem phần Liều lượng và Cách dùng để biết thông tin sử dụng cho bệnh nhân nhi).
Người cao tuổi
Các nghiên cứu lâm sàng với Epclusa bao gồm 156 bệnh nhân từ 65 tuổi trở lên (12% tổng số bệnh nhân trong các nghiên cứu lâm sàng Giai đoạn 3). Tỷ lệ đáp ứng quan sát được cho bệnh nhân từ 65 tuổi trở lên tương tự như tỷ lệ đáp ứng cho bệnh nhân dưới 65 tuổi trong các nhóm điều trị.
Các đặc tính dược động học
Hấp thu
Đặc tính dược động học của sofosbuvir, GS-331007 và velpatasvir đã được đánh giá ở các đối tượng người lớn khỏe mạnh và bệnh nhân mắc bệnh viêm gan C mạn tính. Sau khi dùng Epclusa qua đường uống, sofosbuvir được hấp thu nhanh chóng và đã quan sát thấy trung vị nồng độ đỉnh trong huyết tương đạt được 1 giờ sau khi dùng thuốc. Đã quan sát thấy trung vị nồng độ đỉnh trong huyết tương của GS-331007 đạt được 3 giờ sau khi dùng thuốc. Đã quan sát thấy trung vị nồng độ đỉnh trong huyết tương velpatasvir lúc 3 giờ sau khi dùng thuốc.
Dựa trên phân tích dược động học quần thể ở bệnh nhân nhiễm HCV, AUC0-24 trung bình ở trạng thái ổn định của sofosbuvir (n=982), GS-331007 (n=1.428) và velpatasvir (n=1.425) tương ứng là 1.260, 13.970 và 2.970 ng•giờ/mL. Cmax ở trạng thái ổn định của sofosbuvir, GS-331007 và velpatasvir tương ứng là 566, 868 và 259 ng/mL. AUC0-24 và Cmax của sofosbuvir và GS-331007 tương tự nhau ở đối tượng người lớn khỏe mạnh và bệnh nhân nhiễm HCV. So với các đối tượng khỏe mạnh (n=331), AUC0-24 và Cmax của velpatasvir thấp hơn một cách tương ứng là 37% và 41% so với bệnh nhân nhiễm HCV.
Ảnh hưởng của thức ăn
So với tình trạng đói, việc sử dụng một liều Epclusa duy nhất cùng với bữa ăn có lượng chất béo trung bình (~600 kCal, 30% chất béo) hoặc lượng chất béo cao (~800 kCal, 50% chất béo) dẫn tới tăng tương ứng là 34% và 21% AUC0-inf của velpatasvir và tăng tương ứng là 31% và 5% Cmax của velpatasvir. Bữa ăn có lượng chất béo trung bình hoặc cao làm tăng AUC0-inf của sofosbuvir tương ứng là 60% và 78% nhưng không ảnh hưởng đáng kể đến Cmax của sofosbuvir. Bữa ăn có lượng chất béo trung bình hoặc cao không làm thay đổi AUC0-inf của GS-331007 nhưng dẫn tới giảm tương ứng là 25% và 37% đối với Cmax. Tỷ lệ đáp ứng trong các nghiên cứu Giai đoạn 3 cũng tương tự ở bệnh nhân nhiễm HCV sử dụng Epclusa có hoặc không có thức ăn. Có thể dùng Epclusa kèm hoặc không kèm thức ăn.
Phân bố
Sofosbuvir liên kết khoảng 61-65% với các protein huyết tương của người và liên kết này không phụ thuộc vào nồng độ thuốc trong khoảng 1 μg/mL đến 20 μg/mL. Liên kết protein của GS-331007 ở mức tối thiểu trong huyết tương người. Sau liều dùng duy nhất 400 mg [14C]sofosbuvir ở đối tượng khỏe mạnh, tỷ lệ của hoạt độ phóng xạ trong máu trên hoạt độ phóng xạ huyết tương [14C] khoảng 0,7.
Velpatasvir liên kết >99,5% với các protein huyết tương của người và liên kết này không phụ thuộc vào nồng độ thuốc trong khoảng 0,09 μg/mL đến 1,8 μg/mL. Sau liều dùng duy nhất 100 mg [14C] velpatasvir ở đối tượng khỏe mạnh, tỷ lệ của hoạt độ phóng xạ trong máu trên hoạt độ phóng xạ huyết tương [14C] dao động trong khoảng 0,52 đến 0,67.
Biến đổi sinh học
Sofosbuvir được chuyển hóa mạnh ở gan để hình thành dẫn xuất triphosphate nucleoside có hoạt tính dược lý là GS-461203. Con đường hoạt hóa chuyển hóa liên quan tới quá trình thủy phân nối tiếp nhau của phần carboxyl este, được xúc tác bởi cathepsin A (CatA) hoặc carboxylesterase 1 (CES1) ở người và phân tách gốc phosphoramidate bởi protein 1 liên kết nucleotide có bộ 3 acid amin histidine (histidine triad nucleotide-binding protein 1-HINT1), tiếp theo là quá trình phosphoryl hóa qua con đường sinh tổng hợp pyrimidine nucleotide. Quá trình dephosphoryl hóa dẫn tới hình thành chất chuyển hóa nucleoside GS 331007, chất này không thể tái phosphoryl hóa hiệu quả và không có hoạt tính kháng HCV in vitro. Sofosbuvir và GS 331007 không phải là cơ chất hoặc chất ức chế của các enzyme UGT1A1 hoặc CYP3A4, CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19 và CYP2D6. Sau khi dùng liều duy nhất 400 mg [14C] sofosbuvir theo đường uống, GS-331007 chiếm khoảng >90% trong phơi nhiễm toàn thân.
Velpatasvir là cơ chất của CYP2B6, CYP2C8 và CYP3A4 với tốc độ chuyển hóa chậm. Sau liều dùng duy nhất 100 mg [14C] velpatasvir, phần lớn (>98%) hoạt tính phóng xạ trong huyết tương là thuốc mẹ. Dẫn chất monohydroxyl hóa and desmethyl hóa của velpatasvir là các chất chuyển hóa được xác định trong huyết tương người. Velpatasvir dạng không đổi là thành phần chính xuất hiện trong phân.
Thải trừ
Sau liều dùng duy nhất 400 mg [14C] sofosbuvir qua đường uống, tỷ lệ phục hồi toàn bộ trung bình của hoạt tính phóng xạ [14C] là trên 92%, bao gồm lần lượt khoảng 80%, 14% và 2,5% được phục hồi trong nước tiểu, phân và không khí thở ra. Phần lớn liều dùng sofosbuvir được phục hồi trong nước tiểu là ở dạng GS-331007 (78%) trong khi đó 3,5% được phục hồi dưới dạng sofosbuvir. Dữ liệu này cho thấy thanh thải qua thận là đường đào thải chính của GS-331007. Trung vị thời gian bán thải cuối cùng của sofosbuvir và GS-331007 sau khi dùng Epclusa lần lượt là 0,5 và 25 giờ.
Sau liều dùng duy nhất 100 mg [14C] velpatasvir qua đường uống, tỷ lệ phục hồi toàn bộ trung bình của hoạt tính phóng xạ [14C] là 95%, bao gồm lần lượt khoảng 94% và 0,4% được phục hồi trong phân và nước tiểu. Velpatasvir dạng không đổi là thành phần chính trong phân chiếm trung bình 77% liều dùng, tiếp theo là velpatasvir monohydroxyl hóa (5,9%) và velpatasvir desmethyl hóa (3,0%). Dữ liệu này cho thấy sự bài tiết qua mật của thuốc mẹ là con đường thải trừ chính của velpatasvir. Trung vị thời gian bán thải cuối cùng của velpatasvir sau khi dùng Epclusa là khoảng 15 giờ.
Tuyến tính / phi tuyến tính
AUC của velpatasvir tăng gần như theo tỷ lệ liều dùng trên khoảng liều dùng từ 25 mg đến 150 mg. AUC của sofosbuvir và GS-331007 tăng gần như theo tỷ lệ liều dùng trên khoảng liều dùng từ 200 mg đến 1.200 mg.
Khả năng tương tác thuốc sofosbuvir/velpatasvir trong thử nghiệm in vitro
Sofosbuvir và velpatasvir là các cơ chất của các chất vận chuyển thuốc P-gp và BCRP, còn GS-331007 thì không phải. Velpatasvir cũng là cơ chất của OATP1B. Trong thử nghiệm in vitro, có thể quan sát được chuyển hóa chậm của velpatasvir qua CYP2B6, CYP2C8 và CYP3A4.
Velpatasvir là chất ức chế của chất vận chuyển thuốc P-gp, BCRP, OATP1B1 và OATP1B3 và sự tham gia vào tương tác thuốc với các chất vận chuyển này chủ yếu giới hạn trong quá trình hấp thu. Ở các nồng độ trong huyết tương có ý nghĩa về mặt lâm sàng, velpatasvir không phải là một chất ức chế chất vận chuyển tại gan bơm tống xuất muối mật (bile salt export pump - BSEP), protein đồng vận chuyển natri taurocholate (sodium taurocholate cotransporter protein -NTCP), OATP2B1, OATP1A2 hoặc chất vận chuyển cation hữu cơ (OCT) 1, chất vận chuyển ở thận OCT2, OAT1, OAT3, protein 2 liên quan đến đa kháng thuốc (multidrug resistance-associated protein 2 - MRP2) hoặc protein đẩy độc tố và nhiều loại thuốc (multidrug and toxin extrusion protein - MATE) 1, hoặc CYP hoặc enzyme uridine glucuronosyltransferase (UGT) 1A1.
Sofosbuvir và GS-331007 không phải là các chất ức chế của các protein vận chuyển thuốc P-gp, BCRP, MRP2, BSEP, OATP1B1, OATP1B3 và OCT1.GS-331007 không phải là chất ức chế của OAT1, OCT2 và MATE1.
Dược động học ở các quần thể bệnh nhân đặc biệt
Chủng tộc và giới tính
Không xác định thấy sự khác biệt về dược động học có ý nghĩa lâm sàng do chủng tộc hay giới tính đối với sofosbuvir, GS-331007 hoặc velpatasvir.
Người cao tuổi
Phân tích dược động học quần thể ở các bệnh nhân nhiễm HCV cho thấy trong phạm vi độ tuổi (18 đến 82 tuổi) đã phân tích, tuổi không có ảnh hưởng có ý nghĩa lâm sàng lên mức phơi nhiễm của sofosbuvir, GS-331007 hoặc velpatasvir.
Suy thận
Dược động học của sofosbuvir đã được nghiên cứu ở bệnh nhân âm tính với HCV bị suy thận nhẹ (eGFR ≥50 và <80mL/phút/1,73m2), trung bình (eGFR ≥30 và <50mL/phút/1,73m2), nặng (eGFR <30mL/phút/1,73m2) và bệnh nhân bị ESRD cần thẩm tách máu sau liều dùng duy nhất 400 mg sofosbuvir. So với những bệnh nhân có chức năng thận bình thường (eGFR >80mL/phút/1,73m2), AUC0-inf của sofosbuvir cao hơn tương ứng là 61%, 107% và 171% ở bệnh nhân bị suy thận nhẹ, vừa và nặng, trong khi đó AUC0-inf của GS-331007 cao hơn tương ứng là 55%, 88% và 451%. Ở bệnh nhân bị ESRD, AUC0-inf của sofosbuvir cao hơn 28% khi dùng sofosbuvir 1 giờ trước khi thẩm tách máu so với cao hơn 60% khi dùng 1 giờ sau khi thẩm thách máu. AUC0-inf của GS-331007 ở bệnh nhân bị ESRD dùng sofosbuvir 1 giờ trước hoặc 1 giờ sau khi thẩm tách máu cao hơn một cách tương ứng ít nhất là 10 lần và 20 lần. GS-331007 được loại bỏ một cách hiệu quả bởi quá trình thẩm tách máu với hệ số chiết xuất khoảng 53%. Sau liều dùng sofosbuvir duy nhất 400 mg, quá trình thẩm tách máu 4 giờ loại bỏ 18% liều thuốc đã dùng (xem phần Liều lượng và Cách dùng).
Dược động học của velpatasvir được nghiên cứu với liều dùng duy nhất 100 mg velpatasvir ở những bệnh nhân âm tính với HCV bị suy thận nặng (eGFR <30mL/phút theo Cockcroft-Gault). So với các đối tượng có chức năng thận bình thường, AUCinf của velpatasvir cao hơn 50% ở đối tượng bị suy thận nặng (xem phần Liều lượng và Cách dùng).
Suy gan
Dược động học của sofosbuvir đã được nghiên cứu sau 7 ngày dùng liều 400 mg sofosbuvir ở các bệnh nhân nhiễm HCV bị suy gan vừa và nặng (CPT Loại B và C). So với những bệnh nhân có chức năng gan bình thường, AUC0-24 của sofosbuvir cao hơn tương ứng là 126% và 143% với bệnh nhân suy gan vừa và nặng, trong khi đó AUC0-24 của GS-331007 cao hơn tương ứng là 18% và 9%. Phân tích dược động học quần thể trên các bệnh nhân nhiễm HCV cho thấy bệnh xơ gan (bao gồm xơ gan mất bù) không có ảnh hưởng có ý nghĩa lâm sàng tới mức phơi nhiễm sofosbuvir và GS-331007.
Dược động học của velpatasvir đã được nghiên cứu với một liều duy nhất 100 mg velpatasvir ở bệnh nhân âm tính với HCV bị suy gan vừa và nặng (CPT Loại B và C). So với các đối tượng có chức năng gan bình thường, tổng mức phơi nhiễm huyết tương với velpatasvir (AUCinf) là tương tự ở các bệnh nhân bị suy gan vừa và nặng. Phân tích dược động học quần thể trên các bệnh nhân nhiễm HCV cho thấy bệnh xơ gan (bao gồm xơ gan mất bù) không có ảnh hưởng có ý nghĩa về mặt lâm sàng tới mức phơi nhiễm velpatasvir (xem phần Liều lượng và Cách dùng).
Trọng lượng cơ thể
Trọng lượng cơ thể không có ảnh hưởng có ý nghĩa về mặt lâm sàng đối với mức phơi nhiễm sofosbuvir hoặc velpatasvir theo một phân tích dược động học quần thể.
Nhóm bệnh nhân nhi
Chưa thiết lập được dược động học của sofosbuvir, GS-331007 và velpatasvir ở bệnh nhân nhi (xem phần Liều lượng và Cách dùng).
Dữ liệu an toàn tiền lâm sàng
Sofosbuvir
Không phát hiện thấy mức phơi nhiễm sofosbuvir trong các nghiên cứu trên động vật gặm nhấm do hoạt tính esterase cao và mức phơi nhiễm với các chất chuyển hóa chính GS-331007 được dùng thay thế để tính toán biên độ phơi nhiễm.
Sofosbuvir không có độc tính gen trong một loạt các thử nghiệm in vitro hoặc in vivo, bao gồm đột biến gen vi khuẩn, quang sai nhiễm sắc thể sử dụng tế bào bạch huyết ngoại vi của người và trong các thử nghiệm vi nhân in vivo trên chuột nhắt. Không quan sát thấy tác động gây quái thai trong các nghiên cứu độc tính trên sự phát triển ở chuột cống và thỏ với sofosbuvir. Sofosbuvir không có tác dụng có hại trên hành vi, khả năng sinh sản và sự phát triển của thế hệ sau trong nghiên cứu phát triển trước và sau khi sinh ở chuột cống.
Sofosbuvir không phải là một chất gây ung thư trong các nghiên cứu về tính sinh ung thư ở chuột nhắt và chuột cống trong 2 năm với mức phơi nhiễm GS-331007 cao hơn tương ứng là 15 và 9 lần so với mức phơi nhiễm ở người.
Velpatasvir
Velpatasvir không có độc tính gen trong một loạt các thử nghiệm in vitro hoặc in vivo, bao gồm đột biến gen vi khuẩn, quang sai nhiễm sắc thể sử dụng tế bào bạch huyết ngoại vi của người và trong các thử nghiệm vi nhân in vivo chuột cống.
Các nghiên cứu về khả năng gây ung thư với velpatasvir vẫn đang được tiến hành.
Velpatasvir không có tác dụng có hại trên khả năng giao phối và sinh sản. Không quan sát thấy tác dụng gây quái thai trong các nghiên cứu độc tính trên sự phát triển ở chuột nhắt và chuột cống với velpatasvir ở mức phơi nhiễm AUC cao hơn khoảng 31 và 6 lần so với mức phơi nhiễm trên người ở liều dùng khuyến nghị trên lâm sàng. Tuy nhiên, có thể thấy tác dụng gây quái thai ở thỏ khi đã thấy sự gia tăng tổng số dị tật nội tạng ở động vật bị phơi nhiễm với mức độ phơi nhiễm AUC lên đến 0,7 lần so với mức phơi nhiễm ở người khi dùng liều khuyến nghị trên lâm sàng. Chưa rõ mức độ liên quan ở người. Velpatasvir không có tác dụng có hại trên hành vi, khả năng sinh sản hoặc quá trình phát triển ở thế hệ sau trong nghiên cứu phát triển trước và sau khi sinh của chuột cống ở mức phơi nhiễm AUC cao hơn khoảng 5 lần so với mức phơi nhiễm ở người khi dùng liều khuyến nghị trên lâm sàng.
Chỉ định/Công dụng
Epclusa được chỉ định trong điều trị nhiễm vi rút viêm gan C mạn tính (HCV) ở người lớn (xem phần Liều lượng và Cách dùng, Cảnh báo và Dược lý - Các đặc tính dược lực học).
Liều lượng & Cách dùng
Điều trị bằng Epclusa phải do bác sĩ có kinh nghiệm trong việc chữa trị cho bệnh nhân nhiễm HCV tiến hành và theo dõi.
Liều dùng
Liều đề nghị của Epclusa là 1 viên/ngày, uống cùng hoặc không cùng với thức ăn (xem thêm mục Dược lý - Các đặc tính dược động học).
- xem Bảng 14.

Khi sử dụng kết hợp với ribavirin, hãy tham khảo "Tóm tắt Đặc tính Sản phẩm" của dược phẩm có chứa ribavirin.
Khuyến nghị sử dụng liều dùng sau đây khi chia ribavirin thành hai liều dùng hàng ngày và dùng kèm thức ăn.
- xem Bảng 15.
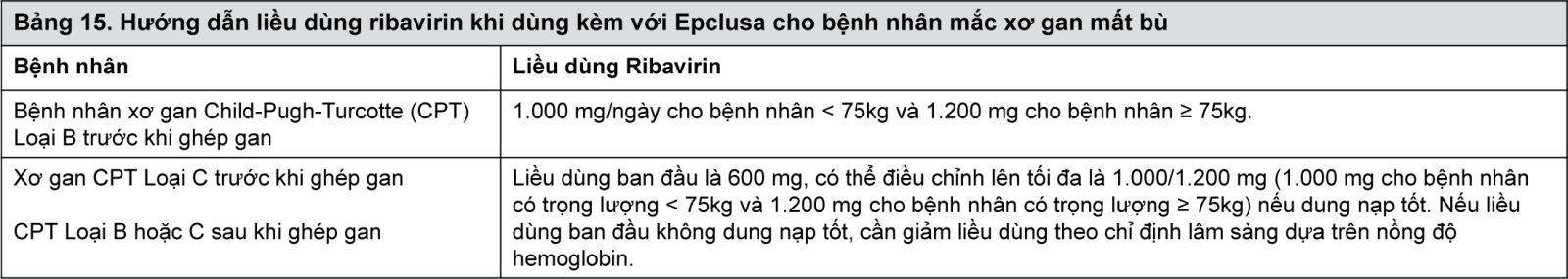
Nếu sử dụng ribavirin cho bệnh nhân nhiễm bệnh kiểu gen 3 mắc xơ gan còn bù (trước hoặc sau ghép gan), liều dùng ribavirin khuyến nghị là 1.000/1.200 mg (1.000 mg cho bệnh nhân có trọng lượng <75kg và 1.200 mg cho bệnh nhân có trọng lượng ≥75kg).
Để điều chỉnh liều dùng ribavirin, tham khảo "Tóm tắt Đặc tính Sản phẩm" của dược phẩm có chứa ribavirin.
Cần hướng dẫn bệnh nhân rằng nếu xảy ra nôn ói trong vòng 3 giờ sau khi dùng thuốc, cần sử dụng thêm một viên nén Epclusa. Nếu nôn ói xảy ra quá 3 giờ sau khi dùng thuốc, không cần dùng thêm Epclusa (xem phần Dược lý - Đặc tính dược lực học).
Nếu dùng thiếu một liều Epclusa và trong vòng 18 giờ kể từ thời điểm cần uống thuốc thông thường, cần hướng dẫn bệnh nhân uống thuốc trong thời gian sớm nhất có thể và sau đó bệnh nhân sẽ dùng liều tiếp theo theo thời gian thông thường. Nếu đã qua 18 giờ thì cần hướng dẫn bệnh nhân chờ và dùng liều Epclusa tiếp theo vào thời điểm uống thuốc thông thường. Cần hướng dẫn bệnh nhân không dùng hai liều Epclusa.
Bệnh nhân đã từng điều trị thất bại trước đó với phác đồ có chứa NS5A
Có thể cân nhắc sử dụng Epclusa + ribavirin trong 24 tuần (xem phần Cảnh báo).
Người cao tuổi
Không cần điều chỉnh liều dùng cho bệnh nhân cao tuổi (xem phần Dược lý - Đặc tính dược động học).
Suy thận
Không cần điều chỉnh liều dùng Epclusa cho bệnh nhân bị suy thận nhẹ hoặc vừa. Chưa đánh giá được tính an toàn và hiệu quả của Epclusa đối với bệnh nhân suy thận nặng (độ lọc cầu thận ước tính [eGFR] < 30mL/phút/1,73m2) hoặc bị bệnh thận giai đoạn cuối (ESRD) cần phải chạy thẩm tách máu (xem phần Dược lý - Đặc tính dược động học).
Suy gan
Không cần điều chỉnh liều dùng Epclusa cho bệnh nhân bị suy gan nhẹ, vừa hoặc nặng (CPT Loại A, B hoặc C) (xem phần Dược lý - Đặc tính dược động học). Đã đánh giá được tính an toàn và hiệu quả của Epclusa ở bệnh nhân mắc bệnh xơ gan CPT Loại B, nhưng chưa đánh giá được ở bệnh nhân mắc bệnh xơ gan CPT Loại C (xem phần Cảnh báo, Tác dụng ngoại ý và Dược lý - Đặc tính dược lực học).
Nhóm bệnh nhân nhi
Chưa xác định được tính an toàn và hiệu quả của Epclusa ở trẻ em và thanh thiếu niên dưới 18 tuổi. Hiện chưa có dữ liệu.
Cách dùng
Dùng theo đường uống.
Cần hướng dẫn bệnh nhân nuốt cả viên nén kèm hoặc không kèm thức ăn (xem phần Dược lý - Đặc tính dược động học). Do thuốc có vị đắng, khuyến cáo không nên nhai hoặc nghiền viên nén bao phim.
Cảnh báo
Không nên sử dụng Epclusa đồng thời với các loại thuốc khác có chứa sofosbuvir.
Chậm nhịp tim nghiêm trọng và bloc tim
Đã quan sát thấy các trường hợp bị chậm nhịp tim nghiêm trọng và bloc tim khi sử dụng sofosbuvir kết hợp với thuốc kháng vi rút có tác động trực tiếp (DAA) khác, dùng đồng thời với amiodarone có hoặc không có thuốc khác làm chậm nhịp tim. Chưa xác định được cơ chế.
Việc sử dụng đồng thời amiodarone mới chỉ giới hạn trong chương trình phát triển lâm sàng của sofosbuvir và DAA. Các trường hợp này có thể đe dọa đến tính mạng, vì vậy chỉ nên sử dụng amiodarone cho các bệnh nhân đang được điều trị với Epclusa khi không dung nạp hoặc chống chỉ định với các biện pháp điều trị chống loạn nhịp tim thay thế khác.
Khi việc sử dụng đồng thời amiodarone được cho là cần thiết, khuyến nghị theo dõi chặt chẽ tình trạng của bệnh nhân khi bắt đầu sử dụng Epclusa. Bệnh nhân được xác định là có nguy cơ cao bị chậm nhịp tim cần được theo dõi liên tục trong 48 giờ trong điều kiện lâm sàng phù hợp.
Do amiodarone có thời gian bán thải dài, cần tiến hành theo dõi phù hợp cho bệnh nhân đã ngừng sử dụng amiodarone trong một vài tháng và bắt đầu sử dụng Epclusa.
Tất cả các bệnh nhân được điều trị với Epclusa kết hợp với amiodarone có hoặc không kèm theo thuốc khác làm chậm nhịp tim cũng nên được cảnh báo về triệu chứng tim đập chậm và bloc tim và khuyến nghị tìm kiếm hỗ trợ y tế khẩn cấp nếu xuất hiện triệu chứng.
Bệnh nhân đã từng điều trị thất bại trước đó với phác đồ có chứa NS5A
Không có dữ liệu lâm sàng chứng minh cho tính hiệu quả của sofosbuvir/velpatasvir trong điều trị cho bệnh nhân đã từng thất bại với phác đồ có chứa chất ức chế NS5A. Tuy nhiên, trên cơ sở các biến thể liên quan đến kháng thuốc (RAV) NS5A thường thấy ở bệnh nhân đã từng điều trị thất bại với các phác đồ khác có chứa chất ức chế NS5A, dược lý học in vitro của velpatasvir và kết quả điều trị với sofosbuvir/velpatasvir ở bệnh nhân chưa từng sử dụng NS5A có RAV NS5A vào thời điểm ban đầu được đăng ký tham gia nghiên cứu ASTRAL, có thể cân nhắc sử dụng Epclusa + RBV trong 24 tuần cho những bệnh nhân đã từng điều trị thất bại với phác đồ có chứa NS5A và những bệnh nhân được cho là có nguy cơ tiến triển bệnh lâm sàng và những bệnh nhân không có lựa chọn điều trị thay thế.
Suy thận
Không cần điều chỉnh liều dùng Epclusa cho bệnh nhân bị suy thận nhẹ hoặc vừa. Chưa đánh giá được tính an toàn của Epclusa ở bệnh nhân bị suy thận nặng (eGFR < 30mL/phút/1,73m2) hoặc ESRD cần phải chạy thẩm tách máu. Khi sử dụng Epclusa kết hợp với ribavirin, tham khảo "Tóm tắt Đặc tính Sản phẩm" của ribavirin cho bệnh nhân có độ thanh thải creatinine < 50mL/phút (xem phần Dược lý - Đặc tính dược động học).
Sử dụng cùng với chất gây cảm ứng P-gp mức độ trung bình hoặc chất gây cảm ứng CYP mức độ trung bình
Các thuốc gây cảm ứng P-gp hoặc CYP mức độ trung bình (ví dụ như oxcarbazepine, modafinil hoặc efavirenz) có thể làm giảm nồng độ huyết tương sofosbuvir hoặc velpatasvir dẫn tới giảm hiệu quả điều trị của Epclusa. Không khuyến nghị sử dụng đồng thời các loại thuốc này với Epclusa (xem phần Tương tác).
Sử dụng cùng với một số phác đồ kháng retrovirus HIV
Epclusa đã được chứng minh là làm tăng khả năng phơi nhiễm với tenofovir, đặc biệt là khi sử dụng với phác đồ điều trị HIV có chứa tenofovir disoproxil fumarate và một chất tăng cường dược động học (ritonavir hoặc cobicistat). Chưa xác định được tính an toàn của tenofovir disoproxil fumarate khi có Epclusa và một chất tăng cường dược động học. Cần cân nhắc nguy cơ và lợi ích tiềm tàng liên quan đến việc sử dụng đồng thời Epclusa với viên nén phối hợp cố định liều có chứa elvitegravir/cobicistat/ emtricitabine/tenofovir disoproxil fumarate hoặc tenofovir disoproxil fumarate kết hợp với chất ức chế protease HIV được tăng cường dược động học (ví dụ như atazanavir hoặc darunavir), đặc biệt ở bệnh nhân có nguy cơ rối loạn chức năng thận. Bệnh nhân được điều trị bằng Epclusa kết hợp với elvitegravir/cobicistat/emtricitabine/tenofovir disoproxil fumarate hoặc tenofovir disoproxil fumarate và chất ức chế protease HIV được tăng cường dược động học, cần được theo dõi phản ứng có hại có liên quan đến tenofovir. Tham khảo "Tóm tắt Đặc tính Sản phẩm" tenofovir disoproxil fumarate, emtricitabine/tenofovir disoproxil fumarate, hoặc elvitegravir/cobicistat/emtricitabine/tenofovir disoproxil fumarate để biết các khuyến nghị theo dõi chức năng thận.
Đồng nhiễm HCV/HBV (virút viêm gan B)
Không có dữ liệu về việc sử dụng Epclusa cho bệnh nhân đồng nhiễm HCV/HBV. Sự thải loại HCV có thể dẫn tới gia tăng nhân bản HBV ở bệnh nhân đồng nhiễm HCV/HBV. Cần theo dõi mức HBV trong khi điều trị với Epclusa và trong thời gian thăm khám theo dõi sau điều trị.
Xơ gan CPT Loại C
Chưa đánh giá được tính an toàn và hiệu quả của Epclusa ở bệnh nhân mắc bệnh xơ gan CPT Loại C (xem phần Tác dụng ngoại ý và Dược lý - Đặc tính dược lực học).
Bệnh nhân ghép gan
Chưa đánh giá được tính an toàn và hiệu quả của Epclusa trong điều trị nhiễm HCV ở bệnh nhân sau ghép gan. Việc điều trị với Epclusa theo liều dùng khuyến nghị (xem phần Liều lượng và Cách dùng) cần được điều chỉnh thông qua đánh giá lợi ích và rủi ro tiềm tàng cho từng bệnh nhân.
Ảnh hưởng đến khả năng lái xe và vận hành máy móc
Epclusa không có ảnh hưởng hoặc ảnh hưởng không đáng kể đến khả năng lái xe và vận hành máy móc.
Quá Liều
Liều dùng cao nhất được ghi nhận của sofosbuvir và velpatasvir lần lượt là là liều duy nhất 1.200 mg và liều duy nhất 500 mg. Trong các nghiên cứu ở những người tình nguyện khỏe mạnh này, không quan sát thấy các tác dụng có hại ở mức liều dùng này và các biến cố có hại là tương tự về tần suất và mức độ nghiêm trọng so với báo cáo thu được từ nhóm bệnh nhân sử dụng giả dược. Chưa xác định được ảnh hưởng của liều cao hơn/mức phơi nhiễm cao hơn.
Không có thuốc giải độc đặc hiệu khi sử dụng quá liều Epclusa. Nếu xảy ra quá liều, phải theo dõi bệnh nhân để phát hiện bằng chứng độc tính. Điều trị quá liều Epclusa bao gồm các biện pháp hỗ trợ chung như theo dõi các dấu hiệu sinh tồn cũng như quan sát tình trạng lâm sàng của bệnh nhân. Thẩm tách máu có thể đào thải hiệu quả chất chuyển hóa lưu hành chiếm ưu thế của sofosbuvir là GS-331007 với tỷ lệ chiết xuất 53%. Thẩm tách máu dường như không làm đào thải đáng kể velpatasvir vì velpatasvir liên kết cao với protein huyết tương.
Chống chỉ định
Quá mẫn cảm với các thành phần hoạt chất hoặc bất kỳ tá dược nào.
Sử dụng với chất gây cảm ứng P-gp mạnh và chất gây cảm ứng CYP mạnh
Những thuốc là chất gây cảm ứng P glycoprotein (P-gp) mạnh hoặc cytochrome P450 (CYP) mạnh (rifampicin, rifabutin, thảo dược St. John’s wort [cây cỏ ban Hypericum perforatum], carbamazepine, phenobarbital và phenytoin). Dùng đồng thời sẽ làm giảm đáng kể nồng độ huyết tương sofosbuvir hoặc velpatasvir và có thể dẫn tới mất hiệu quả của thuốc Epclusa (xem phần Tương tác).
Sử dụng ở phụ nữ có thai và cho con bú
Phụ nữ mang thai
Không có dữ liệu hoặc rất ít dữ liệu (dưới 300 trường hợp mang thai) sử dụng sofosbuvir, velpatasvir hoặc Epclusa ở phụ nữ có thai.
Sofosbuvir
Nghiên cứu trên động vật không cho thấy các ảnh hưởng có hại trực tiếp hoặc gián tiếp liên quan đến độc tính trên sinh sản (xem phần Dữ liệu an toàn tiền lâm sàng).
Chưa thể ước tính đầy đủ các biên độ phơi nhiễm với sofosbuvir ở chuột cống so với mức phơi nhiễm ở người tại liều dùng khuyến nghị trên lâm sàng (xem phần Dữ liệu an toàn tiền lâm sàng).
Velpatasvir
Nghiên cứu trên động vật cho thấy có thể có độc tính đối với khả năng sinh sản (xem phần Dữ liệu an toàn tiền lâm sàng).
Như là một biện pháp phòng ngừa, khuyến nghị không sử dụng Epclusa trong thời kỳ mang thai.
Cho con bú
Hiện chưa rõ liệu sofosbuvir, các chất chuyển hóa của sofosbuvir hoặc velpatasvir có bài tiết qua sữa mẹ hay không.
Dữ liệu dược động học hiện có ở động vật cho thấy có hiện tượng bài tiết velpatasvir và các chất chuyển hóa của sofosbuvir qua sữa.
Không thể loại trừ nguy cơ ảnh hưởng tới trẻ sơ sinh/trẻ nhỏ. Vì vậy, không nên sử dụng Epclusa khi đang cho con bú.
Khả năng sinh sản
Không có dữ liệu nghiên cứu ở người về ảnh hưởng của Epclusa đối với khả năng sinh sản.
Nghiên cứu ở động vật không cho thấy tác dụng có hại của sofosbuvir hoặc velpatasvir đối với khả năng sinh sản.
Nếu ribavirin được dùng đồng thời với Epclusa, hãy tham khảo "Tóm tắt Đặc tính Sản phẩm" của ribavirin để biết các khuyến nghị chi tiết về việc mang thai, tránh thai và cho con bú.
Tương tác
Vì Epclusa chứa sofosbuvir và velpatasvir, nên bất kỳ tương tác nào đã được xác định với từng hoạt chất này cũng có thể xảy ra với Epclusa.
Khả năng Epclusa ảnh hưởng đến các loại thuốc khác
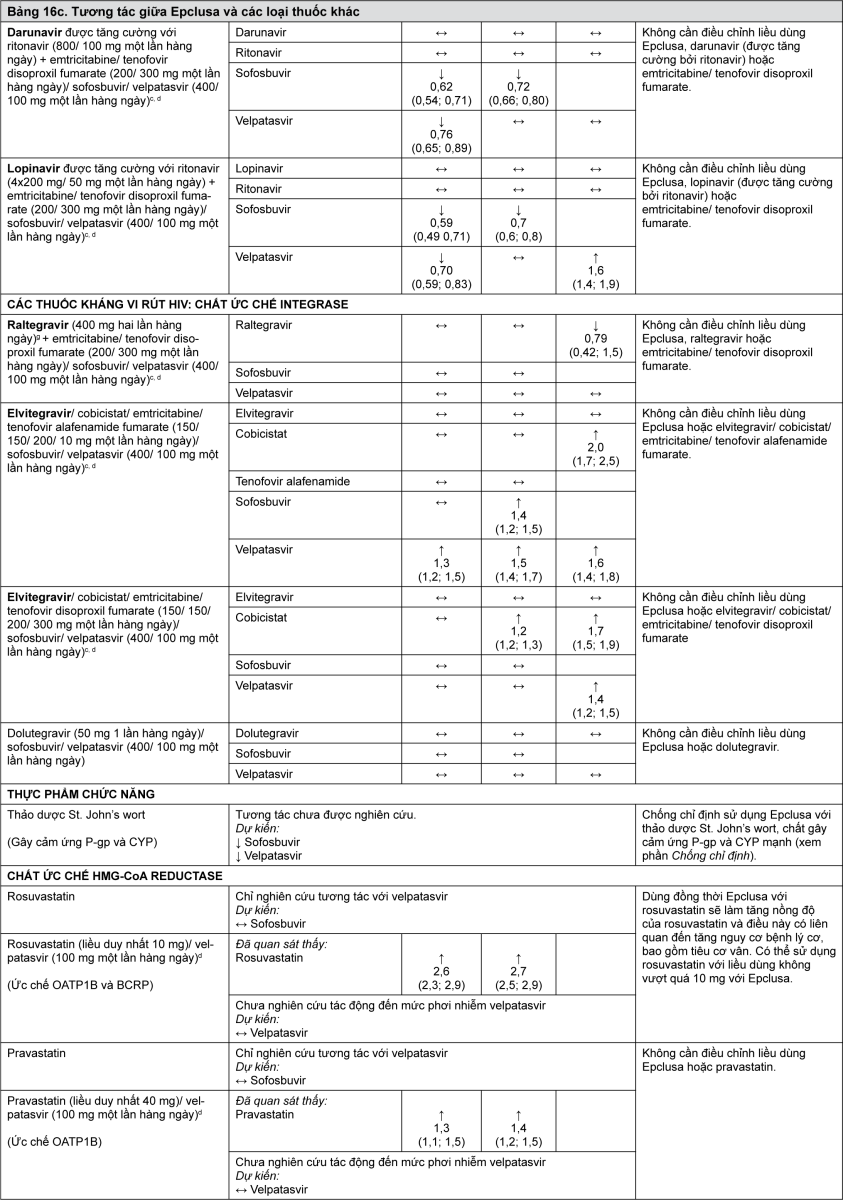
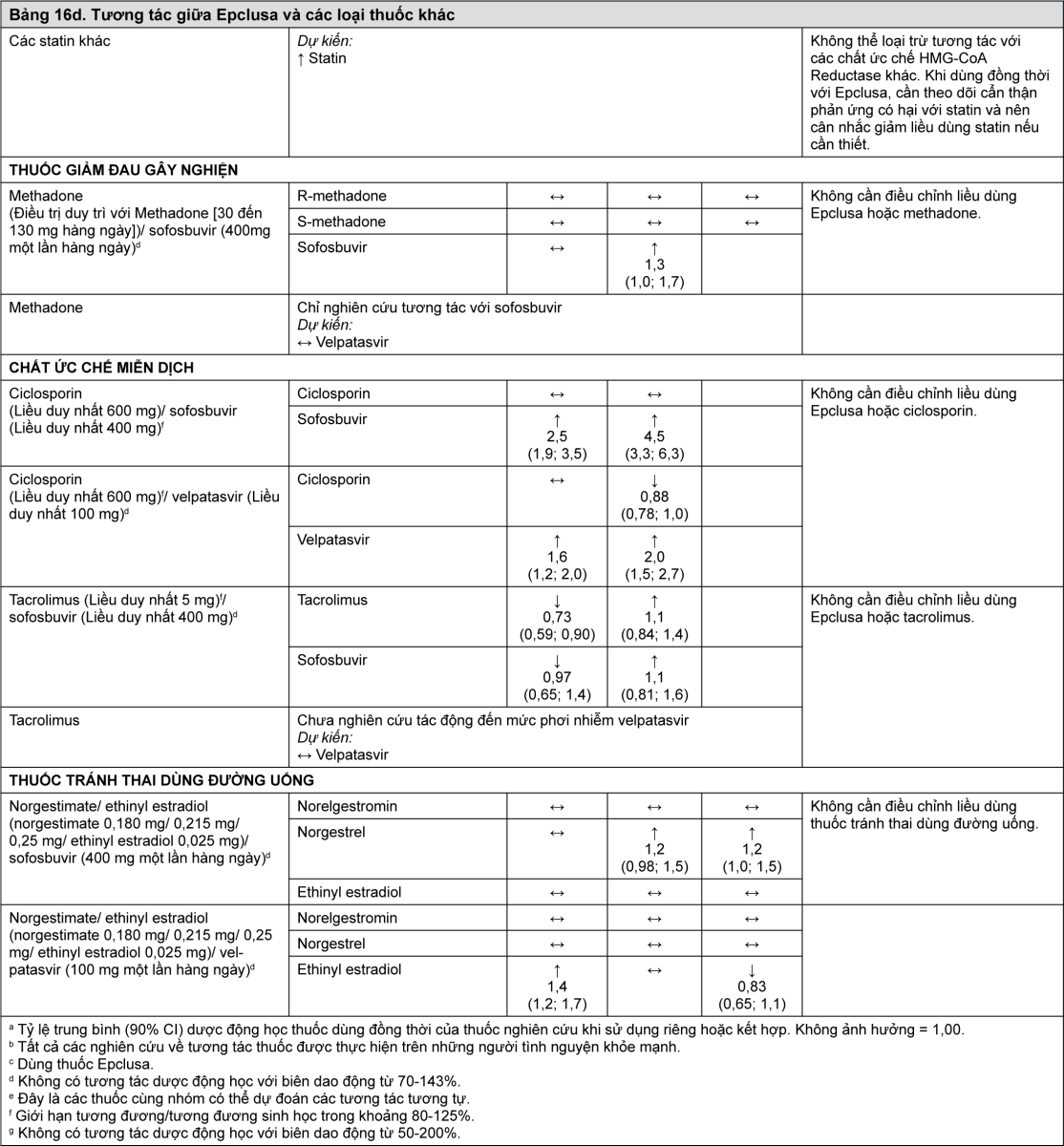
Velpatasvir là chất ức chế của protein vận chuyển thuốc P-gp, protein kháng ung thư vú (organic anion transporting polypeptide - BCRP), polypeptide vận chuyển anion hữu cơ (organic anion transporting polypeptide - OATP) 1B1 và OATP1B3. Việc sử dụng đồng thời Epclusa với các thuốc là cơ chất cho các chất vận chuyển này có thể tăng nguy cơ phơi nhiễm với các thuốc đó. Xem Bảng 16 để biết ví dụ về tương tác với các cơ chất nhạy cảm P-gp (digoxin), BCRP (rosuvastatin) và OATP (pravastatin).
Khả năng các thuốc khác ảnh hưởng đến Epclusa
Sofosbuvir và velpatasvir là cơ chất của các chất vận chuyển thuốc P-gp và BCRP. Velpatasvir cũng là cơ chất của polypeptid vận chuyển thuốc OATP1B. Trong thử nghiệm in vitro, đã quan sát thấy chuyển hóa chậm của velpatasvir bởi CYP2B6, CYP2C8 và CYP3A4. Các thuốc là chất gây cảm ứng mạnh P-gp hoặc chất gây cảm ứng mạnh CYP2B6, CYP2C8 hoặc CYP3A4 (ví dụ rifampicin, rifabutin, thảo dược St. John’s wort, carbamazepine, phenobarbital và phenytoin) có thể làm giảm nồng độ huyết tương của sofosbuvir hoặc velpatasvir dẫn tới giảm hiệu quả điều trị của sofosbuvir/velpatasvir. Chống chỉ định sử dụng các loại thuốc này với Epclusa (xem phần Chống chỉ định). Các thuốc là chất gây cảm ứng P-gp mức độ trung bình hoặc chất gây cảm ứng CYP mức độ trung bình (ví dụ như oxcarbazepine, modafinil hoặc efavirenz) có thể làm giảm nồng độ huyết tương sofosbuvir hoặc velpatasvir dẫn tới giảm hiệu quả điều trị của Epclusa. Không khuyến nghị sử dụng đồng thời các loại thuốc này với Epclusa (xem phần Cảnh báo). Việc sử dụng đồng thời các thuốc ức chế P-gp hoặc BCRP có thể làm tăng nồng độ huyết tương sofosbuvir hoặc velpatasvir. Các thuốc ức chế OATP, CYP2B6, CYP2C8 hoặc CYP3A4 có thể làm tăng nồng độ huyết tương của velpatasvir. Không dự kiến có tương tác thuốc có ý nghĩa về lâm sàng với Epclusa với các chất ức chế P-gp, BCRP, OATP hoặc CYP450; có thể sử dụng đồng thời Epclusa với các chất ức chế P-gp, BCRP, OATP và CYP.
Bệnh nhân được điều trị với chất đối kháng vitamin K
Do chức năng gan có thể thay đổi trong quá trình điều trị với Epclusa, khuyến cáo theo dõi chặt chẽ giá trị Chỉ số Chuẩn hóa Quốc tế (INR).
Tương tác giữa Epclusa và các loại thuốc khác
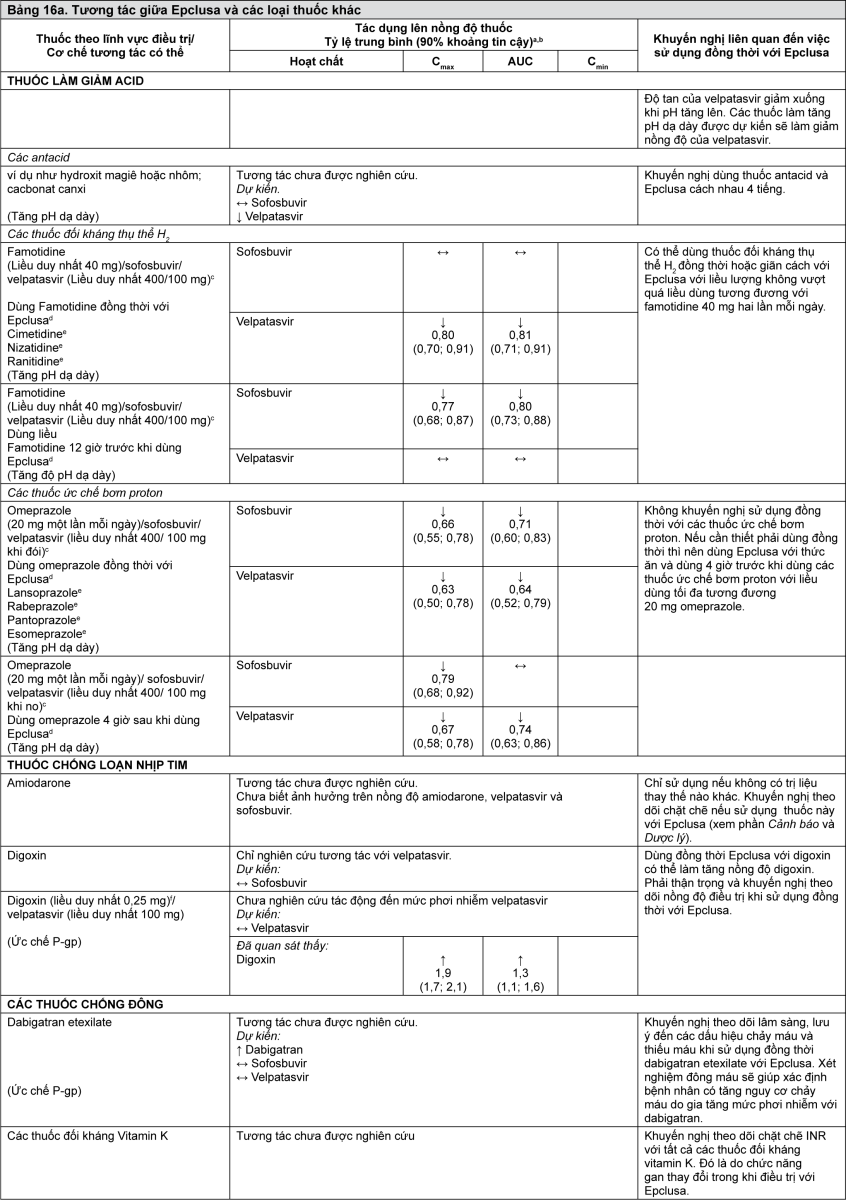
Bảng 16 cung cấp danh sách các tương tác thuốc có ý nghĩa lâm sàng tiềm tàng hoặc đã được xác định (khi khoảng tin cậy 90% [CI] của tỷ lệ trung bình tính theo phương pháp bình phương tối thiểu hình học [Geometric least-squares mean - GLSM] nằm trong khoảng “↔”, vượt lên “↑” hoặc xuống thấp hơn “↓” các biên độ tương tác đã xác định trước). Các tương tác thuốc được mô tả dựa trên các nghiên cứu đã được tiến hành với sofosbuvir/velpatasvir hoặc velpatasvir và sofosbuvir ở dạng các chất riêng rẽ, hoặc là các tương tác thuốc dự đoán có thể xảy ra với sofosbuvir/velpatasvir. Bảng này không phải là danh sách đầy đủ.
- xem Bảng 16a, 16b, 16c & 16d.

Tác dụng ngoại ý
Tóm tắt hồ sơ an toàn
Đánh giá an toàn của Epclusa dựa trên dữ liệu nghiên cứu lâm sàng Giai đoạn 3 được tổng hợp từ các bệnh nhân nhiễm HCV kiểu gen 1, 2, 3, 4, 5 hoặc 6 (mắc hoặc không mắc bệnh xơ gan còn bù) bao gồm 1.035 bệnh nhân dùng Epclusa trong 12 tuần.
Tỷ lệ bệnh nhân dừng điều trị do phản ứng có hại là 0,2% và tỷ lệ bệnh nhân có phản ứng có hại nghiêm trọng là 3,2% đối với những bệnh nhân dùng Epclusa trong 12 tuần. Trong các nghiên cứu lâm sàng, nhức đầu, mệt mỏi và buồn nôn là các phản ứng có hại phổ biến nhất xuất hiện trong khi điều trị (tỷ lệ mắc phải ≥10%) được báo cáo ở những bệnh nhân được điều trị trong 12 tuần với Epclusa. Những phản ứng có hại này và những phản ứng có hại khác được báo cáo với tần suất tương tự ở các bệnh nhân điều trị bằng giả dược so với bệnh nhân được điều trị bằng Epclusa.
Bệnh nhân xơ gan mất bù
Hồ sơ an toàn của Epclusa đã được đánh giá trong một nghiên cứu nhãn mở trong đó bệnh nhân mắc bệnh xơ gan CPT Loại B dùng Epclusa trong 12 tuần (n=90), Epclusa + RBV trong 12 tuần (n=87) hoặc Epclusa trong 24 tuần (n=90). Các biến cố có hại quan sát được nhất quán với các hậu quả lâm sàng dự kiến của bệnh gan mất bù, hoặc hồ sơ độc tính đã biết của ribavirin đối với những bệnh nhân dùng Epclusa kết hợp với ribavirin.
Trong số 87 bệnh nhân được điều trị bằng Epclusa + RBV trong 12 tuần, số trường hợp giảm haemoglobin xuống dưới 10g/dL và 8,5g/dL trong quá trình điều trị lần lượt là 23% và 7%. Ngừng sử dụng ribavirin ở 15% số bệnh nhân được điều trị bằng Epclusa + RBV trong 12 tuần do biến cố có hại.
Mô tả một số phản ứng có hại chọn lọc
Rối loạn nhịp tim
Đã quan sát thấy các trường hợp bị chậm nhịp tim nghiêm trọng và bloc tim khi sử dụng sofosbuvir kết hợp với thuốc kháng vi rút có tác động trực tiếp (DAA), được sử dụng kèm với amiodarone và/hoặc thuốc khác làm chậm nhịp tim (xem phần Cảnh báo và Tương tác).
Báo cáo các trường hợp nghi ngờ phản ứng có hại
Việc báo cáo các trường hợp nghi ngờ phản ứng có hại sau khi cấp phép lưu hành thuốc là điều quan trọng. Việc này cho phép theo dõi liên tục sự cân bằng giữa lợi ích/nguy cơ của thuốc. Các cán bộ y tế được yêu cầu báo cáo bất kỳ trường hợp nghi ngờ phản ứng có hại nào thông qua hệ thống báo cáo quốc gia.
Bảo quản
Bảo quản ở nhiệt độ dưới 300C.
Chỉ để thuốc trong bao bì ban đầu.
Không sử dụng nếu dấu niêm phong trên nắp chai bị rách hoặc mất.
Trình bày/Đóng gói
Viên nén bao phim: lọ 28 viên.
- Abacavir
- Abernil
- Abiiogran
- Acarbose
- ACC
- Acebutolol
- Acenocoumarol
- Acetate Ringer's
- Acetazolamide
- Acetylcystein
- Acetylsalicylic acid
- Aciclovir
- Acid acetylsalicylic
- Acid aminocaproic
- Acid ascorbic
- Acid boric
- Acid chenodeoxycholic
- Acid ethacrynic
- Acid folic
- Acid fusidic
- Acid iopanoic
- Acid ioxaglic
- Acid nalidixic
- Acid pantothenic
- Acid para-aminobenzoic
- Acid salicylic
- Acid tranexamic
- Acid valproic
- Acid zoledronic
- Acitretin
- Aclasta
- Aclon
- Actapulgite
- Actelsar
- Actelsar HCT
- Actemra
- Actilyse
- Acular
- Acupan
- Acuvail
- Acyclovir STADA
- Acyclovir STADA Cream
- Adalat
- Adenosin
- Adenosin Ebewe
- Adipiodon
- Advagraf
- Aerius
- Afinitor
- Agicarvir
- Agifovir-E
- Agilosart
- Agilosart-H
- Agimepzol
- Agimosarid
- Agimstan
- Agimstan-H
- Agiremid
- Agivastar
- Aibezym
- Air-X
- Alaxan
- Albendazol
- Albiomin
- Albumin
- Albumin người Grifols 20%
- Albuminar
- AlbuRx
- Albutein
- Alcuronium chloride
- Aldesleukin
- Alendronat
- Alertin
- Alfa-Lipogamma 600 Oral
- Alfuzosin hydrochlorid
- Algotra
- Alimemazin
- Alimta
- Allipem
- Allopurinol
- Allopurinol STADA
- Aloxi
- Alprazolam
- Alpha Chymotrypsin
- Alpha tocopherol
- Alphachymotrypsin Glomed
- Alphagan-P
- Aluvia
- Alzental
- Amaryl
- Ambroco
- Ambroxol
- Amcinol-Paste
- Amigold
- Amikacin
- Aminocaproic acid
- Aminoleban
- Aminoleban Oral
- Aminosteril N-Hepa
- Amiparen
- Amitriptyline
- Amiyu
- Amlodipine
- Amlor
- Amoxicillin
- Amoxicillin & clavulanate
- Ampicillin
- Amquitaz
- Anaferon for children
- Anargil
- Anaropin
- Andriol Testocaps
- Anepzil
- Anyfen
- Apaisac
- Apidra SoloStar
- Apitim 5
- Aprovel
- Aquaphil
- Arcalion
- Arcoxia
- Aricept Evess
- Arimidex
- Arnetine
- Artrodar
- A-Scabs
- Ascorbic acid
- Asperlican/Candinazol
- Aspilets EC
- Aspirin
- Asthmatin
- Atelec
- Atocib 120
- Atocib 90
- Atosiban PharmIdea
- Atozet
- Attapulgite
- Atussin
- Atropin
- Augbactam
- Augmentin Sachet
- Augmentin SR
- Augmentin Tablets
- Augmex
- Avamys
- Avastin
- Avelox Dịch truyền
- Avelox Viên nén
- Avodart
- Axcel Cefaclor-125 Suspension
- Axcel Cetirizine Syrup
- Axcel Chlorpheniramine
- Axcel Dexchlorpheniramine
- Axcel Dicyclomine-S Syrup
- Axcel Diphenhydramine Paediatric Syrup
- Axcel Erythromycin ES
- Axcel Eviline
- Axcel Fungicort Cream
- Axcel Fusidic acid Cream
- Axcel Fusidic acid-B Cream
- Axcel Hydrocortisone Cream
- Axcel Lignocaine 2% Sterile Gel
- Axcel Loratadine
- Axcel Miconazole Cream
- Axcel Paracetamol
- Axcel Urea Cream
- Axitan
- Azenmarol
- Azicine
- Aziphar
- Azithromycin





